
- •1 Термодинамический расчет
- •1.1 Расчет тепловых эффектов химических реакций
- •1.1.1 Расчет тепловых эффектов при стандартных условиях
- •1.1.2 Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа
- •1.2 Расчет изменения изобарно-изотермического потенциала
- •1.3 Расчет константы равновесия
- •1.3.1 Расчет константы равновесия для идеальных газов
- •1.3.2 Расчет константы равновесия для реальных газов
- •1.4 Расчет равновесного выхода
- •1.5 Последовательность проведения термодинамического расчета химических реакций
- •2 Расчетные методы определения термодинамических свойств
- •3 Пример расчета термодинамических свойств
- •Рекомендации к ведению реакции
- •4 Задания для термодинамического расчета
- •Список литературы
- •Содержание
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РФ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
УФИМСКИЙ ГОСУДАРСТВЕННЫЙ НЕФТЯНОЙ
ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
ТЕРМОДИНАМИЧЕСКИЙ РАСЧЕТ
ХИМИЧЕСКИХ РЕАКЦИЙ
Учебно-методическое пособие для выполнения расчетно-графической
работы студентами специальности 240400 по дисциплине
«Физическая химия»
Салават 2012
ВВЕДЕНИЕ
Термодинамика - наука о взаимопревращениях различных форм энергии и законах этих превращений. Термодинамика базируется только на экспериментально обнаруженных объективных закономерностях, выраженных в двух основных началах термодинамики.
Термодинамика изучает:
Переходы энергии из одной формы в другую, от одной части системы к другой;
Энергетические эффекты, сопровождающие различные физические и химические процессы и зависимость их от условий протекания данных процессов;
Возможность, направление и пределы самопроизвольного протекания процессов в рассматриваемых условиях и различные виды равновесия.
Изучение законов, которые описывают химические и физические равновесия, имеет особое значение в химической термодинамике; их знание позволяет решать, не прибегая к опыту, многие важнейшие задачи, встречающиеся в производственной, проектной и научно-исследовательской работе. Главными задачами являются следующие:
определение условий, при которых данный процесс становится возможным (без совершения работы извне);
нахождение пределов устойчивости изучаемого вещества (совокупности веществ) в тех или иных условиях;
выяснение, каким путем можно уменьшить количество получающихся при реакции нежелательных веществ или даже вовсе избежать их образования, т.е. подавить или устранить побочные реакции;
выбор оптимального режима процесса (температуры, давления, концентрации реагентов) и т.д.
Таким образом, целью термодинамического расчета является выбор оптимальных условий протекания химических реакций с максимальным выходом целевых продуктов. Экспериментальным путем остается лишь найти условия, благоприятствующие протеканию процесса с достаточной скоростью (если термодинамический расчет указывает на принципиальную его осуществимость).
1 Термодинамический расчет
1.1 Расчет тепловых эффектов химических реакций
1.1.1 Расчет тепловых эффектов при стандартных условиях
Тепловым эффектом реакции называется теплота, выделяющаяся или поглощающаяся при реакции, протекающей термодинамически необратимо при равенстве температур начала и конца процесса.
За стандартные условия принимают температуру 298 К и давление 0,1 МПа. Расчеты тепловых эффектов химических реакций основаны на законе Гесса: "Тепловой эффект химических реакций зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути процесса". Закон Гесса применим к процессам, которые проводят при постоянном объеме или давлении.
Тепловые эффекты химических реакций в стандартных условиях можно рассчитать по табличным значениям стандартных теплот образования Н0обр или стандартных теплот сгорания Н0сгор.
Стандартной теплотой образования данного вещества называется тепловой эффект образования 1 моля рассматриваемого вещества из простых веществ, устойчивых в этих условиях.
Стандартной теплотой сгорания данного вещества называется тепловой эффект реакции окисления 1 моля этого вещества кислородом с образованием высших оксидов, входящих в это вещество.
По закону Гесса следует, что тепловой эффект реакции равен разности между стандартными теплотами образования продуктов реакции и исходных веществ с учетом стехиометричемких коэффициентов.
 ,
(1)
,
(1)
где
![]() - тепловой эффект химической реакции
при стандартных условиях,
- тепловой эффект химической реакции
при стандартных условиях,
![]() - стехиометрические коэффициенты.
- стехиометрические коэффициенты.
По закону Гесса тепловой эффект реакции равен разности между стандартными теплотами сгорания исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов.
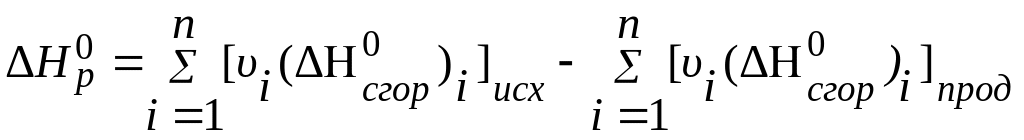 ,
(2)
,
(2)
Если тепловой эффект реакции положительный, то процесс называется эндотермическим, если тепловой эффект реакции отрицательный, то процесс называется экзотермическим.
1.1.2 Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа
Зависимость теплового эффекта химической реакции от температуры выражается уравнением Кирхгофа
 ,
(3)
,
(3)
где
![]() - тепловой эффект химической реакции
при температуре Т,
- тепловой эффект химической реакции
при температуре Т,
![]() - разность теплоемкостей продуктов
реакции и исходных веществ
с учетом стехиометрических коэффициентов.
- разность теплоемкостей продуктов
реакции и исходных веществ
с учетом стехиометрических коэффициентов.
 (4)
(4)
Для
грубых расчетов или для небольшого
интервала температур пренебрегают
зависимостью теплоемкостей веществ от
температуры и рассматривают
![]() как постоянное число. Тогда уравнение
(3) примет вид:
как постоянное число. Тогда уравнение
(3) примет вид:
![]() .
(5)
.
(5)
Для точных расчетов необходимо знать зависимость теплоемкости от температуры для исходных веществ и продуктов реакции, выражаемую уравнением
![]() (6)
(6)
или
![]() ,
(7)
,
(7)
где
![]() -
коэффициенты,
которые определяются опытным путем. Из
уравнений (4), (6), (7) следует:
-
коэффициенты,
которые определяются опытным путем. Из
уравнений (4), (6), (7) следует:
![]() ,
(8)
,
(8)
где
![]() -
разность коэффициентов
-
разность коэффициентов![]() продуктов реакции
и исходных веществ с учетом стехиометрических
коэффициентов.
продуктов реакции
и исходных веществ с учетом стехиометрических
коэффициентов.
 ,
(9)
,
(9)
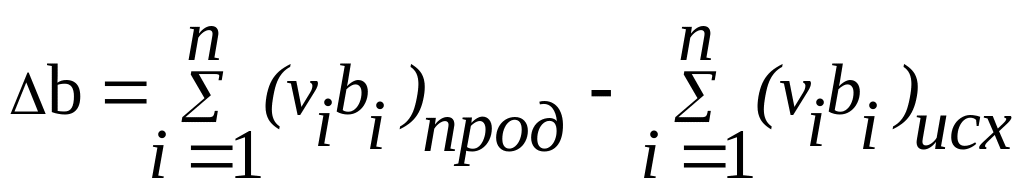 ,
(10)
,
(10)
 ,
(11)
,
(11)
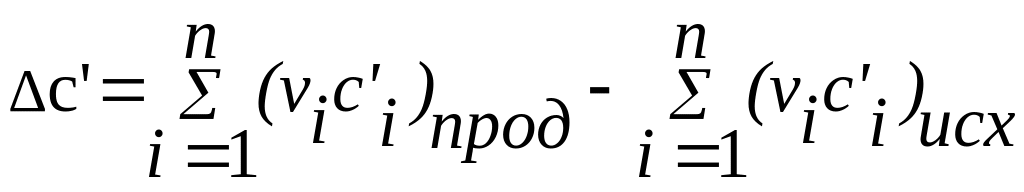 .
(12)
.
(12)
Подставив в уравнение (3) и проинтегрировав его получим
![]() .
(13)
.
(13)
