
- •Содержание:
- •Характеристики элементов.
- •Природные соединения и получение металлов vib-группы.
- •Простые вещества. Физические и химические свойства.
- •Характеристические соединения.
- •Соли кислородсодержащих кислот и комплексные соединения.
- •Металлохимия элементов vib-группы.
- •Применение металлов vib-группы и их соединений.
- •Список литературы.
- •Угай я.А. Неорганическая химия. 1989год
Характеристические соединения.
В соединениях с кислородом хром проявляет степени окисления +2, +3, +4, +6 и образует соответствующие оксиды СгО, Сг2O3, СгO2 и СгO3. Для молибдена известны оксиды МоO2, Мо2O6 и МоO3, отвечающие степени окисле ния этого элемента +4, +5 и +6. Для вольфрама известны всего лишь два оксида: WO2 и WO3. Таким образом, в ряду Сг—Мо—W наблюдается, как и в предшествующих В-группах, повышение ста бильности высших степеней окисления и уменьшение разнообразия соединений с кислородом.
Оксид хрома (+3) представляет собой порошок черно-зеленого цвета, нерастворимый в воде, кислотах и щелочах. Удобным лабораторным способом получения Сг2O3 является термическое разложение дихромата аммония (NH4)2Cr2O7 по схеме
(NH4)2Cr2O7 = Сг2O3 + N2 + 4Н2O
Поскольку Сг2О3 нерастворим, его гидроксид Сг(ОН)3 можно получить лишь косвенным путем, например, действуя раствором аммиака на раствор соли Сг (+3):
Cr2(SO4)3 + 6NH4OH = 2Cr(OH)3 + 3(NH4)2SO4
Осаждение темно-зеленого геля Cr(OH)s начинается при рН~5,3 т. е. в кислой среде, что свидетельствует о его слабо выраженном основном характере. Гидроксид хрома обладает амфотерными свойствами и легко растворяется в избытке раствора щелочи. Со структурной точки зрения гидроксид хрома (+3), имеющий переменный состав Сг2O3-xН2O, обладает пространственным строением многоядерного комплекса. Структурными единицами его являются октаэдры [Сг(ОН)6]3_ и [Сг(Н2O)6]3+, связанные между собой оловыми ОН-мостиками. Относительное количество лигандов ОН- и Н2O может меняться в зависимости от условий получения гидроксида хрома. Равновесия между различными формами гидроксо- и аква-комплексов для Сг (+3) представлены схемой Cr(OH)3.xH2O
он- он-
п[Сг(Н2O)в]3+ = [Сг(ОН)3(Н2O)]0n = п[Cr(ОН)в]3-
кислая среда Н+ нейтральная среда Н+ щелочная cреда
Как следует из этой схемы, для Сг (+3) характерным является координационное число 6. Оксид хрома (+3) и соответствующий гидроксид по свойствам сильно напоминают соединения алюминия А12O3 и А1(ОН)3. В частности, при сплавлении Сг2O3 с оксидами или карбонатами щелочных металлов образуются метапроизводные типа М'СгO2, подобные метаалюминатам. Подобное же взаимодействие с производными щелочно-земельных металлов, магния, железа (+2) приводит к образованию хромовых шпинелей МoСг2O4, относящихся к тому же классу соединений, что и собственно шпинель MgAl204. Свободная НСЮ2 представляет собой синевато-серые кристаллы. Она теряет воду при 430°С с сильным саморазогреванием. В водных растворах метапроизводные (хромиты) не существуют вследствие образования гидроксокомплексов, например:
Сг(ОН)3 + 3NаОН = Na3[Cr(OH)6]
Из характеристических соединений хрома в низшей положительной степени окисления +2 известны черный оксид СгО и соответствующий гидроксид Сг(ОН)2 желтого цвета. Гидроксид хрома (+2) можно получить путем взаимодействия со щелочами дихлорида хрома СгС12 в отсутствие кислорода воздуха. Сг(ОН)2 обладает только основными свойствами и легко растворяется в кислотах с образованием соответствующих солей Сг (+2). Осторожным обезвоживанием Сг(ОН)а в восстановительной атмосфере можно получить оксид СrO, который при небольшом нагревании диспропорциони-рует:
ЗСrO = Сг2O3+Сг
Поскольку степень окисления +2 для хрома неустойчива, соответствующие производные являются сильными восстановителями. Так, Сг(ОН)2 легко окисляется кислородом воздуха, а ион Сг2+ способен, подобно активным металлам, восстанавливать водород даже из воды, переходя в производные хрома (+3). Хотя степени окисления +2 и +3 для молибдена и вольфрама известны (например, в галогенидах), тем не менее кислородные соединения в этих степенях окисления не образуются в силу чрезвычайной неустойчивости и склонности их к диспропорционированию.
В степени окисления +4 характеристические соединения существуют для всех трех элементов VIB-группы. Известны черный оксид СгO2, коричневато-фиолетовый МоO2 и коричневый WO2. CrO2 представляет собой фазу переменного состава с дефектами в подрешетке кислорода (твердый раствор вычитания СгO2) Кристаллизуется в решетке рутила TiO2. Ионизация кислородных вакансий приводит к резкому возрастанию концентрации свободных электронов в кристалле и поэтому СrO2-х обладает высокой электрической проводимостью и даже металлическим блеском. Диоксиды хрома и его аналогов нерастворимы в воде, трудно растворимы в кислотах и щелочах. Отвечающие им гидроксиды не известны. В то же время высокотемпературным синтезом могут быть получены некоторые соли, в которых элементы VIB-группы в степени окисления +4 образуют оксоанионы. Таким образом получены Ва2СгO4, Ва3СгO5, К2МоO3 и т. п. Отсюда следует, что в степени окисления +4 оксиды хрома и его аналогов проявляют скорее слабо выраженные кислотные, чем основные функции. Вообще же степень окисления +4 ярче проявляется у галогенидов и халькогенидов.
Наиболее типичной степенью окисления молибдена и вольфрама и одной из важнейших для хрома является +6. Как отмечено выше, Мо03 и W03 получаются непосредственным термическим окислением металлов газообразным кислородом. СгO3 непосредственно из элементов получить нельзя. Он кристаллизуется в виде ярко-красных игл при действии на раствор дихромата калия К2Сг2O, концентрированной серной кислотой:
К2Сг2O7 + H2SO4 = K2SO4 + 2CrO3 + H2O
СгO3 обладает цепочечной структурой из тетраэдров [CrOJ, соединенных ребрами (подобно цепочечным силикатам). МоO3 и WO3 имеют координационные структуры, построенные из октаэдров [ЭОв], связанных между собой вершинами. Низкая температура плавления СгO3 (187 °С) свидетельствует о заметном ван-дер-вааль-совом вкладе между цепочками, а высокие температуры плавления МоO3 и WOs (735 и 1473 °С) подтверждают их координационную структуру. В отличие от СгO3 высшие оксиды молибдена и вольфрама являются дальтонидными фазами переменного состава, дефектными по кислороду. Вследствие образования при нагревании кислородных вакансий, влияющих не только на электрические, но и на оптические свойства, фазы МоO3 и WO3-x изменяют свой цвет: первая желтеет, а вторая становится оранжевой.
С химической точки зрения СгO3, МоO3 и WO3 представляют собой типичные кислотообразующие оксиды соответствующих кислот: хромовой Н2СгO4, молибденовой Н2МоO4, вольфрамовой H2WO4. СгO3 легко растворяется в воде, образуя хромовую кислоту. Растворимость МоO3 и WO3 в воде составляет соответственно 0,4 и 0,02 г/л. Резкое уменьшение растворимости в ряду СrO3—Мо03—WOs косвенно свидетельствует об ослаблении кислотных свойств оксидов в этом ряду, хотя стабильность высшей степени окисления в этом направлении увеличивается. Действительно, первая константа диссоциации Н2СrO4 равна 2Cr-1, т. е. она является кислотой средней силы, а аналогичная величина для Н2Мо04 равна 10-2. Интересно отметить, что для молибденовой кислоты определена, хотя и небольшая, но все же заметная константа диссоциации по основному типу:
H2Mo04=MoO2+2 + 20H-, КD=10-13
Этим кислотам отвечают многочисленные соли: хроматы, молиб-даты и вольфраматы. Обычно соли хромовой кислоты окрашены в желтый цвет, свойственный иону СгO-1, соли молибденовой и вольфрамовой кислот бесцветны.
Одной из характерных особенностей элементов VIB-группы в высшей степени окисления является способность к образованию полисоединений. Если для самого хрома свойственно образование лишь производных изополикислот, то для Мо и W существуют и производные гетерополикислот. Если в разбавленных водных растворах для хрома характерно образование иона CrOf-, то по мере повышения концентрации раствора происходит переход сначала в дихромат-ион СrО,-, затем в трихромат СгяО2-10 и в тетрахромат Cr4O2-13. Общая формула полихромат-анионов СгпO2-3n+1. Сами изо-полихромовые кислоты известны только в растворах и в свободном состоянии не выделены. Однако их соли довольно многочисленны. Наибольшее значение имеют дихроматы; они в отличие от желтых хроматов имеют красно-оранжевую окраску и лучше растворимы в воде. Растворы дихроматов имеют кислую реакцию, что объясняется не гидролизом по катиону, а взаимодействием дихромат-иона с водой по схеме
H2O + Cr2O = 2Н++2СгО2-4
Отсюда следует, что в кислой среде равновесие смещается влево, а при разбавлении водой или в щелочной среде (связывание ионов Н+) — вправо. Таким образом, можно осуществлять взаимные превращения хроматов и дихроматов, например, в соответствии с уравнениями:
К2Сг2O7 + 2KOH = 2К2СlO4 + Н20 2К2СlO4 + H2SO4 = K2Cr2O7 + K2SO4 + Н2O
Следует отметить, что по мере усложнения структуры комплексного аниона происходит углубление окраски от желтой (СгO42-) через красно-оранжевую (Сг2O2-) к красной (Сг3O2-) и краснокоричневой (Cr4O2-). Сточки зрения теории кристаллического поля* такое изменение цвета связано с уменьшением энергии расщепления в тетраэдрическом поле лигандов при образовании ионов сложной структуры, в которых атомы хрома связаны между собой через кислородные мостики. При этом мостиковый атом кислорода принадлежит одновременно двум координационным сферам, что и снижает эффективную энергию расщепления.
Все хроматы являются сильными окислителями, причем наиболее энергичное окислительное действие они оказывают в кислой среде, восстанавливаясь при этом до производных Сг (+3). Именно по этой причине дихроматы и полихроматы, устойчивые в кислотной среде, являются более энергичными окислителями. Так, на холоду они окисляют HI, H2S, H2SO3 и их соли, а при нагревании НВг и даже НС1:
КгСг2O7 + 14НС1 = 2KC1 + 2СгС13+ЗС12 + 7Н2O
Для соединений хрома (+6) характерно взаимодействие в щелочной среде с перок'сидом водорода. При этом получается пероксид Сг05 синего цвета:
Н2СгO4 + 2Н2O2 = ЗН2O + СгO5
Образуются и пероксокислоты хрома Н2Сг2O12 и Н3СгO8. Все перо-ксохроматы неустойчивы, являются сильнейшими окислителями.
Как отмечено выше, для молибдена и вольфрама в высшей степени окисления также свойственно образование изополикислот, причем эта тенденция у Мо и W выражена более ярко, чем у хрома. Так, для Мо (+6) и W (+6) известны соединения (NH4)eMo7O24 или Na10W2O41. Это уже настоящие изополисоединения с длинными и разветвленными цепями, в которых атомы Мо и W «сшиты» между собой через кислородные мостики. Но помимо таких соединений молибден и вольфрам образуют и гетерополикислоты и их соли. В частности, известно такое гетерополисоединение, как фосфомолибдат аммония (NH4)3(PMo2O40). Подобные соединения можно получить, заменив в ортофосфате аммония (NH4)3P04 все 4 атома кислорода на группировки Мо30|^. Таким образом, формулу этой соли можно представить как (NH4)3 [P(Mo3O10)4]. Это соединение является типичным представителем солей гетерополи-кислот типа Mj[P(33O10)4]. Структурной единицей сложных анионов изо- и гетерополикислот молибдена и вольфрама является октаэдр [ЭO6]. Эти октаэдры могут соединяться между собой вершинами или ребрами, образуя сложные каркасы. По мере усложнения состава аниона связь с атомами водорода во внешней сфере комплекса становится более полярной вследствие перераспределения электронной плотности и сила поликислот возрастает. Однако в целом, как отмечено выше, в ряду Сг—Мо—W кислотный характер высших оксидов и гидроксидов быстро ослабевает. В частности, Н2Мо04 и H2W04 проявляют заметные признаки амфотерности, что выражается в их взаимодействии с сильными кислотами:
ЭO2(ОН)2+2НС1 = ЭO2С12 + 2Н20
Эта реакция может быть проведена и с Н2СгO4, однако в этом лучае равновесие сильно смещено влево. Соединения ЭO2С12 в водных раст ворах диссоциируют по схеме ЭОС12=ЭО2+2 + 2С1-
Комплексный катион ЭO2+ называют хромил, молибденил или вольфрамил. Он является продуктом частичного гидролиза соответствующего галогенида ЭГв. Хлористый хромил СгO2С12 — производное хромовой кислоты (подобно хлористому сульфурилу SO2C12 — аналогия между элементами главной и побочной подгрупп в высшей степени окисления):
СгO2С12 + 2Н2O==Н2СгO4 + 2НС1
В то же время аналогичные производные молибдена и вольфрама обладают более ярко выраженным солеобразным характером, что подтверждает тенденцию к ослаблению кислотных свойств в ряду Сг—Mo—W в высшей степени окисления.
Действием пероксида водорода в щелочной среде на растворы молибдатов и вольфраматов можно получить пероксопроизводные общей формулы Ме2ЭОп, где п=5—8. Со структурной точки зрения они аналогичны соответствующим производным хрома и содержат от одной до четырех пероксогрупп —О—О—, замещающих атомы кислорода в анионах ЭO42-. Это твердые вещества, окрашенные в яркие тона от красного до желтого. При нагревании разлагаются со взрывом, а при комнатной температуре медленно отщепляют кислород, благодаря чему обладают сильными окислительными свойствами. В ряду Сг—Мо—W устойчивость пероксосоединений, отвечающих высшей степени окисления, заметно возрастает.
Одной из интересных особенностей химии молибдена и вольфрама является существование соединений с непрерывно меняющейся степенью окисления элемента. Так, при осторожном восстановлении водных растворов молибденовой или вольфрамовой кислоты с помощью S02, H2S, HI, N2H4 и т. п. образуются так называемые молибденовые или вольфрамовые сини, имеющие в растворе интенсивную голубую окраску. Продукты восстановления представляют собой смесь различных веществ, в которых степень окисления Мо и W непрерывно изменяется от +4 до +6. Эти продукты могут быть выделены как индивидуальные вещества в виде безводных промежуточных оксидов, таких, как Мо9O2в, MosO23, или в виде гидрат-ных форм, например MoO288*H2O и т. п.
Оксид Мо9O28 Мо8O23 МоO2,88*Н2O НМо3O9 МоO2ОН
Формальная степень
окисления молибдена +5,66 +5,75 +5,76 +5,66 +5,0
Таким образом, эти «синие оксиды» представляют собой фазы переменного состава и занимают промежуточное положение между твердыми растворами и собственно химическими соединениями.
Для вольфрама известен еще один тип твердых соединений переменного состава — так называемые «вольфрамовые бронзы». Они представляют собой вольфрама™ щелочных и щелочно-земельных металлов с переменным содержанием катиона, например NaxWO3, где 0<x<1. Если х=0, то это просто оксид вольфрама WOs, в котором степень окисления вольфрама равна +6. Если же х—1, то это соединение NaWO3, в котором степень окисления вольфрама равна +5. Тот факт, что х непрерывно меняется от 0 до 1, свидетельствует о непрерывном изменении степени окисления W в ряду этих соединений. Последнее обстоятельство имеет принципиальное значение не только потому, что лишний раз подчеркивает формальность понятия «степень окисления», но и потому, что это очень редкий случай существования переменного состава у тройных соединений.
При непрерывном изменении состава вольфрамовых бронз непрерывно меняются и их свойства. Чем ближе х к единице (NaWO3), тем сильнее выражены металлические свойства. Так, соединение Na0,9WO3 обладает золотистым цветом, характерным металлическим блеском, высокой электрической проводимостью и теплопроводностью, что и дало основание назвать эти соединения бронзами, хотя ничего общего со сплавами на основе меди эти фазы не имеют. По мере уменьшения содержания катионообразователя свойства становятся все более неметаллическими, вплоть до проявления диэлектрического характера у WO3. Структурными единицами кристаллов вольфрамовых бронз являются радикалы WO3, образующие кубическую решетку. В пустотах кристаллической решетки находятся внутренние атомы катионообразователя (Li, Na, К, Rb, Cs, Са, Ва, Tl, Pb). Ионизация внутренних атомов приводит к делокали-зации электронов в пределах всей решетки, что формально снижает степень окисления вольфрама пропорционально содержанию катионообразователя. Наличие делокализованных электронов и придает кристаллу металлические свойства.
Соединения с другими неметаллами. Фтор как наиболее энергичный окислитель способен образовывать высшие галогениды ЭЁ6, из которых CrF6 — твердое вещество, MoFe — легкокипящая жидкость, а wFe — газ, что свидетельствует об увеличении тенденции к образованию молекулярных структур и связано с ослаблением металлических свойств в ряду Сг—Mo—W. Наибольшее число фторидов образует хром, для которого реализуются все степени окисления от +2 до +6 (в том числе и нехарактерная +5, не наблюдаемая в ряду оксидов). Низшие фториды CrF2 и CrF3 солеобразны и тугоплавки. У молибдена, и особенно у вольфрама число известных фторидов значительно меньше, поскольку для них характерны высшие степени окисления. Ни один из фторидов Мо и W не является солеобразным. Кристаллический MoF5 является тетрамером (MoF5)4 и изоструктурен NbF5 и TaF5, в чем проявляется горизонтальная аналогия в рядах переходных металлов. Путем осторожного восстановления высших фторидов удается получить тетрафториды MOF4 и WF4, а также MoF3. Последний изоморфен трифторидам ванадия, хрома и железа.
В ряду хлоридов хрома и его аналогов наиболее ярко видна стабилизация высших степеней окисления от хрома к вольфраму. Хлор способен окислить хром только до СгС14, молибден — до МоС15, а вольфрам — даже до высшего хлорида WC1».
Низшие хлориды хрома СгС12 и СгС13 — типичные солеобразные соединения. Первый из них образуется при растворении хрома в соляной кислоте без доступа воздуха. СгС12 — бесцветное кристаллическое вещество, гигроскопичное и хорошо растворимое в воде. Из раствора выделяется в виде кристаллогидрата СгС12-4Н20, который следует рассматривать как аквакомплекс [Сг(Н2O)4]С12. Хлорид хрома (+3) также образует кристаллогидрат СгС13-6Н20, который представляет собой аквакомплекс [Сг(Н2О)0]С13 сине-фиолетового цвета.
В отличие от низших хлоридов хрома МоС12 и WC12 не являются солеобразными соединениями, а представляют собой так называемые
Рис. Структура
окта-эдрического кластера
[Мо6С18]4+
Большой интерес представляет сопоставление свойств и структуры таких комплексных ионов, как [Э2С19]3~. В противоположность парамагнитному [Сг2С19]3- аналогичные по составу ионы на основе молибдена и вольфрама диамагнитны и значительно более прочны. Причина этого различия заключается в разной структуре и разном характере связей в рассматриваемых ионах. Строение парамагнитного комплекса [Сг2С19]3- представлено ниже:
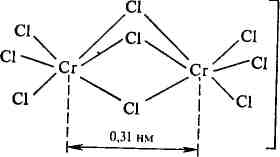
Неспаренные электроны у каждого иона Сг3+ (по 3 электрона) обеспечивают парамагнетизм комплексного иона в целом. Расстояние между атомами хрома в этом комплексе довольно велико и составляет 0,31 нм. Таким образом, комплекс [Сг2С19]3- не является кластером. Аналогичные комплексные ионы на основе Мо и W [Мо2С19]3_ и [W2C19]3_ отличаются от [Сг2С1„]3_ значительно меньшим расстоянием между атомами металла, несмотря на то, что размеры самих атомов больше. Так, расстояние W—W в таком комплексе равно всего лишь 0,24 нм. Это обусловлено тем, что более удаленные от ядра и более рыхлые валентные 4d- или 5d-орбитали соседних атомов металла, содержащие по одному электрону, перекрываются по обменному механизму, образуя тройную ковалентную связь. Именно поэтому эти комплексы диамагнитны. Таким образом, комплексы [Мо2С19]3_ и [W2C19]3~ в отличие от [Сг2С1„]3~ представляют собой кластеры с непосредственной связью Ме = Ме

0,24 нм
Бром с металлами рассматриваемой группы образует соединения, в общем напоминающие аналогичные производные хлора. При этом, однако, в силу несколько меньшей окислительной активности брома высший бромид молибдена отвечает формуле МоВг4 (против МоС15 и MoF6). Иод как наименее активный окислитель среди галогенов образует соединения с еще меньшими степенями окисления катионообразователя: сравнительно тугоплавкие Сг13 и Сг12, обладающие солеобразным характером, и соединения Э12, Э13 и Э14 для молибдена и вольфрама. При этом следует подчеркнуть, что низшие бромиды и иодиды тяжелых аналогов — молибдена и вольфрама (ЭГ2), как и хлориды этих элементов, представляют собой кластеры и в этом отношении заметно отличаются от аналогичных производных хрома.
Все сульфиды металлов подгруппы хрома (CrS, Cr2S3, 3S2 и 3S3 для Мо и W) достаточно термически устойчивы и обладают полупроводниковыми свойствами, что подчеркивает их неметаллическую природу. Все они представляют собой координационные кристаллы и обладают переменным составом, что особенно характерно Для низших сульфидов. В этом отношении они заметно отличаются от галогенидов, которые нередко образуют или молекулярные структуры, или кластеры. Взаимодействие хрома, молибдена и вольфрама с селеном и теллуром протекает менее энергично, причем вольфрам с теллуром соединений не образует, а в остальных случаях в системах образуется небольшое количество соединений, отвечающих лишь наиболее стабильным степеням окисления (CrX, Cr2X3, WSe2s WSe3, MoTe2, MoTe3).
Продукты взаимодействия элементов подгруппы хрома с фосфором, мышьяком и сурьмой резко отличаются от галогенидов и халь-когенидов тем, что их формульный состав не отвечает правилам формальной валентности, т. е. фосфиды, арсениды и стибиды хрома и его аналогов принадлежат к классу аномально построенных дальтонидов, содержащих «анион-анионные» и «катион-катионные» связи. Наиболее характерны для фосфидов соединения состава Э3Р, ЭР и ЭР2. Образование моно- и дифосфидов вообще весьма характерно для переходных металлов. Для таких фосфидов при всем разнообразии их состава можно отметить общие закономерности, заключающиеся в том, что по мере увеличения относительного содержания фосфора понижаются температуры плавления, увеличивается склонность к термической диссоциации с отщеплением летучего компонента (фосфора), уменьшается ширина области гомогенности и при этом свойства меняются от металлических у фосфидов типа Э3Р и ЭР до полупроводниковых у высших фосфидов ЭР,.
Продукты взаимодействия металлов подгруппы хрома с кремнием по формульному составу и структурным особенностям во многом напоминают пниктогениды. Для всех трех элементов существуют дисилициды 3Si2, представляющие собой тугоплавкие соединения, обладающие полупроводниковыми свойствами. Дисилициды устойчивы к агрессивным средам при повышенных температурах. Существование низших силицидов для вольфрама и молибдена точно не установлено. Напротив, в системе Сг—Si установлено существование соединений CrSi, Cr2Si, Cr3Si, первое из которых является вырожденным полупроводником, а два других — металлиды. Таким образом, в ряду силицидов хрома наблюдается та же закономерность, что была отмечена для фосфидов: с увеличением атомной доли ани-онообразователя наблюдается переход от металлических свойств к полупроводниковым, что обусловлено изменением характера химической связи путем замены «катион-катионных» связей у низших силицидов на «анион-анионные» у высших.
Строго говоря, пниктогениды и силициды не относятся к типичным соединениям металлов с неметаллами, таким, как галогениды, оксиды и халькогениды. Эти соединения не подчиняются правилу формальной валентности. С другой стороны, эти соединения неправомерно рассматривать в рамках металлохимии, поскольку многие из них обладают неметаллическими свойствами. Таким образом, пниктогениды и силициды элементов подгруппы хрома в определенном смысле представляют собой промежуточный класс соединений, переходный между объектами химии неметаллических фаз и металлохимии, что лишний раз подчеркивает условность любой классификации применительно к реальным объектам.
