- •Основные виды кристалических решеток металлов и сплавов, виды твердых растворов
- •Дефекты кристаллического строения
- •Точечные дефекты
- •Линейные дефекты
- •Поверхностные дефекты
- •Понятие о диаграммах фазового равновесия систем. Цель их существования.
- •Структура литого слитка:
- •Диаграмма Fe-c, Al-Cu, Cu-Zn.
- •Общая классификация металлических материалов.
- •Черные металлы в свою очередь можно подразделить следующим образом:
- •Цветные металлы подразделяются на:
- •Легированная сталь
- •Закалка с полиморфным и без полиморфного превращения.
- •Этапы распада пересыщенного твердого раствора при отпуске и старении
Диаграмма Fe-c, Al-Cu, Cu-Zn.
Начало изучения диаграммы состояния системы железо – углерод (Fe-C) связано с открытием критических точек в стали Д. К. Черновым в 1868 г.
На рис. приведена полная диаграмма состояния системы
(стабильная система железо-углерод Fe—Сгр и метастабильная система железо - цементит Fe—FeC).
Метастабильная система Fe—Fe3C. Перитектическое превращение δ+ж↔γ протекает при 1494±2°С.
Предельная концентрация углерода в δ-фазе (точка Н) отвечает 0,1 % (по массе), или 0,46% (ат.).
Для точки A приняты значения 0,16% (по массе), или 0,74% (ат.), для точки В — значения 0,51% (по массе), или 2,33% (ат.). По данным термического анализа , линия ликвидус δ-фазы АВ — почти прямая, точке В соответствует 2,47% (ат.), предельная растворимость углерода в δ-Feсоставляет 0,5 % (эт.). Температура перитектической горизонтали равна 1496±2°С, точке 1 отвечает 0,18 % (но массе), или 0,83 % (эт.).
Кривая ликвидус аустенита ВС, установленная по данным Руэра, Хондо, Эдкока, Умино и др.
Предельная растворимость углерода в γ-Fe при 1147°С составляет 2,14% (по массе), или 9,2% (ат.) ; при 1150°С 2,02% (по массе), или 8,7 % (ат.).
Кривая ликвидус цементита CD экспериментально не фиксируется. Первичный цементит выделяется только при закалке расплавов, содержащих до 5,5 % (по массе) С, а при нагреве белых заэвтектических чугунов цементит разлагается до плавления (Fe3C->Fe+Crp) . По расчетным данным, виртуальная Температура плавления цементита оценивается равной 1200—1450 °С .
Возможно, цементит испытывает инконгруэнтное разложение при 1250—1300° С.
В высокоуглеродистых сплавах, содержащих более 6,7 % (по массе) С после закалки из жидкого состояния в медную изложницу и ледяную воду наблюдали только Fe3C; других карбидов не обнаружено . Таким образом, метастабильная система при нормальном давлении ограничена цементитом. При повышении давления стабилизируются высшие карбиды Fe7C3, Fe2C и Салм, однако при давлении 0,1 МПа выделение карбидов FeхC (Fe2C) наблюдали лишь при низкотемпературном отпуске закаленной стали.
Температура эвтектической горизонтали ECF принята равной 1147°С, эвтектике (точке С) соответствует 4,30%
(по массе), или 17,28 % (ат.) С .
Превращение у↔а (A3, кривая GS), исследованное многими авторами, также подтверждено последующими работами.
Эвтектоидная точка, находится при 723 °С и 0,76 % (по массе), или 3,44% (ат.). растворимость цементита в α-Fe(кривая PQ) очень мала и составляет 0,02% (по массе), или 0,095 % (ат.) растворимость цементита в a-Feпри 723 °С равна 0,025 % (по массе).
Кристаллическая структура. Феррит имеет о. ц. к. структуру a-Fe. Период решетки a-Feравен 0,2862 им при 20 °С и линейно возрастает до 0,2899 нм при 910 °С . При 769 °С (точка Кюри) ферромагнитное a-Feпереходит в «немагнитное α-Fe» (точнее, в упорядоченное антиферромагнитное β-Fe) . Вследствие малой растворимости углерода в a-Fe[0,02 % (по массе)] период решетки Тk-феррита практически такие же, как и чистого a-Fe. Атомы углерода в феррите занимают преимущественно октапоры. Выше 1392 °С γ-Fe превращается в парамагнитную δ-фазу, существующую при 1392—1536 °С. Период решетки о. ц. к. δ-Fe равен 0,2925 нм при 1392 °С и линейно растет до 0,2935 нм при 1536 °С . Температурная зависимость периода решетки для α-(β-) и γ-Fe различны. Период решетки δ-феррита с повышением температуры увеличивается сильнее, чем α (β)-фазы и, по-видимому, растет с увеличением содержания углерода.
Аустенит имеет г. ц. к. структуру γ-Fe. Период решетки γ-Fe линейно возрастает от 0,3637 нм при 911 °С до 0,368 нм при 1390 °С . углерод растворяется в γ-Fe в виде С4+ и занимает октапоры, образуя твердые растворы внедрения. С увеличением содержания углерода в аустените период решетки γ-фазы увеличивается.
Цементит Fe3C имеет ромбическую структуру .Периоды решетки: а=0,45244±0,0005 нм, b = 0,50885±0,0005 нм, с=0,67431± ±0,0005 нм; Температура перехода цементита из ферромагнитного в парамагнитное состояние (Тс) равна 215°С .
Карбид Fe7C3 получен только при высоких давлениях. Он имеет гексагональную структуру типа Сr7С3.
Периоды решетки а=0,6882 нм, с= 0,4540 нм. Установлено существование метастабильного карбида Fe2C
(ε-карбид), выделяющегося при отпуске стали. При 150—200°С из закаленной стали выделяется ε-карбид с гексагональной решеткой, имеющей периоды а=0,627 нм, с=0,214 нм. Высшие карбиды весьма неустойчивы и при построении диаграммы состояния при нормальных условиях не учитываются.
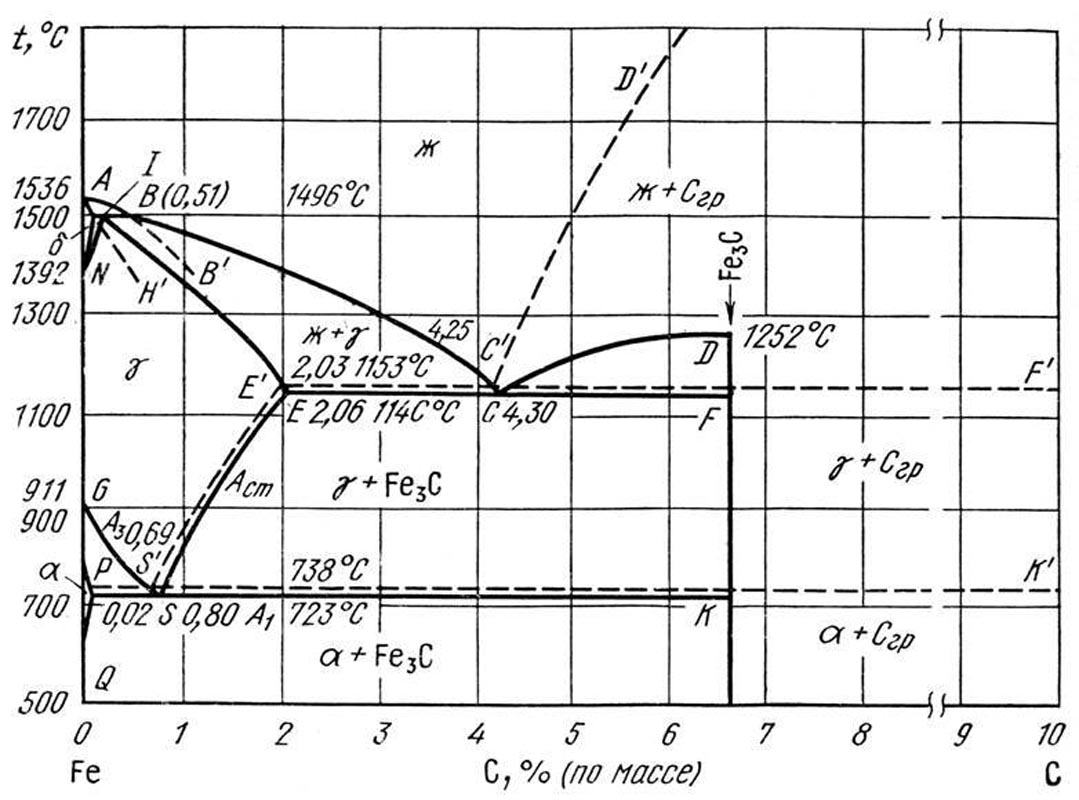
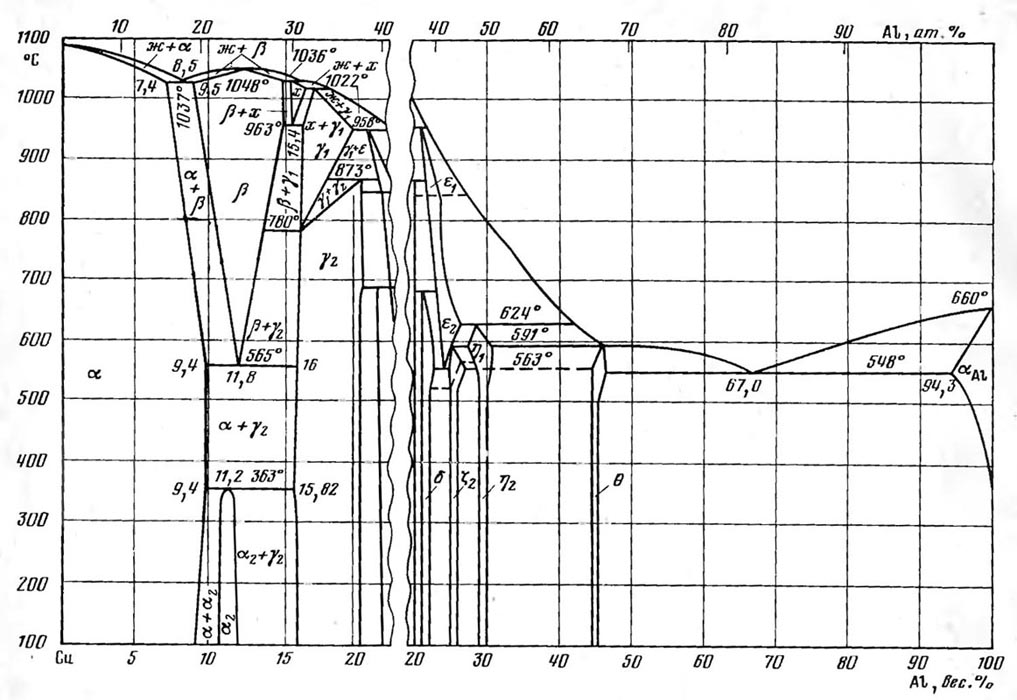
Диаграмма состояния системы медь—алюминий (Al-Cu) подробно исследована во всей области концентраций сплавов. Состав жидкой фазы в эвтектической точке соответствует 8,5 вес.% А1. При температурах 1036° и 1022° протекают перитектические реакции. Фаза х существует только в области высоких температур 1036—963°. Фаза β кристаллизуется из расплава по кривой с максимумом, который соответствует температуре 1048° и составу сплава, содержащего 12,4 вес.% Аl. В твердом состоянии имеет место несколько эвтектоидных и перитектоидпых превращений. При температуре 963° Фаза х распадается. В эвтектоидкой точке содержание алюниния соответствует 15,4 вес. %. Концентрационные пределы области гомогенности а2-фазы точно не установлены. Существование а2-фазы объясняет аномальный ход температурной кривой удельной теплоемкости при температуре около 300°, наблюдаемый в однофазных (а) и двухфазных сплавах.
Фаза a — твердый раствор на основе меди охватывает широкую область составов (до 9 вес. % Al), причем с понижением температуры растворимость алюминия в меди повышается. По данным измерения микротвердости при температурах 500, 700, 800 и 900° она составляет 9,4; 8,8; 8,2 и 7,8 вес.% соответственно. При 1037° растворимость Al в твердой меди составляет 7,4 вес.%
Фаза а имеет гранецентрированную кубическую решетку, аналогичную решетке чистой меди, параметр которой увеличивается с повышением содержания алюминия. Фаза β представляет собой твердый раствор на основе соединения Си3А1 (12,44 вес. % А1).
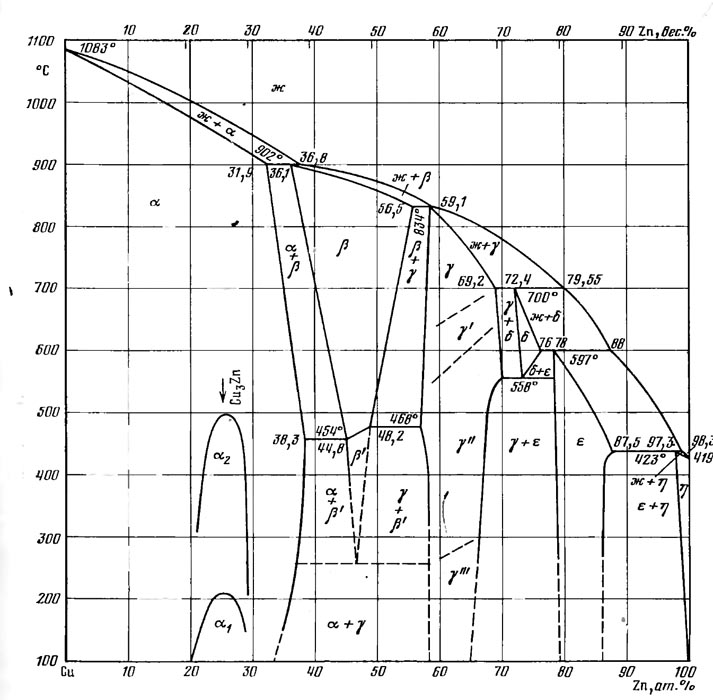
В системе Cu—Ζn существуют шесть фаз. Фаза (Cu) кристаллизуется из жидкости в интервале температур от температуры затвердевания Cu до 902 °С и при концентрациях до 36,8 % (ат.) Ζn. В твердом состоянии в области (Cu) установлены превращения, указывающие на образование соединения с формулой Cu3Zn, существующее в двух модификациях: α1 и α2 .
Фазы β, γ, δ, ε, (Ζn) образуются по перитектическим реакциям.
Область фазы β ограничена областью концентраций 36,1 % (ат.) Ζn при температуре 902 °С, 56,5 % (ат.) Ζnпри 834 °С; 48,2 % (ат.) Ζnпри 468 °С и 44,8 % (ат.) Ζnпри 454 СС. В интервале температур 454—468 °С происходит упорядочение фазы β: β ↔ β'. Фаза β' распадается по эвтектоидной реакции β' ↔ (Cu) + γ'" (НТ) при температуре -255 °С. Эвтектоидный распад фазы β' происходит при температуре выше100 °С.
Фаза γ имеет широкую область гомогенности, и максимально протяженность ее при температуре 558 °С составляет 13 % (ат), фаза γ существует в четырех модификациях но дотемператур 250—280 °С стабильна фаза γ'", выше 280 °С устойчива фаза γ", которая при температурах 550—650 °С переходит в фазу γ', выше 700 °С существует высокотемпературная модификация γ.
Фаза δ существует в узком температурном 700—558 °С и концентрационном интервалах и при температуре 558 °С претерпевает распад δ ↔γ" + ε.
Область ε
фазы находится в пределах концентраций
78 % (ат) Ζn
при температуре 597 °С и 87,5 % (ат.) Ζn
при температуре 423 °С. Фаза ε
стабильна до комнатной температуры.
Растворимость Ζnв
(Cu)
сначала увеличивается от 31,9 % (ат) при
температуре 920 °С до 38,3 % (ат.) при
температуре 454 °С, а затем понижается и
составляет 34,5 % (ат.) при температур. 150
°С и 29 % (ат.) при 0 °С.