- •Введение
- •1. Упругие волны
- •1.1. Волновые процессы Продольные и поперечные волны
- •1.2. Уравнение бегущей волны. Фазовая скорость. Волновое уравнение
- •Учитывая (1.3), уравнению (1.2) можно придать вид
- •Предположим, что при волновом процессе фаза постоянна, т.Е.
- •Продифференцировав выражение (1.5) и сократив на , получим
- •1.3. Интерференция волн.
- •1.4. Стоячие волны
- •В точках, где
- •2. Электромагнитные волны
- •2.1. Экспериментальное получение электромагнитных волн
- •2.2. Дифференциальное уравнение электромагнитной волны
- •2.3. Энергия электромагнитных волн
- •3 Интерференция света
- •3.1. Развитие представлений о природе света
- •3.2. Когерентность и монохроматичность световых волн
- •3.3.Условия интерференции света
- •Если оптическая разность хода равна целому числу волн в вакууме
- •3.4. Методы наблюдения интерференции света
- •3.5. Расчет интерференционной картины от двух источников
- •3.6. Интерференция света в тонких пленках
- •3.7. Применение интерференции света
- •4. Дифракция света
- •4.1. Принцип Гюйгенса-Френеля
- •4.2. Метод зон Френеля. Прямолинейное распространение света
- •4.3.Дифракция Фраунгофера на одной щели
- •4.4. Дифракция Фраунгофера на дифракционной решетке
- •5.2. Поляризация света при отражении и преломлении на границе двух диэлектриков
- •5.3. Поляризационные призмы и поляроиды
- •5.4. Искусственная оптическая анизотропия
- •5.5. Вращение плоскости поляризации
- •6. Квантовая природа излучения
- •6.1. Тепловое излучение и его характеристики
- •6.2. Закон Кирхгофа
- •Закон Стефана-Больцмана и смещение Вина
- •6.4. Формула Рэлея-Джинса и Планка
- •Планк вывел для универсальной функции Кирхгофа формулу
- •6.5. Оптическая пирометрия и тепловые источники света
- •6.6. Виды фотоэлектрического эффекта. Законы внешнего фотоэффекта
- •6.7. Уравнение Эйнштейна для внешнего фотоэффекта. Экспериментальное подтверждение квантовых свойств света
- •6.8. Применение фотоэффекта
- •6.9 Масса и импульс фотона.
- •6.10. Диэлектрическое единство корпускулярных и волновых свойств электромагнитного излучения
- •7. Теория атома водорода по бору
- •Модели атома Томсона и Резерфорда
- •Линейчатый спектр атома водорода
- •Постулаты Бора
- •7.4. Спектр атома водорода по Бору
- •8. Элементы квантовой физики
- •Корпускулярно-волновой дуализм свойств вещества
- •8.2. Соотношение неопределенностей
- •Волновая функция и её статистический смысл
- •Величина
- •8.4. Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний
- •9. Элементы современной фи3ики атомов и молекул
- •9.1. Атом водорода в квантовой механике
- •9. Элементы современной фи3ики атомов и молекул
- •9.1. Атом водорода в квантовой механике
- •Спин электрона. Спиновое число
- •Согласно общим выводам квантовой механики, спин квантуется по закону
- •Принцип Паули. Распределение электронов в атоме по состояниям
- •10. Элементы физики твердого тела
- •Понятие о зонной теории твердых тел
- •10.2. Металлы, диэлектрики и полупроводники по зонной теории
- •10.4. Примесная проводимость полупроводников
- •Контакт электронного и дырочного полупроводников
- •10.6. Полупроводниковые диоды и триоды
- •11. Элементы физики атомного ядра
- •11.1. Размер, состав и заряд атомного ядра. Массовое и зарядовое число
- •11.2. Дефект массы и энергия связи ядра
- •11.3. Ядерные силы. Модели ядра
- •11.4. Радиоактивное излучение и его виды
- •Закон радиоактивного распада. Правила смещения
- •11.6. Элементарные частицы и типы взаимодействий
- •11.7. Частицы и античастицы
- •11.8. Классификация элементарных частиц. Кварки
9. Элементы современной фи3ики атомов и молекул
9.1. Атом водорода в квантовой механике
Решение задачи об энергетических уравнениях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизированного лития Li++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1),
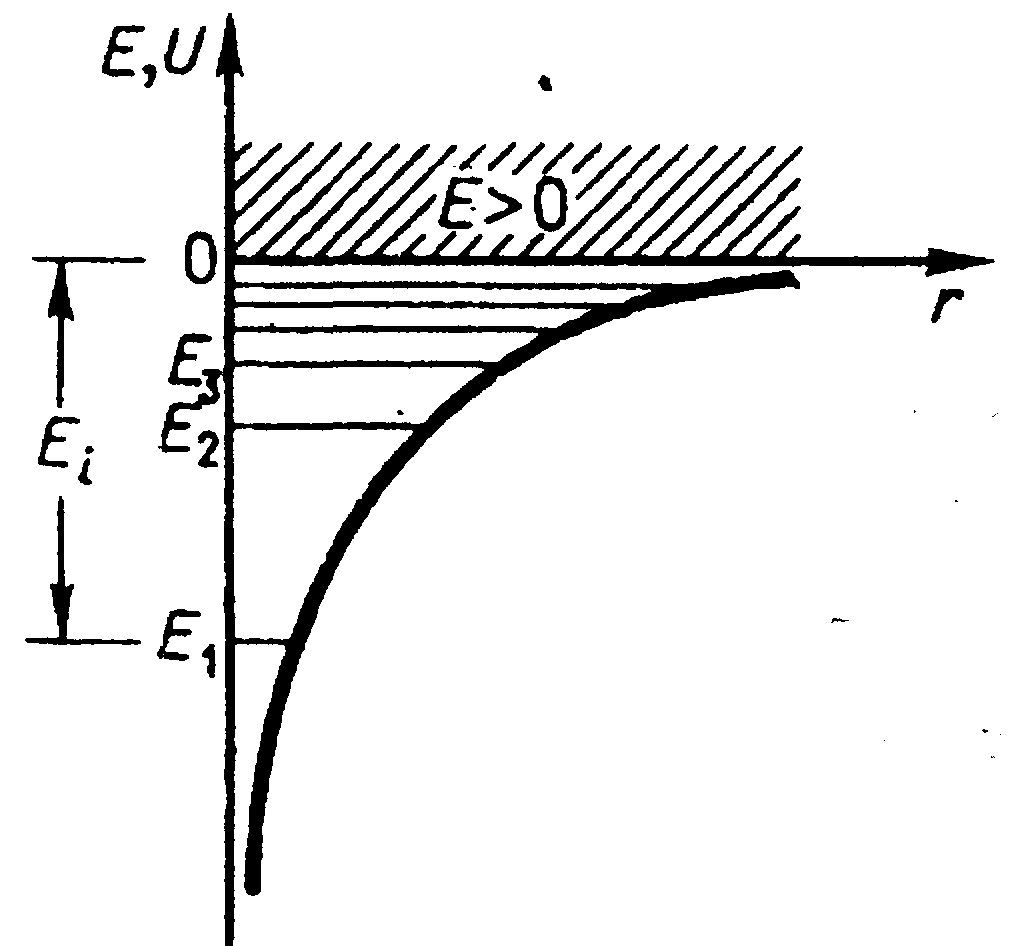
где r - расстояние между электроном и ядром. Графически функция U(r) изображена жирной кривой на рис. 38, неограниченно убывающей (возрастающей) по модулю при уменьшении r, т.е. при приближении электрона к ядру.
Состояние электрона в атоме водорода описывается волновой функцией , удовлетворяющей стационарному уравнению Шредингера
![]() (9.1)
(9.1)
где
m
- масса электрона, Е
- полная энергия электрона в атоме. Так
как поле, в котором движется электрон,
является центрально-симметричным; то
для решения уравнения (9.1) обычно
используют сферическую
систему координат:
![]() .
Не вдаваясь в математическое решение
этой задачи; ограничимся рассмотрением
важнейших результатов; которые из него
следуют; пояснив их физический смысл.
.
Не вдаваясь в математическое решение
этой задачи; ограничимся рассмотрением
важнейших результатов; которые из него
следуют; пояснив их физический смысл.
1. Энергия. В теории дифференциальных уравнений доказывается, что уравнения типа (9.1) имеют решения; удовлетворяющие требованиям однозначности; конечности и непрерывности волновой функции только при собственных значениях энергии
![]() (n=1,2,3,…)
(9.2)
(n=1,2,3,…)
(9.2)
т.е. для дискретного набора отрицательных значений энергии.
Таким образом; решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е1,Е2,Е3 показаны на рис. 38 в виде горизонтальных прямых.
|
Самый
нижний уровень E1,
отвечающий минимально возможной
энергии, - основной.
Все остальные
|
Рис. 38
При Е>О движение электрона является свободным; область непрерывного спектра Е>О (на рис. 37 заштрихована) соответствует ионизированному атому. Энергия ионизации атома водорода равна
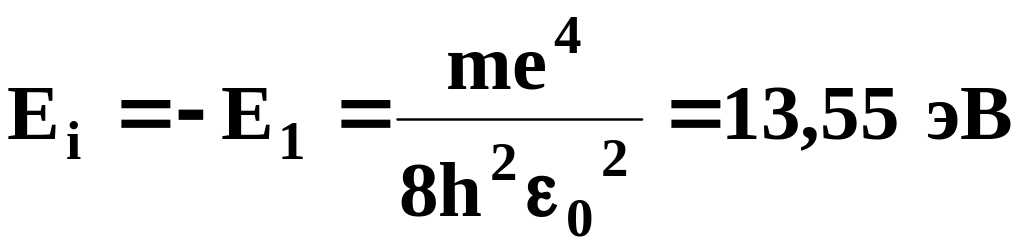 (9.3)
(9.3)
Выражение (9.3) совпадает с формулой (7.7), полученной Бором для энергии атома водорода. Однако если Бору пришлось вводить дополнительные гипотезы, то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
2.
Квантовые
числа. В
квантовой механике доказывается, что
уравнению Шредингера (9.1) удовлетворяют
собственные функции,
![]() ,
определяемые тремя квантовыми числами:
главным n,
орбитальным
и магнитным
,
определяемые тремя квантовыми числами:
главным n,
орбитальным
и магнитным
![]() .
.
Главное квантовое число n, согласно (9.2), определяет энерге-тические уровни электрона в атоме и может принимать любые цело-численные значения начиная с единицы: n=1, 2, 3,
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т.е. не может быть произвольным, а принимает дискретные значения, опреде-ляемые формулой
![]() ,
(9.4)
,
(9.4)
где – орбитальное квантовое число, которое при заданном n принимает значения
![]() (9.5)
(9.5)
т.е. всего n значений, и определяет момент импульса электрона в атоме.
Из
решения уравнений Шредингера следует
также, что вектор
![]() момента импульса электрона может иметь
лишь такие ориентации в пространстве,
при которых его проекция
момента импульса электрона может иметь
лишь такие ориентации в пространстве,
при которых его проекция
![]() на направление z
внешнего магнитного поля принимает
квантовые значения кратные
на направление z
внешнего магнитного поля принимает
квантовые значения кратные
![]()
![]() (9.6)
(9.6)
где
![]() -
магнитное
квантовое число, которое
может принимать значения =0,1,2,…,
,
-
определяет проекцию момента импульса
электрона на заданное направление,
причем вектор момента импульса электрона
в атоме может иметь в пространстве 2
+
ориентаций. Наличие квантового числа
должно
привести в магнитном поле к расщеплению
уровня с главным квантовым числом n
на 2
+ 1 подуровней. Соответственно в спектре
атома должно наблюдаться расщепление
спектральных линий. Действительно,
расщепление энергетических уровней в
магнитном поле было обнаружено в 1896 г.
голландским физиком П. Зееманом и
получило название эффекта
Зеемана.
Расщепление уровней энергии во внешнем
электрическом поле, тоже доказанное
экспериментально, называется эффектом
Штарка.
-
магнитное
квантовое число, которое
может принимать значения =0,1,2,…,
,
-
определяет проекцию момента импульса
электрона на заданное направление,
причем вектор момента импульса электрона
в атоме может иметь в пространстве 2
+
ориентаций. Наличие квантового числа
должно
привести в магнитном поле к расщеплению
уровня с главным квантовым числом n
на 2
+ 1 подуровней. Соответственно в спектре
атома должно наблюдаться расщепление
спектральных линий. Действительно,
расщепление энергетических уровней в
магнитном поле было обнаружено в 1896 г.
голландским физиком П. Зееманом и
получило название эффекта
Зеемана.
Расщепление уровней энергии во внешнем
электрическом поле, тоже доказанное
экспериментально, называется эффектом
Штарка.
Хотя
энергия электрона (9.2) и зависит только
от главного квантового числа n,
но каждому собственному значению En
(кроме Е1)
соответствует несколько собственных
функций
![]() ,
отличающихся значениями
.
Следовательно,
атом водорода может иметь одно и то же
значение энергии, находясь в нескольких
различных состояниях. Так как при данном
n
орбитальное квантовое число
может изменяться от 0 до n-
1 , а каждому
значению
соответствует 2
+
различных значений, то число различных
состояний, соответствующих данному n,
равно
,
отличающихся значениями
.
Следовательно,
атом водорода может иметь одно и то же
значение энергии, находясь в нескольких
различных состояниях. Так как при данном
n
орбитальное квантовое число
может изменяться от 0 до n-
1 , а каждому
значению
соответствует 2
+
различных значений, то число различных
состояний, соответствующих данному n,
равно
![]() .
(9.7)
.
(9.7)
Квантовые числа и их значения являются следствием решений уравнений Шредингера и условий однозначности, непрерывности и конечности, налагаемых на волновую функцию . Кроме того, поскольку при движении электрона в атоме существенны волновые свойства электрона, квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно учению, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема, различную в разных частях атома. Электрон при своем движении как бы "размазан" по всему объему и образует электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и характеризуют размер и форму электронного облака, квантовое число - ориентацию электронного облака в пространстве.
В
атомной физике по аналогии со спектроскопией
состояние электрона, характеризующееся
квантовым числом
![]() ,
называют s -
состоянием (электрон в этом состоянии
называют s
- электроном),
=1
- р
– состоянием,
=2
- d -
состоянием,
=
3 - f
- состоянием и т. д. Значение главного
квантового числа указывается перед
условным обозначением орбитального
квантового числа. Например, электроны
в состояниях с n
= 2 и
=
0 и
обозначаются соответственно символами
2s
и 2р.
,
называют s -
состоянием (электрон в этом состоянии
называют s
- электроном),
=1
- р
– состоянием,
=2
- d -
состоянием,
=
3 - f
- состоянием и т. д. Значение главного
квантового числа указывается перед
условным обозначением орбитального
квантового числа. Например, электроны
в состояниях с n
= 2 и
=
0 и
обозначаются соответственно символами
2s
и 2р.

Рис. 39
На
рис. 39 для примера приведено
распределение электрон-ной плотности
(в форме электронного облака) для
состояний атома во-дорода при n
= 1 и n
= 2, определяемое
![]() как видно из рисунка, оно зависит от n,
как видно из рисунка, оно зависит от n,
![]() и
.
Так при
=
0 электронная плотность в центре отлична
от нуля и не зависит от направления
(сферически симметрична), а для остальных
состояний в центре она равна нулю
зависит от направления.
и
.
Так при
=
0 электронная плотность в центре отлична
от нуля и не зависит от направления
(сферически симметрична), а для остальных
состояний в центре она равна нулю
зависит от направления.
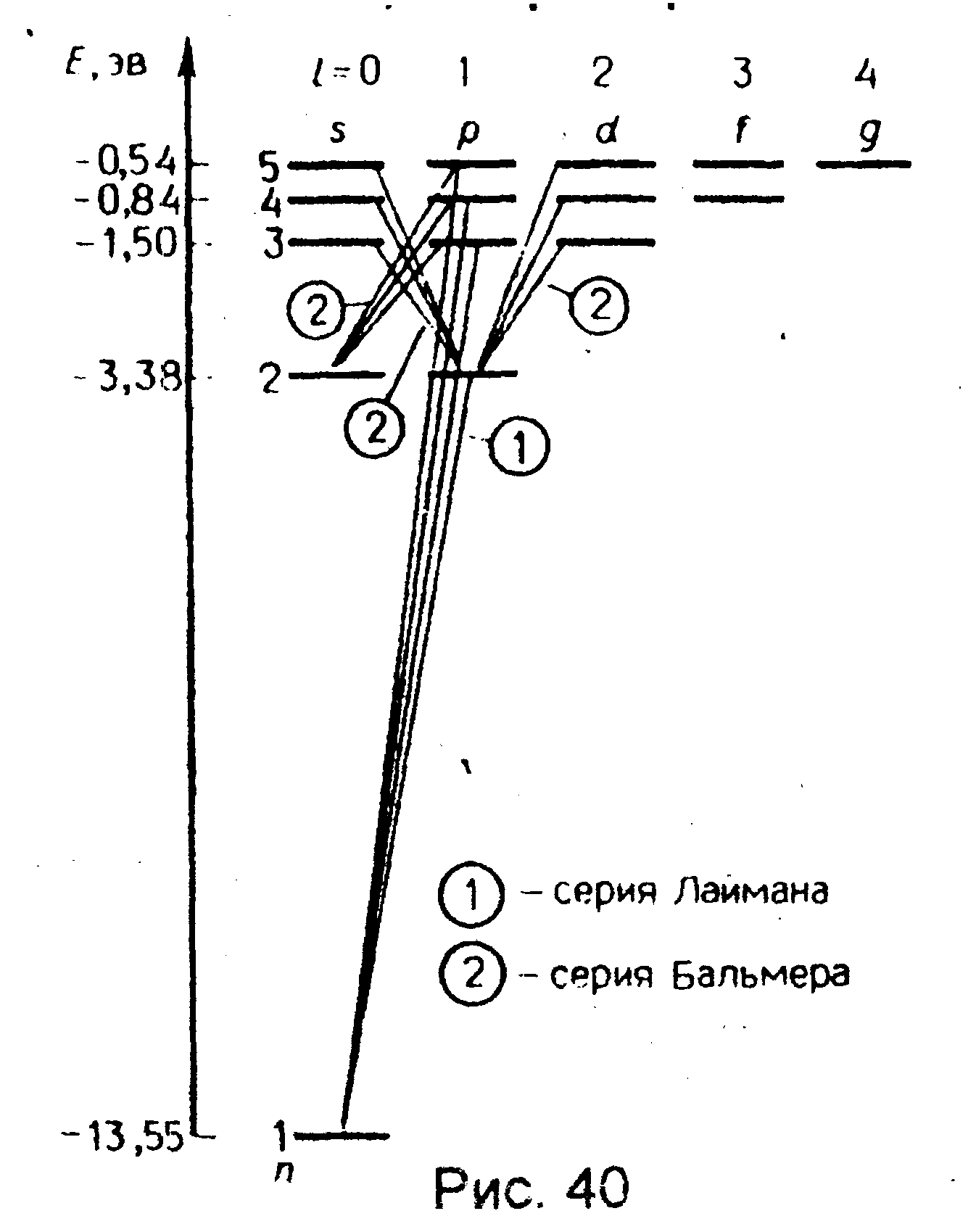
3. Спектр. Квантовые числа n, и позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора. В квантовой механике вводятся правила отбора, ограничивающее число возможных переходов электронов в атоме, связанных с испусканием и поглощением света.
Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центрально - симметричном поле ядра, могут осуществляться только такие переходы, для ко-
торых:
1) изменение орбитального квантового
числа
![]() удовлетворяет
условию
удовлетворяет
условию
![]() ;
(9.7)
2)
изменение магнитного квантового числа
;
(9.7)
2)
изменение магнитного квантового числа
![]() удовлетворяет условию
удовлетворяет условию
![]() .
.
В
оптических спектрах указанные правила
отбора в основном выполняются. Однако
в принципе могут наблюдаться и слабые,
"запрещенные" линии, например
возникающие при переходах с
![]() .
Появление этих линий объясняется
тем, что строгая теория, запрещая
дипольные переходы, разрешает переходы,
соответствующие излучению более сложных
систем зарядов. Например, квадруполей.
Вероятность же квадрупольных переходов
(переходы с
.
Появление этих линий объясняется
тем, что строгая теория, запрещая
дипольные переходы, разрешает переходы,
соответствующие излучению более сложных
систем зарядов. Например, квадруполей.
Вероятность же квадрупольных переходов
(переходы с
![]() )
во много раз меньше вероятности дипольных
переходов, поэтому "запрещенные"
линии и являются слабыми. Учитывая число
возможных состояний, соответствующих
данному n,
и правило отбора (9.8), рассмотрим
спектральные линии атома водорода:
серии Лаймана соответствуют переходы
)
во много раз меньше вероятности дипольных
переходов, поэтому "запрещенные"
линии и являются слабыми. Учитывая число
возможных состояний, соответствующих
данному n,
и правило отбора (9.8), рассмотрим
спектральные линии атома водорода:
серии Лаймана соответствуют переходы
![]()
серии Бальмера -
![]() .
.
Переход
электрона из основного состояния в
возбужденное обусловлен увеличением
энергии атома и может происходить только
при сообщении атому энергии извне.
Например, на счет поглощения атомом
фотона. Так как поглощающий атом
находится обычно в основном состоянии,
то спектр атома водорода должен состоять
из линий, соответствующих переходам
![]() (n=2,3,.
. .), что находится в полном согласии с
опытом.
(n=2,3,.
. .), что находится в полном согласии с
опытом.