
- •1 Огляд літератури
- •2 Матеріали та методи дослідження
- •3 Результати та їх обговорення
- •1. Фітотоксичність важких металів та їх надходження у рослинний організм
- •2 Вплив мікроелементів на радіочутливість рослин
- •4. Зміна фізіолого-біохімічних процесів рослин у відповідь на дію надлишкової концентрації важких металів
- •4.1. Вплив на фотосинтетичні процеси
- •4.2. Вплив на метаболізм азоту рослин
- •4.3. Фізіологічні аспекти дії полютантів на систему антиоксидантного захисту
- •2 Матеріали та методи
- •2.1 Об’єкти дослідження
- •2.2 Морфометричні виміри
- •2.4 Визначення ізоферментного складу пероксидази методом ізоелектричного фокусування в поліакриламідному гелі
- •2.5 Визначення вмісту важких металів у грунті атомно-абсорбційним методом
- •2.6 Статистичні методи обробки матеріалів
- •3 Результати та їх обговорення
2.5 Визначення вмісту важких металів у грунті атомно-абсорбційним методом
Визначення важких металів проводили атомно-абсорбційним методом [13]. Наважку 2г подрібненого матеріалу переносили в чистий прокалений і зважений тигель. При температурі 500ºC±50º прокалювали в муфелі протягом 0,5 години. Потім охолоджували до кімнатної температури, зволожували 1 мл розбавленою дистильованою водою HNO3 (1:1), прогрівали на електроплитці до знищення білих парів і знову 0,5 години прокалювали в муфелі. Після цього тиглі охолоджували і зволожували (для визначення вмісту попелу). Попіл зволожували 1–2 мл HCL (1:1) і нагрівали на електроплитці до слабкого кипіння. Потім додавали 3-5 мл гарячої води і розчин переносили в пробірки. З пробірок розчин переливали в чисті пляшечки через фільтр з білою стрічкою і розводили водою до 10 мл. Цей розчин використовували для визначення мікроелементів[18]. Стандартні розчини для побудови калібрувального графіку готували з сірчанокислих солей визначаємих елементів шляхом розведення їх дистильованою водою (до визначаємих концентрацій в межах 0,1–25 мкг/мл) (табл. 2.1).
Табл. 1. – Калібрувальні точки для побудови калібрувального графіку
№ п/п |
Концентрація мг/мл |
Оптична густина, мБ |
1 |
0,05000 |
32,3109 |
2 |
0,10000 |
63,8235 |
За результатами фотометрії стандартів будували калібрувальні графіки залежності величини абсорбції від концентрації (рис. 2.1).
Параметри елементів, оптимальних для кожного визначення, вибираються з розрахунком впливу полум'я на абсорбцію атомами металів світлової енергії випромінюючої лампи, що врешті визначає чутливість аналізу, а також залежність стабільного випромінювання лампи від сили живлячого струму [9]. Вміст важких металів в пробі розраховували в мг/кг.

Рис. 1. – Калібрувальний графік залежності оптичної густини
від концентрації металу
2.6 Статистичні методи обробки матеріалів
Досліди виконували в двох-трьох біологічних і трьох аналітичних повтореннях. Отримані результати опрацьовували статистично за допомогою стандартних комп'ютерних програм у EXCEL 2003/XP. Визначали середнє арифметичне, стандартну похибку. Достовірність різниці між варіантами оцінювали за критерієм Ст'юдента, використовуючи 5% рівень значущості [24].
3 Результати та їх обговорення
Одним із критеріїв оцінки токсичності грунтів є ступінь їхнього впливу на ранніх етапах розвитку[54]. Проведені нами експерименти показали інгібування ростових показників проростків сої та люпину, вирощених на витяжках з грунтів з районів з різним рівнем техногенного навантаження( табл. 3; 4 ). Уже через дві доби після пророщення темп росту довжини коренів зменшувався на 18,8-40,8% у порівнянні з умовним контролем (Царичанський район) (рис.2; 4). Маса проростків, вирощених на забрудених важкими металами грунтах, теж значно знижувалася. Дослідження показали, що найбільш токсичною дією на розвиток проростків сої та люпину виявляють витяжки з грунтів, взятих на техногенних територіях м. Дніпропетровськ (рис. 3; 5). Ріст підземної частини проростків виявився стійкішим до дії токсичних елементів грунтів, що містяться у водних витяжках ( рис. 2-5 ).
Вміст важких металів у грунтах Дніпропетровської області представлено в табл. 2.
Табл. 2. – Вміст важких металів
Метал |
Дніпропетровськ |
Дніпродзержинськ |
||
Ділянка1 |
Ділянка2 |
|||
ВРФ |
КРФ |
ВРФ |
КРФ |
|
Свинець |
9,42 |
42,72 |
8,00 |
36,48 |
Кадмій |
0,28 |
1,40 |
0,60 |
1,15 |
Нікель |
1,40 |
9,62 |
1,30 |
6,85 |
Цинк |
52,87 |
254,60 |
43,48 |
258,54 |
Мідь |
1,02 |
25,57 |
1,14 |
27,69 |
Залізо |
2,00 |
1563,64 |
9.66 |
4553,38 |
Марганець |
11,81 |
681,91 |
23,13 |
15,98 |
Табл. 3. – Зміни морфометричних показників 3-добових проростків люпину при вирощуванні на витяжках з грунту територій Дніпропетровської області з різним рівнем забруднення важкими металами
Морфометричні показники |
Контроль |
Дослідні ділянки |
||
ділянка 1 |
ділянка 2 |
ділянка 3 |
||
Довжина кореня, мм |
57± |
50± |
46± |
57± |
Довжина пагону, мм |
30± |
34± |
33± |
35± |
Маса проростка, г |
0,89± |
0,78± |
0,75± |
0,85± |
|
Концентрація білку, мг/мл |
|||
у корінні |
2,62 |
1,06 |
1,66 |
1,73 |
Примітка: грунти з: 1 - м. Дніпродзержинськ, 2 - м.Дніпропетровськ, 3 - ботанічний сад, контроль - Царичанський район.
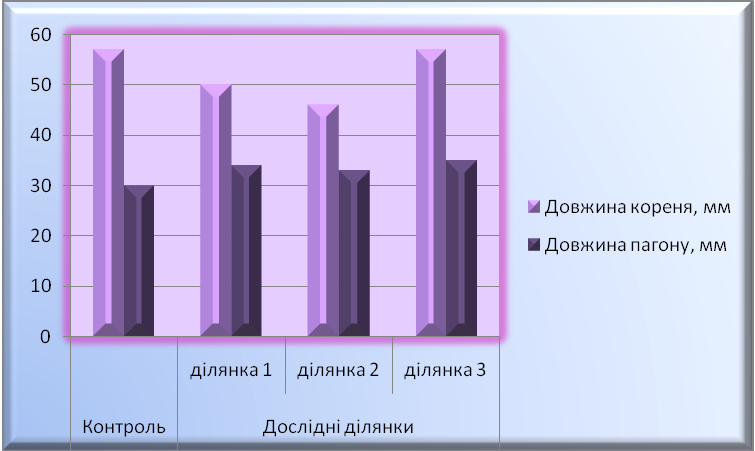
Рис. 2. Порівняльна характеристика довжини кореня та пагону проростків люпину дослідних ділянок і контрольних значень

Рис. 3. Порівняльна характеристика маси проростків люпину дослідних ділянок і контрольних значень
Табл. 4 – Зміни морфометричних показників 3-добових проростків сої при вирощуванні на витяжках з грунту територій Дніпропетровської області з різним рівнем забруднення важкими металами
Морфометричні показники |
Контроль |
Дослідні грунти |
||
1 |
2 |
3 |
||
Довжина кореня, мм |
70 ± |
72 ± |
67 ± |
75 ± |
Довжина пагону, мм |
34 ± |
37 ± |
24 ± |
28 ± |
Маса проростка, г |
0,70 ± |
0,65 ± |
0,53 ± |
0,56 ± |
|
Концентрація білку, мг/мл |
|||
у корінні |
2,11 |
1,27 |
1,30 |
0,70 |
Примітка: грунти з: 1 - м. Дніпродзержинськ, 2 - м.Дніпропетровськ, 3 - ботанічний сад, контроль - Царичанський район.

Рис 4. Порівняльна характеристика морфометричних показників: довжини кореня та пагону проростків сої дослідних ділянок і контрольних значень
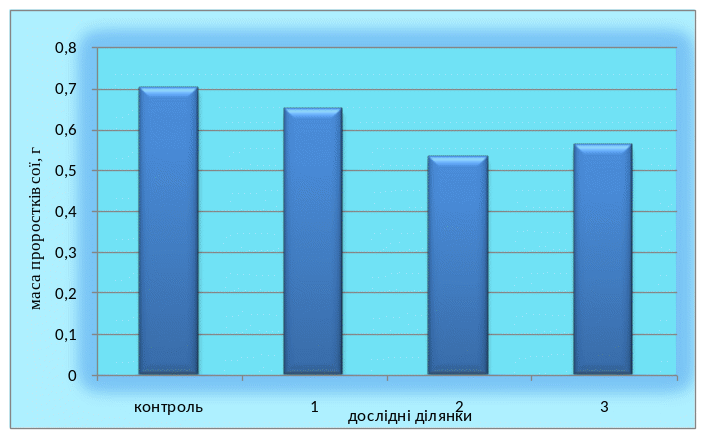
Рис. 5. Порівняльна характеристика маси проростків сої дослідних ділянок і контрольних значень
Таким чином, вивчення ростових показників проростків сої та люпину, вирощених на водних витяжках з грунту з різним рівнем забруднення важкими металами показало зниження активності ростових процесів рослин сої та люпину вже на ранніх стадіях онтогенезу (рис. 2-5). Токсична дія металів чітко видна по інгібуванню росту, що широко застосовується для тестування їх присутності в навколишньому середовищі. Гальмування росту відбувається, з одного боку, через порушення метаболізму і, з іншого боку, у результаті більш прямої дії металів на ріст, наприклад, у результаті взаємодії з полісахаридами оболонок і зниження пластичності клітинних оболонок. При сильному ураженні у рослин порушується багато функцій, що є наслідком первісних порушень особливо чутливих ланок метаболізму[19]. Одним з таких порушень є зміна обміну азотистих сполук (амінокислот, білків)[9]. Будучи тісно зв’язаним із клітинним метаболізмом і володіючи винятково великою різноманітністю біологічних функцій, білок бере участь в адаптації рослин до несприятливих факторів середовища[13,43]. Результати дослідження вмісту цитоплазматичних білків показали зниження їх рівня у коренях проростків, вирощениї на водних витяжках грунтів з різних районів Дніпропетровської області у порівнянні з умовним контролем (Царичанський район) ( табл. 3;4 ).
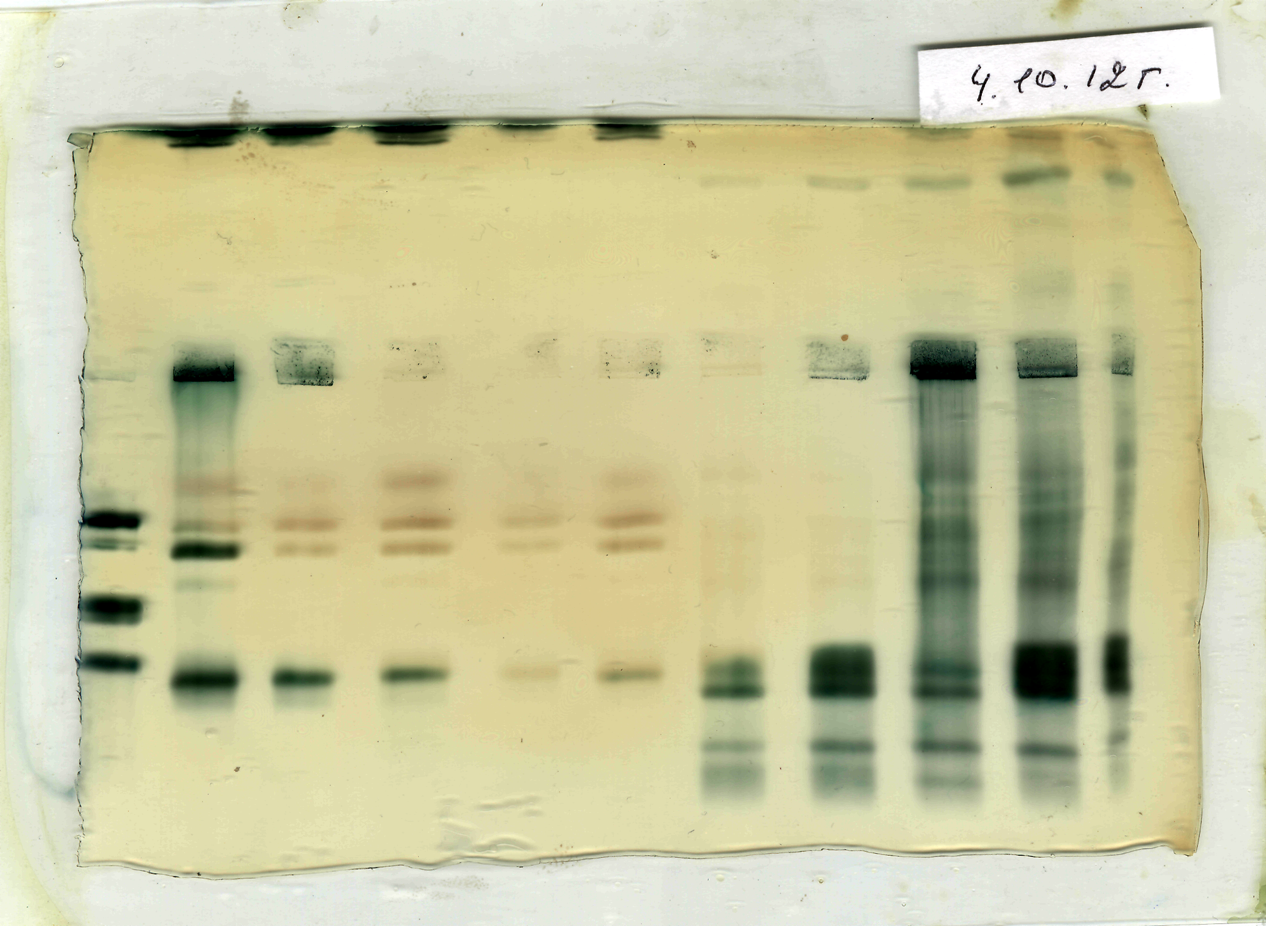
1 2 3 4 5 6 7 8 9
Примітка: Люпин: 1 - вода; 2 – Царичанка; 3 – бот. сад. 4 - Дніпропетровськ; 5 - Дніпродзержинськ. Соя: 6 - Царичанка; 7 – бот. сад; 8 - Дніпропетровськ; 9 - Дніпродзержинськ.
Рис. 6. – ІЕФ-спектри пероксидази коренів проростків сої та люпину, вирощених на водних витяжках грунтів різної забрудненості важкими металами.
Якщо концентрація білку коренів сої у контролі (Царичанський район) складала 2,11 мг/мл, то у варіанті №3( Ботанічний сад) спостерігалося зменшення цього показника приблизно в 2,0 рази. Зниження концентрації білку спостерігалося також у варіанті №1 ( м. Дніпродзержинськ) і у варіанті № 2 (м. Дніпропетровськ). Концентрація білку коренів люпину у варіанті №1 (м. Дніпродзержинськ) виявилася найменшою – 1,06 мг/мл, у порівнянні з контролем – 2,62 мг\мл. У варіантах №2 і №3 зниження концентрації було майже однаковим. Аналіз електрофоретичних спектрів легкорозчинних білків коренів сої показав, що до їх складу входить 18-ть компонентів (рис. 6, табл.5 ). У контрольному досліді спостерігалося усі 18-ть компонентів, але в інших зразках спостерігається відсутність деяких компонентів (рис. 6, табл.5 ). Аналіз електрофоретичних спектрів легкорозчинних білків коренів люпину показав, що до їх складу входить 8 компонентів – контроль, в інших зразках – менше. ( табл. 6, рис.8).
В літературі є достатньо багато повідомлень про вплив різноманітних факторів довкілля на вміст і метаболізм білків клітини: посухи, засолення, кальцієвого голодування і т.д. Зазвичай при ушкоджуючій дії вміст білку знижується за рахунок посилення його розпаду і обмеження синтезу. Але в залежності від ступеня стійкості рослин ці процеси проходять з різною швидкістю і інтенсивністю[3,8,16]. У нестійких розпад білка більш глибокий, а здатність до синтезу його губиться при меншій силі впливу. Довготривале збереження синтетичних реакцій у пристосованих рослин може супроводжуватися зміною складу білків, розширенням спектру та іншими якісними змінами[4]. Кількісні зміни у вмісті легкорозчинних білків у дослідних рослин повинні бути пов’язані із змінами їх якісного складу. В залежності від умов пророщування, склад білків був різним.
Відомо, що пероксидаза є чутливим ферментом до дії антропогенних чинників[25]. Підтвердженням цього є дослідження кінетики окислення бензидину пероксидазою з коріння проростків сої та люпину, які вирощували на водних витяжках грунтів різних областей м. Дніпропетровська. Так, каталітична реація перетворення бензидину під дією пероксидази проходить зі значною швидкістю, яка характеризується різницею оптичної густини початку і кінця реакції.
Табл. 5. – Значення ізоелектричних точок (рІ) ізоферментів пероксидази проростків сої, вирощеної на витяжках грунтів з різних районів Дніпропетровської області
№ п/п |
Значення рІ |
Райони відбору зрізків грунтів |
||||
1 |
2 |
3 |
4 |
5 |
||
1 |
3,95 |
+ |
+ |
- |
- |
|
2 |
4,02 |
++ |
++ |
++ |
сл. |
|
3 |
4,04 |
сл. |
- |
- |
- |
|
4 |
4.05 |
сл. |
- |
- |
- |
|
5 |
4,08 |
++ |
+ |
+ |
сл. |
|
6 |
4,09 |
+++ |
+++ |
сл. |
- |
|
7 |
4,10 |
сл. |
сл. |
- |
+ |
|
8 |
4.11 |
++ |
++ |
+ |
+ |
|
9 |
4,12 |
+ |
+ |
+ |
+ |
|
10 |
4,13 |
+ |
+ |
+ |
+ |
|
11 |
5,01 |
сл. |
сл. |
- |
- |
|
12 |
5,02 |
+++ |
++ |
++ |
+ |
|
13 |
5,04 |
сл. |
сл. |
- |
- |
|
14 |
6 |
+++ |
- |
++ |
- |
|
15 |
6,10 |
+++ |
+++ |
++ |
++ |
|
16 |
6,30 |
+++ |
+++ |
++ |
+ |
|
17 |
6,12 |
++ |
++ |
+ |
+ |
|
18 |
6,55 |
+ |
++ |
++ |
++ |
|
Примітка: ““ – відсутність ізоферменту; : “+“ – наявність ізоферменту (слабка інтенсивність забарвлення); : “++“ – середня інтенсивність забарвлення; “+++“ – сильна інтенсивність забарвлення; “сл.” – сліди ізоферменту
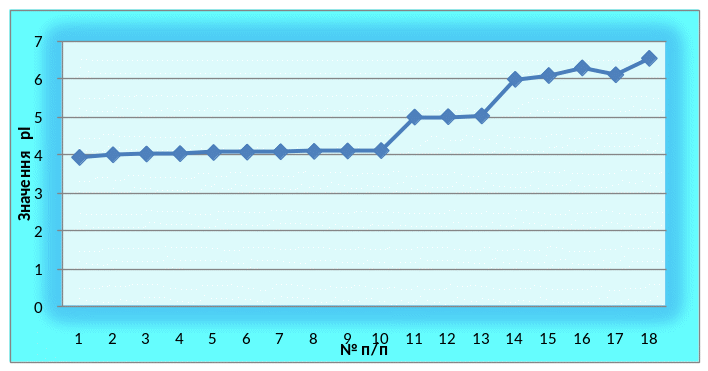
Рис. 7. Значення ізоелектричних точок (рІ) ізоферментів пероксидази проростків сої, вирощеної на витяжках грунтів з різних районів Дніпропетровської області.
Табл. 6. – Значення ізоелектричних точок (рІ) ізоферментів пероксидази проростків сої, вирощеної на витяжках грунтів з різних районів Дніпропетровської області
№ п/п |
Значення рІ |
Райони відбору зрізків грунтів |
||||
1 |
2 |
3 |
4 |
5 |
||
1 |
4,45 |
++ |
+ |
++ |
++ |
+ |
2 |
4,50 |
+ |
- |
++ |
++ |
+ |
3 |
4,55 |
- |
- |
- |
+ |
+++ |
4 |
4.60 |
++ |
сл. |
- |
сл. |
+ |
5 |
4,85 |
+++ |
+ |
+ |
+ |
+ |
6 |
5,05 |
++ |
+ |
+ |
+ |
+++ |
7 |
6,70 |
- |
- |
- |
- |
+ |
8 |
7,0 |
++ |
+ |
++ |
+++ |
+++ |
Примітка: ““ – відсутність ізоферменту; : “+“ – наявність ізоферменту (слабка інтенсивність забарвлення); : “++“ – середня інтенсивність забарвлення; “+++“ – сильна інтенсивність забарвлення; “сл.” – сліди ізоферменту

Рис. 8. Значення ізоелектричних точок (рІ) ізоферментів пероксидази проростків люпину, вирощеного на витяжках грунтів з різних районів Дніпропетровської області
Отримані результати свідчать про те, що питома активність пероксидази коренів сої та люпину, вирощених на водних витяжках грунту з різних районів м. Дніпропетровська, збільшена відносно умовного контролю.
ВИСНОВКИ
1. Забруднення грунтів важкими металами викликає пригнічення ростових показників проростків сої та люпину, як тест-обєкту, на ранніх стадіях онтогенезу. Показано, що техногенні території грунтів м. Дніпропетровськ викликають більш токсичну дію на ріст і розвиток рослин.
2. Встановлено, що при дії екстремальних факторів посилюється розпад білків, про що свідчить їх менший вміст у коренях дослідних зразків у порівнянні з умовним контролем ( Царичанський район).
3. Виявлено, що адаптація проростків сої та люпину здійснюється якісними і кількісними перебудовами в компонентному складі цитоплазматичних білків коренів.
4. Встановлено, що токсиканти забруднених грунтів посилюють активність пероксидази коренів.
Список використаної літератури:
1. Авениров А. К., Гончаров Г. Н., Исупова Н. В. О содержании тяжелых металлов и радионуклидов в сосне Павловского парка // Вопросы экологии и охраны природы. – 2004.– N4. – С.106-110.
2. Алексеев Ю. В. Тяжелые металлы в почве и растениях. – Л.: Наука, 2007. – 201 с.
3. Баїк О. Л., Речевська Н. Я. Реакція мохів на токсичну дію важких металів // Матеріали І-ї Всеукр. Наук. Конф. «Онтогенез рослин в природному та трансформованому середовищі». – Тернопіль, 2008. – С. 6-8.
4. Баранова Н. М. Оцінка забруднення важкими металами сучасних відкладів прибережно-морських екосистем м. Одеси. // Екологія довкілля та безпека життєдіяльності. – 2002. – № 2.
5. Бессонова B.П., Юсипіва Т.І. Вплив Вважких металів на стан пігментів у хлоропластах деревних рослин. // Вісник Запорізького державного університету. – №1. – 1998. – Режим доступу до журналу: http://web.znu.edu.ua/herald/articles/1513.pdf
6. Бєлих О. С. Закономірності індукції цитогенетических ефектів у рослин при окремій і сумісній дії важких природних радіонуклідів і металів : Дис. ... канд. біол. наук : 03.00.01. – Сиктивкар, 2005.
7. Бойко Н. В., Кривцова М. В., Чонка І.І., Стефурак В. П., Ніколайчук В. І., Фабрі З. Й. Важкі метали: від поширення у ґрунті до модельної інтоксикації та її біопротекції (на прикладі солі цинку) // Науковий8 вісник Українського державного лісотехнічного університету. Проблеми урбоекології та фітомеліорації. – 2003. – Вип. 13. – № 5. – С.77-85.
8. Бурдин К. С., Золотухина Е. Ю. Тяжелые металлы в водных растениях (аккумуляция и токсичность). – М.: Диалог-МГУ, 2008. – 202 с.
9. Воробець Н. М. Активність аспартат- і аланінамінотрансфераз соняшника за дії різних доз свинцю // Физиология и биохимия культурных растений. – 2002. – № 2. – С. 147-151.
10. Воробець Н. М., Микієвич І. М. Вміст аскорбінової, дегідроаскорбінової, дикетоглутонової кислот у проростках соняшника за дії іонів свинцю // Вісник Львівського університету. Серія: біологічна. – 2001. –№ 27. – С. 244-251.
11. Воробьев Л. Н. Регулирование ионного транспорта: теоретические и практические аспекты минерального питания растений // Итоги науки и техники. Сер. Физиология растений.– М.: ВИНИТИ, 2001. – Т. 5. – С. 179.
12. Гливляс Н. В., Ніколайчук В. І. Вплив важких металів на ріст рослин та вміст хлорофілу в листках Lotus corniculatus L. // Науковий вісник УжНУ. Серія: біологія. – Вип. 9. – 2001. – С. 311-313.
13. Грабовський О.В. Міграція та акумуляція важких металів в агроценозах, прилеглих до автомагістралей, в умовах Закарпаття (грунт – рослини – тварини): Автореф. дис... канд. біол. наук: 03.00.16. – Чернівці, 2002. – 22 с.
14. Гуральчук Ж. З. Надходження та детоксикація важких металів у рослинах // Живлення рослин: теорія і практика. – К.: Логос, 2005. – С. 438-475.
15. Гуральчук Ж. З. Механизмы учойчивости растений к тяжёлым металлам // Физиология и биохимия культурных растений. – 2000. – Т. 26, №2. – С. 107-117.
16. Демич Ю. А. Содержание тяжёллых металлов в объектах окружающей среды и состояние растительных популяций // Вестник СамГУ – Естественнонаучная серия. –2006. – №7 (47).
17. Дергунова А. Б., Рахимова Х. Х. Особенности аккумуляции тяжелы металлов листьями древесных растений // Маетериалы II Всероссийской конференции "Новые достижения в химии и химической технологии растительного сырья" (21-22 апреля, 2005 г). – Барнаул: Изд-во Алт. ун-та. – 2005. – Т. I. – С. 713-716.
18. Жовинский Э. Я., Кураева И. В. Геохимия тяжелых металлов в почвах Украины. – К.: Наукова думка, 2002. – 214 с.
19. Журавльова І. М. Вплив важких металів на вміст хлорофілу в зеленій масі ячменю // Охорона та раціональне використання природних ресурсів Українських Карпат: Тези доповідей регіональної конференції, присвяченої 25-річчю біобази УжНУ в с. Колочава та пам’яті її Фундатора В. Ю. Штаєра (23-25 травня, 2008 р., с. Колочава, Між гірський район Закарпатської області). – Ужгород, 2008. – 132 с.
20. Заєць І. Є., Вознюк Т. М., Ковальчук М. В., Крамарьов С. М., Козировська Н. О. Активність консорціуму бактерій в агроценозах сої на забруднених важкими металами чорноземних територіях Придніпров’я // Наука та інновації. – 2007.– Т.3. – № 6. – С. 26-37.9
21. Ильин В.Б. Тяжелые металлы в системе почва - растение. – М., 1998. – 151 с.
22. Исидоров В. А. Введение в химическую экотоксикологию: Учеб. Пособие. – Санкт-Петербург: Химиздат, 1999. – 144 с.
23. Ігнатюк О. А. Залежність продукційно-енергетичних показників біосистем від рівня забруднення середовища важкими металами: Автореф. дис…канд. біол. наук. – К., 2002 – 19 с.
24. Іутинська Г. О., Петруша З. В., Іваниця В. А., Васильєва Т. В., Сопліна О. М. Токсичність і мутагенна активність важких металів – забруднювачів ґрунту. – № 2. – 2000. – С. 53-56.
25. Каракас К. Д., Сидоршина Т. Н., Ермак М. М. Влияние условий обеспечения цинком на рост кукурудзы и активность триптофансинтетазы // Физиология и биохимия культурных растений. – 1997. – №1. – С. 47-52.
26. Кобилецька М. С. Адаптація рослин кукурудзи та сої до токсичної дії іонів кадмію: Автореф. дис... канд. біол. наук: 03.00.12. – Львів: 2003. – 134 с.
27. Колупаєв Ю. Є. Стресові реакції рослин (молекулярно-клітинний рівень). – Харків, 2001. – 173 с.
28. Коршиков И. И. Адаптация растений к условиям техногенно загрязненной среды. – К.: Наук. думка, 1996. –240 с.
29. Кравець О. П. Сучасний стан та проблеми фітоочищення ґрунтів від радіонуклідів і важких металів // Физиология и биохимия культ. растений. – 2002. – Т. 34.– № 5. – С. 377-386.
30. Куриленко В. В., Осмоловская Н.Г. Биоиндикаторная роль высших растений при диагностике загрязнений водных экосистем на примере малых водоемов г. Санкт-Петербурга // Водные ресурсы . – 2007. – Т 34.–№ 6. – С. 757-764.
31. Кутукова Ю. Д. Стан важких металів у ґрунтах і нагромадження їхніми рослинами при внесенні опадів, стічних вод і мелиорантов : Дис. ... канд. біол. наук : 03.00.27. – М., 2001.
32. Гайсина Л. А., Хайбуллина Л. С. Влияние тяжелых металлов на морфологию почвенной водоросли Xanthonema Silva // Почвоведение. – № 3. – 2007. – С. 343-347.
33. Линдиман А. В., Шведова Л. В., Тукумова Н. В., Невский А. В. Повышение эффективности фиторемедиации почв, загрязненных тяжелыми металлами // Сборник материалов 4-й международной конференции "Сотрудничество для решения проблемы отходов" 31 января – 1 февраля 2007 г. – Харьков, 2007 – С. 47-48.
34. Лелюк А., Терек О. Використання регуляторів росту рослин як протекторних сполук у разі забруднення важкими металами рослин сої та соняшнику. // Вісник Львівського ун-ту. Серія біологічна. – Вип. 43. –2007 – С. 228-232.
35. Лобачевська О. В. Стратегія адаптацій мохів до забруднення довкілля важкими металами // Фізіологія рослин в Україні на межі тисячоліть. – К., 2001. – С. 73-76.
36. Маєвська С., Кардаш О., Демків Л., Лобачевська О. Особливості поглинання іонів важких металів мохом Plagiomnium undulatum (Hedw.) // Вісник Львівського ун-ту. Серія біологічна. – 2000. – Вип. 26. – С. 134-141.
37. Микієвич І. М. Роль аскорбінової кислоти та ферментів її метаболізму в адаптації рослин до токсичної дії іонів свинцю: Автореф. дис... канд. біол. наук: 03.00.12. – Л., 2003. – 20 с.
38. Михеєв О. В. Акумуляція та біогенна міграція кадмію у лісових екосистемах степового Придністров’я: Автореф. дис… канд. біол. наук: 03.00.16. – Дніпропетровськ, 1996. – 20 с.
39. Москальчук Л. Н. Средство для снижения степени токсичности загрязненных металлами, в том числе тяжелыми, лесных и сельскохозяйственных почв RU №2041910, С09К 17/14, С09К 101:00, 2008., Бюл. № 23. – 1995.
40. Новак В. А., Иванкина Н. Г. Природа электрогенеза и транспорта ионов в растительных клетках // Докл. АН СССР. – 1978. – Т.42.– №5. – С.1229.
41. Головач О., Козловський В., Демків О. Забруднення сільськогосподарських ґрунтів важкими металами та характер їхнього перерозподілу у рослинах кукурудзи. // Вісник Львівського ун-ту. Серія біологічна. –2004.– Вип. 38. – С. 205-21.
42. Овчаренко М. М. Тяжёлые металлы в системе почва-растение-удобрение // Химия в сельском хозяйстве. –1995. – № 4. – С. 8-18.
43. Овчинников Н. А., Безденежных В. С. Способ реабилитации почв RU №2064748, А01В 79/02, В09С 1/100, 10.08. – 1996.
44. Пархоменко Н. А. Агроэкологическая оценка действия тяжелых металлов в системе почва-растение : Дис... канд. с.-х. наук : 06.01.04 : Омск, 2004. – 237 c. РГБ ОД, 61:05-6/104.
45. Пацула О. І. Адаптаційні реакції соняшника до токсичної дії іонів свинцю та кадмію: Автореф. дис... канд. біол. наук: 03.00.12. – К.: 2006. – 19 с.
46. Alex-Alan F. de Almeida, Valle Raúl R., Mielke Marcelo S., Gomes Fábio P. Tolerance and prospection of phytoremediator woody species of Cd, Pb, Cu and Cr // Braz. J. Plant Physiol., 2007. – vol.19, №.2. – Р. 83-98.
47. Angelova V., Ivanova R. and Ivanov Kr. Study accumulation of heavy metals by plants in field condition // Geophysical Research Abstracts. – 2005. – Vol. 7. – 03931, SRef-ID: 1607-7962/gra/EGU05-A-03931.
48. Anthonovich J., Shaw J. Inter- and intraspecific variation of mosses in tolerances to copper and zinc // Evolution (USA). – 1987. – P. 1312-1325.
49. Anthony G., Kachenko A. C., Balwant Singh A., Naveen P., Bhatia B. Heavy metal tolerance in common fern species // Australian Journal of Botany. – 2007. – Vol. 55. – №1. – Р. 63-73.
50. Baker A. J. M., Reeves R. D., Hajar A. S. M. Heavy metal accumulation and tolerance in British populations of the metallophyte Thlaspi caerulescens J. and C. Presl (Brassicaceae) // New Phytol. – 1994. – №127. – Р.61–68.
51. Barocsi Attila, Csintalan Zsolt, Kocsanyi Laszlo, Dushenkov Slavik, Kuperberg J. Michael, Kucharski Rafal, Richter Peter I.. Optimizing Phytoremediation of Heavy Metal-Contaminated Soil by Exploiting Plants' StressAdaptation // International Journal of Phytoremediation. – 2003.– Vol. 5. – Issue 1. – Р. 13-23.
52. Barcelo J., Poschenrieder Ch. Plant-water relations as affected by heavy metal stress: a review // J. Plant Nutr. –1990. – Vol.13, №1. – P. 1-37.
53. Bohnert H. J., Jensen R. G. Metabolic Engineering for Increased Salt Tolerance – the Next Step // Functional Plant Biology. – 1996. – Vol. 23. – № 5. – Р. 661-667.
54. Bollag J.-M., Bollag V. B., Soil contamination and the feasibility of biological remediation // Bioremediation. Science and Applications / Skipper H.D., Turco R.F. eds. – Wisconsin (USA), 1995. – P.1-12.
55. Bowen J. E. Absorption of Copper, Zinc, and Manganese by Sugarcane Leaf Tissue . // Plant Physiol. – 2001. –№ 44 (2). – Р. 255–261.
56. Brooks R. R. Geobotany and hyperaccumulators. // Plants that hyperaccumulate heavy metals / Brooks RR (ed). CAB International,. – Wallingford (UK), 1998. – Р. 55–94.
57. Clemans S. Molecular mechanisms of plant metal tolerance and homeostasis // Planta. – 2001. – Vol. 212, № 4. – P. 475-486.
58. Conesa H. M., Faz A, Arnaldos R. Heavy metal accumulation and tolerance in plants from mine tailings of the semiarid Cartagena-La Unión mining district (SE Spain). // Sci Total Environ. 2006. – 31, 366(1) – Р. 1-11.
59. Deng D. M., Shu W. S., Zhang J., Zou H. L., Ye Z. H., Wong M. H. Zinc and cadmium accumulation and tolerance in populations of Sedum alfredii. // Environ Pollut. – 2007. – № 147. – Р. 381–386.
60. Ducic T., Polle А. Transport and detoxification of manganese and copper in plants // Braz. J. Plant Physiol. –vol.17 no.1. – 2005.
61. Varennes A., Torres M. O., Coutinho J. F., Rocha M. M. G. S., Neto M. M. P. M. Effects of heavy metals on the growth and mineral composition of a nickel hyperaccumulator. // J. plant nutr. – 1996. – Vol.19. – № 5 – Р. 669-676.
62. El-Sheekh M.M., El-Naggar A.H., Osman M. E. H., El-Mazaly E. Effect of cobalt on growth, pigments and the photosynthetic electron transport in Monoraphidium minutum and Nitzchia perminuta // Braz. J. Plant Physiol. –2003. – Vol. 15, №.3.
63. Fayiga A. O., Ma L. Q. Using phosphate rock to immobilize metals in soil and increase arsenic uptake by hyperaccumulator Pteris vittata. Sci Total Environ. // Sci Total Environ., 2005.
64. Folkenson L. Heavy metal accumulation in the moss Pleurosium schreberi on the surroundings of two peatfired power plants in Finland // Ann. Bot. Fen. – 1981. – Vol. 18. – № 3. – P. 245-253.
65. Gabbrielli R., Mattioni, C., Vergnano, O. Accumulation mechanisms and heavy metal tolerance of a nickel hyperaccumulator. // J. Plant Nutr. – 1991. – Vol. 14. – № 10. – Р.1067-1080.
66. Gardea-Torresdey J. L., Polette L., Arteaga S., Tiemann K.J., Bibb J., Gonzalez J.H. Determination of the content of hazardous heavy metals on Larrea tridentata grown around a contaminated area. // Proceedings of the Eleventh Annual EPA Conf. On Hazardous Waste Research / Edited by L.R. Erickson, D.L. Tillison, S.C.Grant and J.P. McDonald, Albuquerque, NM. – 1996. – Р. 660. 13
67. Gardea-Torresdey J. L, de la Rosa G, Peralta-Videa J. R., Montes M., Cruz-Jimenez G., Cano-Aguilera I. Differential uptake and transport of trivalent and hexavalent chromium by tumbleweed (Salsola kali). // Arch Environ Contam Toxicol. – 2005. – Vol. 48, № 2. – Р. 225-232.
68. Gohre Vera, Paszkowski Uta. Contribution of the arbuscular mycorrhizal symbiosis to heavy metal phytoremediation // Planta.– 2006. – № 223. – Р. 115-1122.
69. González A., Lynch. J.P. Subcellular and tissue Mn compartmentation in bean leaves under Mn toxicity stress // Functional Plant Biology. – Volume 26. – № 8. – 1999. – Р. 811-822.
70. Gemici U., Tarcan G. Assessment of the pollutants in farming soils and waters around untreated abandoned Türkönü mercury mine (Turkey). // Bull Environ Contam Toxicol. – 2007. – Vol. 79. – №1. – Р. 20-24.
