
Порушення жирового обміну
Жири присутні в їжі у формі тригліцеридів і ліпідів. Тригліцериди — це ефіри гліцерину з трьома молекулами жирних кислот, здебільшого олеїнової, пальмітинової і стеаринової. Ліпіди — також ефіри гліцерину, але в цих сполуках не всі гідроксильні групи заміщені радикалами жирних кислот. Розрізняють три класи ліпідів: фосфоліпіди (фосфатиди), гліколіпіди (цереброзиди) і сульфоліпіди (сульфатиди).
Поглинуті з їжею жири зазнають складних перетворень спочатку у травному каналі, а після всмоктування — в процесі метаболізму. Розлади травлення і всмоктування жирів у тонкому кишечнику мають дві головні причини: дефіцит жовчних кислот і дефіцит активної панкреатичної ліпази. Обмаль жовчі в кишечнику буває у випадках жовчнокам'яної хвороби, раку фатерового сосочка, запалення жовчовидільних шляхів, стискування їх рубцями. Без жовчних кислот жири не емульгуються і не активується панкреатична ліпаза. Ще серйозніше порушують травлення жирів різні ураження підшлункової залози: панкреатит, фіброз, травма, крововилив. Всмоктування жирних кислот страждає при проносах, нестачі жовчних кислот, малій кількості холіну і метіоніну в їжі, гіповітамінозі А, пошкодженні епітелію кишечника інфекційними агентами.
Зміни транспорту жирів найчастіше зводяться до гіперліпемії, тобто збільшення концентрації у крові. Розрізняють три види гіперліпемій — аліментарну, транспорту і ретенційну.
Аліментарна гіперліпемія виникає тоді, коли жир транспортується від кишечника до органів і тканин. Вона виникає через 2-3 год після їди і досягає максимуму через 4-6 год. Розвитку високої і тривалої аліментарної гіперліпемії сприяють низький рівень гепарину в крові (цукровий діабет, атеросклероз, нефроз, літній вік) і висока концентрація натрію хлориду, який гальмує ліпопротеїнову ліпазу.
Транспортна гіперліпемія спостерігається в тих випадках, коли жир транспортується з жирових депо до органів і тканин. Вивільнення жиру з депо стимулюється при стресі, голодуванні, цукровому діабеті. Жиромобілізуючу функцію виконують гормони: адреналін, тироксин, глюкагон, соматотропний та інші.
Ретенційна гіперліпемія характерна для всіх станів, які супроводжуються гальмуванням активності ліпопротеїнової ліпази (атеросклероз, цукровий діабет, механічна жовтяниця, гіпернатріємія). у Порушення проміжного обміну жирів проявляється кетозом, тобто нагромадженням кетонових тіл. До них належать ацетон, ацетооцтова і β-гідроксимасляна кислоти. Вони синтезуються в печінці з ацетил-КоА. Збільшення їх у крові називають гіперкето-немією, а виведення із сечею - кетонурією. Усі фактори, що збіднюють організм на вуглеводи або утруднюють їх використання, стимулюють вихід жирів із депо і кетоутворення. Це, перш за все, голодування, гарячка, виснажлива м'язова робота, тривалий емоційний стрес, цукровий діабет, печінкова недостатність.
Морфологічно порушення обміну жирів проявляється у вигляді жирових дистрофій (ліпідозів). Вони поділяються на паренхіматозні й стромально-судинні.
Паренхіматозні жирові дистрофії проявляються збільшенням жиру в клітинах, де він знаходиться в нормі, появою жиру там, де він у нормі не зустрічається, і синтезом аномальних жирів. Як правило, в клітинах скупчуються нейтральні жири.
Відкладання жиру в нежирових тканинах спостерігається тоді, коли він не піддається своєчасному розщепленню, окисленню і виведенню й надовго залишається в цитоплазмі.
У міокарді жирова дистрофія характеризується появою в кар-діоміоцитах дрібненьких жирових крапель (пиловидна дистрофія). Із часом краплі жиру збільшуються (дрібнокрапельна дистрофія), і жир повністю заповнює цитоплазму (крупнокрапельна дистрофія). Функція клітин знижується.
Головні причини жирової дистрофії міокарда — гіпоксія та інтоксикація, механізми розвитку — інфільтрація і декомпозиція. Процес має вогнищевий характер. Спочатку жир накопичується в кардіоміоцитах, розташованих за ходом венозної галузки капілярів, де гіпоксія виникає в першу чергу. Міокард стає в'ялим, на розрізі — тьмяним, глинисто-жовтим. Камери його розтягнуті, серце збільшене. Із боку ендокарда видно біло-жовту посмугованість (тигрове серце). Ця посмугованість зумовлена вогнищевим ураженням кардіоміоцитів за ходом венул і вен.
У печінці жирова дистрофія проявляється нагромадженням жир) в гепатоцитах. Печінка при цьому збільшена, глинисто-жовта з поверхні й на розрізі. Розрізняють пиловидну, дрібнокрапельну і крупнокрапельну жирову дистрофію гепатоцитів. Найважливіший механізм її розвитку - інфільтрація, рідше - декомпозиція (фанероз), тобто вивільнення протоплазматичного жиру з ліпопротеїдних структур.
Під інфільтрацією розуміють насичення клітинних елементів печінки жирами, що надійшли з кров'ю або синтезувалися безпосередньо в клітинах. Походження її буває різне. Аліментарна інфільтрація пов'язана з постійним вживанням жирної їжі. Хіломікрони, які у великій кількості синтезуються стінкою кишечника, транспортуються до печінки і затримуються в гепатоцитах. Другий механізм інфільтрації - активна мобілізація жиру з депо і транспорт вищих жирних кислот у печінку, де вони ресинтезуються у тригліцериди. Така інфільтрація виникає, коли виснажується депо глікогену. Третій варіант - аліпотропна інфільтрація, зумовлена нестачею холіну і метіоніну, які необхідні для синтезу фосфоліпідів. Інфільтрація може поєднуватися з порушенням обміну щитоплазматичних білків печінкових клітин. Хронічна жирова дистрофія печінки завершується атрофічним цирозом.
Серед їх причин на першому місці стоїть хронічний алкоголізм, на другому — цукровий діабет. Етиловий спирт стимулює ресинтез жирів у печінці, а діабетогенна дистрофія пояснюється зменшенням внутрішнього ліпотропного фактора - ліпокаїну.
Порушення обміну ліпідів у жирових депо призводить або до виснаження їх, або до відкладання надлишкових запасів жиру. Жирові депо — не просто склади ліпідів. Тут здійснюються інтенсивні метаболічні процеси: синтез і розпад тригліцеридів, розщеплення глюкози, утворення вищих жирних кислот із білків та вуглеводів.
Особливо тісні зв'язки існують між жировим і вуглеводним обмінами. Вони побудовані за принципом саморегуляції. Коли глюкоза є в надлишку, частина жирних кислот виключається з метаболізму і відкладається в депо у вигляді тригліцеридів. Якщо ж рівень глюкози у крові низький (голодування) або якщо вона не може бути метаболізована (цукровий діабет), тригліцериди розпадаються до жирних кислот, а ті викидаються у кров і утилізуються замість глюкози як джерела енергії. Адаптацію вуглеводно-жирових взаємовідносин до конкретних умов життя здійснюють нервова й ендокринна системи.
Типовим прикладом стромально-судинної жирової дистрофії вважається ожиріння. Цим терміном позначають процес надмірного відкладання жиру в жирових депо, коли маса тіла зростає не менше як на 20 % від розрахункової. У багатьох випадках ожиріння слід розглядати як симптом, а не хворобу.
Патогенетична класифікація передбачає три форми ожиріння: аліментарне, церебральне й ендокринне.
До аліментарної форми належать ті випадки, коли має місце систематичне переїдання, особливо в поєднанні з гіпокінезією. Повні люди споживають більше їжі, ніж це потрібно для підтримання енергетичного балансу. Апетит, тобто бажання приймати їжу, не зникає в них навіть тоді, коли втамовано голод. Такі люди не відчувають ситості, незважаючи на те, що запаси харчових речовин у них перевищують мінімально необхідний рівень.
Доведено, що в повних дітей кількість жирових клітин (адипоцитів) збільшена. У дорослих, які вживають багато їжі, виявлено збільшення розмірів адипоцитів, а не їх кількості. Численні спостереження підтвердили доцільність класифікації ожиріння, побудованої за цим принципом: гіпертрофічне — якщо збільшені розміри адипоцитів, гіперпластичне - якщо збільшена їх кількість.
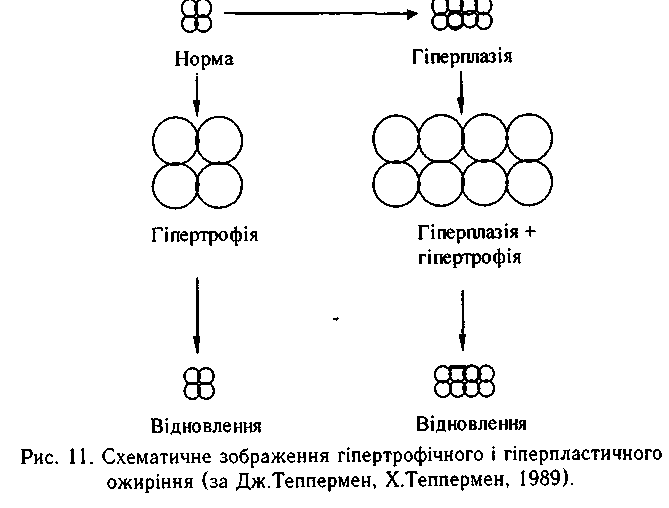
Церебральне ожиріння розвивається внаслідок патологічних процесів, що пошкоджують гіпоталамус. Споживання їжі регулюється харчовим центром, що складається з коркових і підкоркових відділів. Найважливішу роль відіграють вентромедіальні ядра гіпоталамуса, які виконують функцію центру ситості: оцінюють об'єм спожитої їжі (сигнали з розтягнутого шлунка) і реєструють кількість тепла, що виділяється в процесі травлення (сигнали насичення). Нейрони гіпоталамуса розглядаються як глюкостат, якщо концентрація глюкози в крові знижується-вмикає відчуття голоду; якщо ж рівень глюкози високий, суб'єктивно відчувається ситість. Цей саморегуляторний механізм ламається при деструкції гіпоталамічних ядер (травми, пухлини, запальні і процеси, оперативні втручання). Як результат розвиваєься апетит, який не можна втамувати, й ожиріння. Ендокринне ожиріння спостерігається при гіпофункції щитовидної і статевих залоз (гіпотиреоїдне, гіпогенітальне, клімактеричне). Збільшення продукції адренокортикотропного гормону адено-1 гіпофізом, глюкокортикоїдів — корою надниркових залоз, інсуліну — підшлунковою залозою також призводить до ожиріння. Доведена роль генетичного фактора у формуванні схильності до запасання жиру.
Ожиріння характеризується надмірним відкладанням жиру в підшкірній клітковині, сальнику, брижі, середостінні, осерді. Жирова тканина з'являється навіть там, де вона в нормі відсутня: в стромі міокарда, підшлунковій залозі.
За зовнішнім виглядом розрізняють симетричний (універсальний), верхній, середній і нижній типи ожиріння. Верхній тип ожиріння характеризується відкладанням жиру в ділянках обличчя, шиї, плечового пояса і молочних залоз, середній — у ділянці живота, нижній — у ділянці таза, стегон, гомілок.
В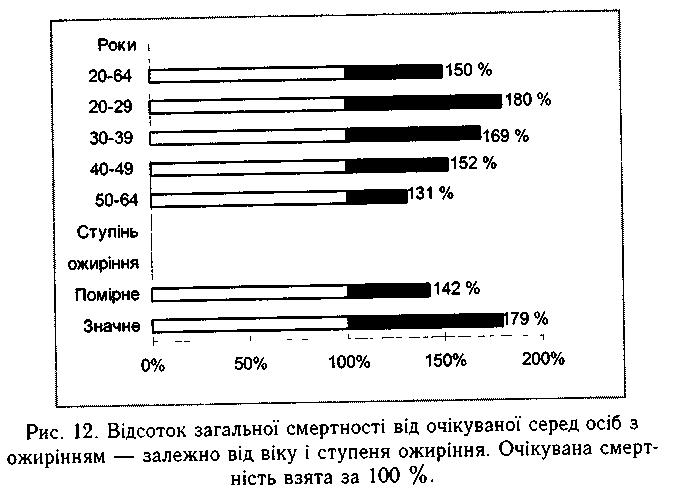 елике
клінічне значення має ожиріння серця.
Жирова тканина,
розростаючись під осердям, окутує серце,
ніби футляром. Вона проростає строму
міокарда між кардіоміоцитами, стискаючи
їх, що призводить до атрофії м'язових
клітин. Ожиріння більше виражене в
правій половині серця. Інколи весь
міокард правого
шлуночка замінюється жировою клітковиною,
у зв’язку з чим
може настати розрив серця.
елике
клінічне значення має ожиріння серця.
Жирова тканина,
розростаючись під осердям, окутує серце,
ніби футляром. Вона проростає строму
міокарда між кардіоміоцитами, стискаючи
їх, що призводить до атрофії м'язових
клітин. Ожиріння більше виражене в
правій половині серця. Інколи весь
міокард правого
шлуночка замінюється жировою клітковиною,
у зв’язку з чим
може настати розрив серця.
Тривалий позитивний енергетичний баланс і зайва маса тіла спричиняють передчасну смерть на третьому-п'ятому десятиріччях життя (рис. 12). Головна патологія у повних людей — атеросклероз судин серця, мозку і нирок, артеріальна гіпертензія, цукровий діабет, жовчнокам'яна хвороба, тромбоемболія, цироз печінки, легенева недостатність.
