
- •Методы валового анализа органической части почвы.
- •Углерод в почвах и методы определения углерода органической части почвы.
- •Методы валового анализа органической части почвы.
- •Углерод в почвах и методы определения углерода органической части почвы.
- •Показатели и методы оценки вещественного состава почв.
- •Эколого-химическая характеристика почвы.
- •Особенности в анализе почвенных загрязнений.
- •Металлы.
- •Органические соединения.
Показатели и методы оценки вещественного состава почв.
Вещественный состав характеризует набор и содержание в почве индивидуальных химических соединений, которые обуславливают специфические свойства почв. Он позволяет классифицировать почвы и исследовать механизмы почвообразования.
Карбонаты щелочно-земельных металлов и методы их определения.
Основную массу карбонатов в твердых фазах почвы составляют карбонаты кальция и магния. В почвах щелочного характера могут присутствовать также легкорастворимые карбонаты натрия.
Содержание и распределение карбонатов по почвенному профилю используют в качестве диагностических показателей в классификациях почв. От содержания карбонатов зависят химические и физические свойства, их плодородие и мелиоративность. Например, карбонат кальция при содержании 10 -15%, способствует образованию стабильных крупнопористых почвенных агрегатов, а увеличение его до 20 -255 приводит к уменьшению диффузивности почвенной влаги в связи с осаждением СаСО3 внутри капилляров.
Методы определения карбонатов основаны главным образом на измерении масс, объема или количества вещества СО2, выделившегося при их разложении, т.е. на тех же принципах, что и методы определения углерода органических соединений почвы, основанные на отгонке СО2.
Гипс в почвах и методы его определения.
Гипс обладает большей, чем СаСО3, растворимостью. Поэтому в незасоленных почвах в почвенном профиле он залегает ниже карбонатов и выше легкорастворимых солей. Разработаны классификации почв по залеганию верхней границы слоя с содержанием гипса 10%, по мощности гипсового горизонта, по строению гипсовых образований и по содержанию гипса.
Почвы, с содержанием CaSO4·2H2O 2 -10% относят к слабозагипсованным, с содержанием 10 -20% - к среднезагипсованным, с содержанием 20-40% - к сильнозагипсованным.
Методы определения гипса основаны на его полном извлечении из анализируемой навески почвы водой, растворами соляной кислоты или солей.
Содержание гипса рассчитывают по количеству извлеченных из почвы сульфат-ионов и кальция. При извлечении их из почвы необходимо учитывать, что в раствор оно могут переходит также из других соединений ( кальций, например может закрепляться в ППК вследствие ионообменных реакций с натрием и магнием). Поэтому при определении гипса в почвах одной из основных проблем является вычленение из общего количества найденных в процессе анализа ионов сульфата и кальция той их доли, которая перешла в раствор вследствие растворения именно гипса.
В России гипс извлекают из почв растворами 0,1 – 0,25М HCl. Из найденного в таком растворе количества SO42- вычитают то их количество, которое было определено в водной вытяжке из той же почвы. Этот прием, хотя и применяется очень широко, недостаточно корректен, т.к. гипс достаточно хорошо растворим (SCaSO4 = 2г/л). При низких содержаниях гипса результат будет значительно занижен.
В методах, рекомендуемых для определения гипса в лабораториях США, предусмотрено извлечение гипса водой при таком широком соотношении почвы и воды, которое позволяет полностью извлечь гипс из навески почвы.
Содержание гипса рассчитывают затем по результатам анализа той водной вытяжки и фильтрата из насыщенной водой почвенной пасты. В водной вытяжке определяют сульфат-ионы , в фильтрате из пасты – сульфат-ионы и кальций. Количество эквивалентов CaSO4 определяют по уравнению:
½ CaSO4 = a + b – c,
где а – общее количество эквивалентов SO42-, извлеченное из почвы водной вытяжкой, ммоль/100г почвы;
b - общее количество эквивалентов SO42-, перешедшее из твердых фаз почвы в жидкую фазу насыщенной водой пасты, ммоль/100г почвы;
с - количество эквивалентов SO42-, перешедшее в жидкую фазу пасты вследствие растворения гипса, ммоль/100г почвы. Величину с находят следующим образом. Если содержание эквивалентов SO42- и Са2+ в фильтрате из пасты равно или более 30ммоль·экв/л, то принимают количество эквивалентов SO42- равным 30ммол·экв/л. Если концентрация Са2+ больше концентрации SO42-, то количество эквивалентов SO42-, обусловленное растворением гипса, принимают равным содержанию эквивалентов сульфат-ионов в фильтрате из пасты; если концентрация Са2+ меньше концентрации SO42- - количество эквивалентов SO42- считают равным количеству эквивалентов Са2+.
Таким образом, в этом случае при вычислении содержания гипса по разности учитывается не общее количество сульфат-ионов, перешедшее в раствор из пасты, а лишь то, которое связано с легкорастворимыми солями.
Чтобы вычислить массовую долю (%) гипса в почве, количество миллимолей эквивалента гипса умножают на величину молярной массы его эквивалента:
CaSO4·2H2O% = моль(1/2 CaSO4) 0,086.
Легкорастворимые соли, методы определения и показатели засоления почв.
Для оценки степени и химизма засоления почв в водных вытяжках определяют общую концентрацию легкорастворимых солей и концентрацию входящих в их состав конкретных ионов. Степень засоления почв оценивают по массовой доле (%) сухого, или плотного, остатка или по сумме массовых доле отдельных ионов.
Сухим, или плотным, остатком называется массовая доля высушенного при 105о остатка, полученного выпариванием аликвоты водной вытяжки.
К засоленным относят почвы, содержащие легкорастворимые соли в количествах, растворимость которых превышает 10г в 100г воды при комнатной температуре. Все их считают токсичными для растений. Они увеличивают осмотическое давление почвенной влаги, снижая ее доступность для растений, могут оказывать специфическое токсическое действие и нарушать нормальное соотношение элементов минерального питания растений.
В нативном состоянии легкорастворимые соли находятся частично в составе почвенного раствора, частично в составе твердых фаз почвы. В обычных условиях это карбонаты, гидрокарбонаты, хлориды, сульфаты, нитраты и нитриты щелочных и щелочноземельных металлов.
При оценки засоления почв обычно определяют анионы (CO32-, HCO32-, Cl-
SO42-) и катионы (Ca2+, Mg2+, Na2+, K+).
Степень засоления почв оценивают либо по общему содержанию легкорастворимых солей в почве, либо по концентрации их в почвенных растворах. И этих показателей используют в качестве диагностических. В частности, к засоленным относят почвы содержанием легкорастворимых солей более 0,05 - 0,15% или с концентрацией их в почвенных растворах более 5 – 7г/л.
В России определение легкорастворимых солей проводят методом водной вытяжки. 5-кратный по отношению к массе почвы объем воды добавляют к навеске, суспензию взбалтывают и фильтруют. Однако этот раствор нельзя отождествлять с почвенным раствором, т.к. при добавлении воды к почве резко нарушается соотношение между твердой и жидкой фазами реальной почвы. Полевые влажность и влагоемкость различных почв неодинаковы, а соотношение массы почвы и объема воды в методе водной вытяжки всегда одно и то же (1 : 5). Поэтому глина и песок могут иметь в своем составе одинаковую массовую долю легкорастворимых солей, но при этом концентрация их в жидких фазах при приближении к влажности завядания для песка может быть в10 раз больше, чем для глины. При получении водной вытяжки протекают также процессы, которые влияют на результаты определения состава и содержания легкорастворимых солей:
1. Состав обменных катионов ППК находится в соответствии с составом жидкой фазы. Поэтому при получении водной вытяжки нарушаются ионообменные процессы может происходит замена обменного натрия на кальций (и магний) жидкой фазы суспензии (например, при анализе сильнозагипсованных почв).
2. При добавлении воды к почве может происходить усиление гидролиза ППК, содержащего обменный натрий:
П - Na+ + H2O ↔ П - H+ + Na+ + OH-, что приводит к увеличению РН раствора и титруемой щелочности.
3. В процессе получения водной вытяжки растворяются также и слаборастворимые соединения, что неизбежно сказывается на результатах оценки засоления почвы. В загипсованных почвах происходит растворение гипса. Содержание гипса в почве часто больше того, которое может растворяться в воде при приготовлении водной вытяжки, поэтому она будет являться насыщенным раствором CaSO4. Количество извлекаемого из почвы гипса будет выше того, которое в природных условиях содержится в почвенных растворах и результаты определения легкорастворимых солей будут при этом завышены.
4. По мере добавления к почве воды снижается содержание адсорбированного почвой СО2 за счет его растворения. Парциальное давление СО2 (РСО2), что приводит к изменению РН и растворимости труднорастворимых карбонатов, что также сказывается на результатах определения количества легкорастворимых солей.
Эти процессы практически сводятся к минимимуму при определении содержания легкорастворимых солей методом насыщенных водой почвенных паст. При приготовлении пасты к почве практически добавляют наименьшее количество воды, которое позволяет получить фильтрат, отсасывая его под вакуумом. Влажность насыщенной водой почвенной пасты отвечает максимальному количеству воды, которое удерживается почвой и не стекает в углубление, сделанное в почвенной массе. Таким образом, объем прибавляемой к почве воды зависит от ее влагоудерживающей способности.
Малое количество прибавляемой воды снижает степень гидролиза солей, растворимость СО2, количество растворенного гипса. Таким образом, в этом методе делается попытка воспроизвести или как можно меньше нарушить химические равновесия, свойственные реальной почве и получить фильтрат, который бы отражал свойства реальной жидкой фазы почвы.
Недостатком этого метода считают визуальный контроль точки насыщения почвы водой. При проведении анализа рекомендуется стандартизация степени измельчения почвы, времени экстракции и других факторов. Анализ должен быть проведен в короткий срок, исключающий влияние биологических процессов на состояние пасты. При этом в пастах может быть не достигнуто равновесие между твердой и жидкой фазами, что снижает воспроизводимость метода.
Таким образом, с некоторыми допущениями, метод водной вытяжки позволяет оценить общее содержание легкорастворимых солей в почвах, которое выражается массовой долей или числом ммоль·экв /100г почвы.
Метод насыщенных водой почвенных паст, также с рядом допущений, позволяет определить содержание солей в почвенных растворах, которое принято выражать в единицах концентрации компонентов легкорастворимых солей в фильтрате.
Проверка точности результатов анализа водных вытяжек.
Контроль точности выполнения анализа осуществляют сопоставлением суммы миллимолей-эквивалентов анионов и катионов в водной вытяжке. Количество миллимолей-эквивалентов анионов должно быть равно количеству миллимолей-эквивалентов катионов. Суммарная масса их не должна превышать массы сухого остатка.
Расчет содержания токсичных солей и способы представления результатов анализа водных вытяжек.
Принято считать, что ионы Cl-, Na+, Mg2+, К+ переходят из твердых фаз почвы в водную вытяжку в основном при растворении легкорастворимых или токсичных солей. Ионы НСО3-, SO42-, Са2+ поступают в водные вытяжки как при растворении токсичных солей, например NaHCO3, Na2SO4, MgSO4, так и солей малорастворимых, таких как гипс и кальцит, которые к токсичным не относят.
Содержание токсичных солей находят расчетным путем по уравнениям:
НСО3ˉтокс = НСО3ˉ - Са2+ , если НСО3ˉ > Са2+;
SO42-токс = SO42- - (Са2+ - НСО3ˉ), если НСО3ˉ < Са2+;
Са2+токс = Са2+ - SO42- - НСО3ˉ
где Са2+, SO42-, НСО3ˉ - общее количество эквивалентов ионов, которое было определено методом водной вытяжки, ммоль-экв/ 100 г почвы;
Са2+токс, SO42-токс, НСО3ˉтокс - количество эквивалентов ионов, которое перешло из твердых фаз почвы в водную вытяжку вследствие растворения токсичных солей, ммоль-экв/ 100 г почвы.
При вычислении массовой доли токсичных солей (%) сначала рассчитывают содержание эквивалентов токсичных ионов Са2+токс, SO42-токс, НСО3ˉтокс. Затем вычисляют и суммируют массовые доли (%) всех токсичных ионов (НСО3-, SO42-, Са2+, Cl-, Na+, К+, Mg2+). Этот показатель называют «суммой токсичных солей».
Для приблизительной оценки суммы токсичных солей предложено эмпирическое уравнение: _____________________
Σтокс.солей, % = (Na+ + Mg2+) / 15,
где Na+ и Mg2+ - количество эквивалентов натрия и магния, найденное методом водной вытяжки, ммоль-экв/ 100 г почвы.
Результаты анализа водной вытяжки обычно представляют в виде таблицы
(табл.13,стр.172).
Контрольные вопросы.
Задачи исследования вещественного анализа почв.
Карбонаты щелочных и щелочно-земельных металлов, их влияние на свойства почвы и методы определения.
Гипс в почвах, особенности определения его содержания в российских и зарубежных методиках.
Показатели степени засоления почв. Определение содержания легкорастворимых солей из водной вытяжки и из фильтрата из паст, достоинства и недостатки этих методик. Проверка точности анализа водной вытяжки.
Расчет содержания токсичных солей.
Лекция 11
Показатели и методы оценки группового (фракционного) состава соединений химических элементов в почвах.
Идентификация и количественное определение конкретного химического соединения в составе почвы часто затруднено подбором соответствующих растворителей. Поэтому часто определяют группы соединений химических элементов в почвах. В основе разделения на группы часто лежат различия в их растворимости. Группу рассматривают как совокупность сходных по свойствам химических соединений. Эти соединения участвуют в одних и тех же химических процессах и их набор и содержание отражают специфику почвообразования.
Поэтому при решении определенного типа задач можно ограничиться сведениями о групповом и фракционном составе соединений химических элементов в почвах.
Наиболее хорошо разработаны методы определения и интерпретации группового и фракционного состава гумуса. В практике исследования почв часто используют также показатели группового и фракционного определения соединений железа, алюминия, фосфора и др. При оценке группового состава часто выделяют водорастворимые соединения, обменные ионы ППК и группы соединений, входящие в состав твердых фаз почвы.
В практике исследования группового состава используют два подхода. В одном случае каждую из групп соединений определяют из отдельной навески анализируемой почвы, в другом - группы соединений определяют путем последовательной обработки одной и той же навески разными экстрагентами. Каждый из этих подходов имеет свои достоинства и недостатки.
При определении из разных навесок анализируемой почвы результаты анализа могут показывать содержание нескольких групп. Содержание какой- либо конкретной группы соединений находят по разности. Однако в связи с недостаточной селективностью экстрагирующих реагентов по разности можно получить отрицательную величину.
При определении групп соединений из одной и той же навески каждый последующий экстрагирующий раствор воздействует на уже измененную предыдущими обработками навеску почвы. Эта предшествующая обработка может нарушать соотношения входящих в состав почвы соединений, вследствие чего можно не получить адекватного представления о групповом составе соединений химического элемента в почве.
Показатели и методы определения группового состава соединений железа.
При определении группового состава соединений железа обычно применяют схему анализа, предложенную С.В.Зонном. Эта схеме предусматривает оценку содержания железа силикатных и несиликатных соединений. В составе несиликатных соединений выделяют окристаллизованные и аморфные, в составе аморфных – минеральные и органические соединения.
Железо жидких фаз почвы и обменные катионы железа.
В жидких фазах железо присутствует в виде Fe2+ и Fe3+. Их концентрация и соотношение зависят от кислотно-основных и окислительно-восстановительных свойств почвы. Они представлены аква-, гидроксо- и более сложными комплексными соединениями с минеральными и органическими лигандами.
Несиликатное (или свободное) железо представлено, главным образом оксидами и гидроксидами и может составлять до 90% общего железа. Определение несиликатного железа основано на восстановлении трехвалентного железа дитионитом натрия (Na2S2O4) и извлечении двухвалентного железа раствором цитрата натрия:
S2O42- + 2Fe3+ + 4OH- = 2SO32- + 2Fe2+ + 2H2O
SO32- + Fe3+ + 2OH- = SO42- + Fe2+ + H2O
Известно, что соединения трехвалентного железа менее растворимы, чем двухвалентного.
Концентрацию железа в полученных вытяжках определяют атомно-адсорбционным или фотометрическим методом.
В составе несиликатных соединений железа выделяют аморфные и окристаллизованные соединения. Окристаллизованные формы формируются при старении аморфных. Поэтому деление несиликатных соединений железа на аморфные и окристаллизованные достаточно условна.
Аморфные соединения железа увеличивают уровень РН-зависимых зарядов ППК и фосфорофиксирующую способность почв, влияют на почвенную структуру.
Кроме того, определяют железо органического вещества почвы.
Таким образом, в составе соединений железа определяют:
Железо силикатных соединений (Fec) рассчитывают как разность между валовым содержанием железа и содержанием железа несиликатных соединений:
Fec = Feвал - Feнc
2.Железо несиликатных соединений определяют методом Мера-Джексона.
2.1.Железо окристаллизованных соединений (Feокр) рассчитывают по разности:
Feокр = Feнс - Feа
2.2. Железо аморфных соединений (Feа) определяют методом Тамма.
2.2.1Железо органических соединений (Feорг) извлекают методом
Баскомба.
2.2.2 Железо неорганических аморфных соединений (Feа.н.)
рассчитывают по разности:
Feа.н. = Feа - Feорг
Соотношению Fec/ Feнc служит показателем степени выветривания почвенной массы. Чем оно выше, тем степень выраженности процессов выветривания. Отношение Feа/ Feнс называют коэффициентом Швертмана, который широко используют для оценки степени гидроморфизма почв гумидных ландшафтов. Его значение растет по мере увеличения степени гидроморфизма почв.
Показатели и методы определения группового состава соединений алюминия.
В почвах алюминий присутствует в почвенных растворах в виде разнообразных ионов, в ППК – в виде обменных катионов и в твердых фазах – в составе различных минералов. С алюминием всязывают формирование почвенной кислотности, способность почв к фиксации фосфатов, он токсичен для многих растений.
В почвенных растворах, водных и солевых вытяжках алюминий может существовать в виде аквакомплекса Al(H2O)63+, мономерных [Al(OH)2+, Al(OH)2+ и т.п. ] и полимерных [Al6(OH)126+, Al13(OH)327+ и т.п.] гидроксокомплексов и комплексов с другими неорганическими и органическими лигандами. Эти соединения обладают различными свойствами и оказывают различное влияние на почвы и растения. Поэтому делаются попытки раздельного определения групп соединений алюминия, присутствующих в жидких фазах почвы. Один из приемов такого разделения основан на использовании различной скорости замещения лигандов. По скорости замещения их выделяют кинетически лабильные соединения, в которых реакция завершается менее чем за 1мин, в отличие от кинетически инертных, в которых обмен лигандов происходит медленно. Кинетически лабильные соединения алюминия обладают относительно более сильными кислотными свойствами и они более токсичны для растений, чем кинетически инертные.
К кинетически лабильным относят аквакомплексы и мономерные комплексы алюминия, к кинетически инертным – более сложные полимерные комплексы и комплексы с органическими лигандами.
Определение алюминия основано на образовании его устойчивого соединения с оксихинолином, окрашенного в желтый цвет. Оксихинолят алюминия практически нерастворим в воде, но хорошо растворяется в хлороформе. Его экстрагируют из водной вытяжки и определяют в нем содержание алюминия фотоколориметрическим методом. Измерения проводят при λ=400нм.
Определению мешает железо, комплекс которого с оксихинолином также поглощает в условиях определения алюминия. Концентрацию железа учитывают, измеряя оптическую плотность органической фазы при 600нм, где оксихинолят алюминия не поглощает. Разность оптических плотностей при 400 и 600нм прямопропорциональна концентрации алюминия в растворе.
Кинетически лабильные формы алюминия экстрагируют в виде оксихинолята сразу после прибавления оксихинолина к водной вытяжке, кинетически инертные – через 30 минут после прибавления реагента.
Определение содержания обменного алюминия в ППК основано на извлечении его солевыми или буферными растворами. В России его извлекают 1М раствором KCl при соотношении почвы и раствора равном 1: 2,5 при взбалтывании суспензии в течение 1часа. Однако надо заметить, что этот показатель зависит от РН и несопоставим для почв с различной кислотностью. Поэтому, кроме обменного алюминия проводят определение так называемого экстрагируемого алюминия. Его извлекают их почвы буферными растворами с фиксированным значением РН (1М раствором ацетата аммония –РН=4,8)
В составе соединений алюминия твердой фазы почвы также, как и железо, определяют силикатные и несиликатные его соединения. Несиликатные соединения алюминия извлекают из почвы растворами гидроксида натрия при нагревании до 60о (метод Дюшофура-Сушье). Содержание силикатных соединений рассчитывают по разности между валовым содержанием алюминия и содержанием его несиликатных соединений.
Показатели и методы оценки группового состава соединений фосфора.
Сведения о групповом составе соединений фосфора используют при исследовании химии и генезиса почв, при оценке их плодородия и трансформации соединений фосфора в почвах.
Фосфор в почвах связан в основном с кальцием (Ca3(PO4)2, CaHPO4, 2Ca4H(PO4)3∙5H2O, CaHPO4·2H2O), с алюминием (AlPO4∙2H2O) и железом (FePO4∙2H2O). Все эти соединения труднорастворимы.
Схемы определения состава неорганических соединений фосфора основаны на извлечении фосфатов кальция, железа и алюминия. Проводят также идентификацию соединений, растворение или образование которых контролирует концентрацию фосфатов в жидких фазах почв и почвенных суспензий. Найденную концентрацию сравнивают с теоретической растворимостью соединений фосфора, характерных для данного типа почвы.
В процессе анализа одну и ту же навеску почвы обрабатывают последовательно химическими реагентами различного состава, предполагая, что каждый из них извлекает одну из групп соединений фосфора.
Самая простая схема фракционирования фосфатов проводится в четыре этапа.
Обработка навески почвы 0,1М раствором NaOH – извлекаются фосфаты железа и алюминия;
Обработка остатка 1М раствором NaCl и раствором цитрат-гидрокарбоната натрия – извлекается фосфор, сорбированный на осадке карбонатов во время операции (1);
Обработка раствором цитрата и гидрокарбоната натрия с добавлением дитионита натрия – извлекаются фосфаты, окклюдированные оксидами и гидроксидами железа;
Обработка 1н раствором соляной кислоты – извлекается фосфор, связанный с кальцием.
Количественное определение фосфора в вытяжках осуществляют фотоколориметрическим методом по фосфорно-молибденовой гетерополикислоте. В слабокислой среде фосфаты образуют с молибдатом аммония комплексные соединения, содержащие во внутренней координационной сфере анионы молибденовой изополикислоты:
H3PO4 + 12(NH4)2MoO4 + 12H2SO4 =
= H3PMo12O40 + 12 (NH4)2SO4 + 12H2O
H3PMo12O40 - соединение желтого цвета, который в присутствии мягких восстановителей переходит в синий за счет восстановления молибдена (МоVI→MoV). Состав и спектр поглощения сини зависит от восстановителя. В последнее время в качестве восстановителя обычно используют аскорбиновую кислоту в присутствии сурьмяно-виннокислого калия, который ускоряет реакцию и способствует устойчивости полученного соединения. Оно имеет максимумы светопоглощения при 690 и 882нм.
(см. спектр).
Фотоколориметрическое определение фосфора требует тщательного соблюдения методики, т.к. всякие отклонения неизбежно внесут ошибку.
Контрольные вопросы.
Оценка группового состава химических соединений, различные подходы к их определению.
Показатели и методы оценки группового состава соединений железа.
Показатели и методы оценки группового состава соединений алюминия.
Показатели и методы оценки группового состава соединений фосфора.
Лекция 12.
Показатели и способы оценки
подвижности химических элементов в почвах.
Подвижность химических элементов в почвах характеризуется как их способность переходить из твердых фаз почвы в жидкую.
Подвижность характеризуется показателями, позволяющими получить представление
о концентрации (активности) компонента в жидкой фазе почвы;
о содержании соединений, способных переходить из твердых фаз почвы в жидкую и обеспечивать в ней свойственную почвенной системе концентрацию компонента;
о потенциальной буферной способности почвы (ПБС) противостоять изменению концентрации компонента в жидкой фазе при изменении внешних условий, выносе или поступлении компонента в почву.
В качестве показателей рассматривают концентрацию компонента в почвенных растворах (или в близких к нему по составу системах – водных или солевых вытяжках с низким содержанием электролита) или рассчитывают химический потенциал – мольное изменение энергии Гиббса.
В практике исследования почв определяют фосфатный, известковый, калийный, аммонийный, нитратный и др. потенциалы. Их расчет основан на представлении о доминирующем процессе, который контролирует концентрацию химического элемента в жидкой фазе почвы. Например, расчет калийного потенциала основан на оценке ионообменных процессов, расчет фосфатного потенциала – на оценке процессов осаждения-растворения фосфатов.
Концентрацию (мг/л, моль/л) элемента в жидкой фазе называют фактором интенсивности процесса, а содержание его в твердой фазе (мг\100г почвы, ммоль/100г почвы) – фактором емкости.
Для подвижных элементов важным свойством почвы является ее способность поддерживать концентрацию этих элементов на определенном уровне по мере потребления их растениями.Это свойство почвы называют буферностью.
Потенциальную буферную способность почвы (ПБС) часто оценивают по соотношению показателей емкости (Q) и интенсивности ( I ).
Рассмотрение совокупности этих показателей позволяет получить наиболее полную информацию о подвижности химического элемента в почве и может служить основой оценки возможной миграции элемента, поглощения его почвами, доступности растениям.
Рассмотрим это на примере подвижности фосфатов и калия.
Оценка подвижности почвенных фосфатов.
Фосфаты в почве присутствуют в виде труднорастворимых соединений. Легкорастворимые фосфаты самостоятельно существовать в почвах не могут, т.к. фосфат-, дигидрофосфат- и гидрофосфат-ионы реагируют со многими почвенными катионами сообразованием труднорастворимых соединений, наиболее растворимыми из которых являются фосфаты алюминия и железа, а также дигироортофосфат кальция.
Степень подвижности фосфатов оценивают по концентрации фосфат-ионов в водных или близких им по составу солевых вытяжках, по активности фосфат-ионов (Н2РО-4., НРО42-) в вытяжках или по величине фосфатного потенциала (0,5рСа +р Н2РО-4). Формально фосфатный потенциал выражает произведение растворимости Са(Н2РО4)2 и характеризует возможность перехода фосфат-ионов из твердых фаз почвы в почвенный раствор, т.е. является фактором интенсивности процесса. Его рассчитывают по результатам анализа вытяжек из почвы 0,01М раствором СаC12.
Подвижность фосфатов контролируется значением РН, поэтому предложены уравнения расчета фосфатного потенциала для разных значений кислотности.
Например, для РН=8
Ф.п. = 9/10рСа +1/5рН2РО-4 +4/5рНРО42-.
В кислых почвах концентрация фосфат-ионов может контролироваться растворением фосфатов алюминия или железа и тогда рекомендуется расчет по уравнениям:
Ф.п. = 1/3 рFe + pН2РО-4 или 1/3рAl + рН2РО-4
Однако при производственных обследованиях территорий подвижность элементов в почвах характеризуют, как правило, одним показателем – фактором емкости, оценивающим содержание подвижных соединений в почве. Для этого используют различные методы в зависимости от свойств почвы. Эти методы различаются составами экстрагирующих растворов и соотношениями почва- раствор.
Основываясь на сопоставлении запасов подвижных соединений фосфора в почвах с урожаями сельскохозяйственных культур и их отзывчивостью на внесение фосфорных удобрений для каждого метода установлены граничные содержания подвижных фосфатов, которые соответствуют той или иной обеспеченности почв фосфатами.
Оценка подвижности калия в почвах.
При оценке подвижности калия можно определить и фактор интенсивности и фактор емкости, но обычно определяют только первый.
Степень подвижности калия (фактор интенсивности) можно оценить по величине калийного потенциала. Переход калия в жидкую фазу зависит не только от его состояния в почве, но и от его способности обмениваться на другие катионы ППК. При проведении исследований обычно учитывают обмен ионов калия на катионы кальция и магния:
П – ½(Са2+ + Mg2+) + К+↔ П – К+ + ½(Са2+ + Mg2+)
В качестве калийного потенциала рассматривают мольное изменение стандартной свободной энергии Гиббса (∆G0):
∆G0 = -2,303RT (рК+ - 0,5рСа2+), где рК+=-lg aK+, pCa2+=-lg aCa2+
или при стандартных термодинамических условиях (Р=101,3кПа, Т=298оК)
∆G0 = - 1364 (рК+ - 0,5рСа2+) кал/моль.
Часто калийный потенциал выражают просто величиной (рК+ - 0,5рСа2+)
и считают, что оптимальным условиям калийного питания растений соответствуют ее значения, равные 1,8 – 2,2.
Увеличение калийного потенциала может привести к недостатку калия, уменьшение – к его избытку. При увеличении рК+ - 0,5рСа2+ равновесие реакции смещается в сторону образования продуктов реакции, калий входит в ППК, вытесняя кальций и магний в жидкую фазу; при уменьшении рК+ - 0,5рСа2+ калий переходит в жидкую фазу почвы, а ионы кальция и магния поглощаются твердыми фазами почвы.
Определение рК+ - 0,5рСа2+ можно провести потенциометрически с помощью ионоселективных электродов, которые позволяют оценить концентрации ионов калия и кальция в почвенных суспензиях и вытяжках из почв.
Контрольные вопросы.
Что понимают под подвижностью химических элементов в почве?
Показатели, позволяющие определить подвижность: фактор интенсивности, фактор емкости, потенциальная буферная способность.
Методы оценки подвижности фосфатов. Почему подвижность фосфатов оценивают обычно фактором емкости?
Методы оценки подвижности калия. Почему подвижность калия оценивают обычно фактором интенсивности?
Лекция 13
Показатели и методы оценки кислотно-основных свойств почв.
Кислотно-основные свойства почв характеризуют специфическим набором показателей. Универсальным показателем, который определяют во всех почвах, независимо от их свойств и используют практически при решении любых проблем, является рН (вспомнить, что это такое).
Величина рН позволяет дать сравнительную оценку активности Н+ и ОН—ионов в жидких фазах исследуемых почвенных систем – реальных почв, паст, почвенных суспензий. В почвоведении кислотность, которая характеризуется величиной рН, часто называют актуальной кислотностью. В таком же понимании можно использовать термин актуальная щелочность, связанный с активностью гидроксил-ионов (рН +рОН=14). Но величины рН и рОН не дают сведений о количестве содержащихся в почве кислотных и основных компонентах, которые определяют уровни этих показателей. Такие сведения получают, определяя потенциальную кислотность и общую щелочность.
Для удобства использования в практических целях потенциальную кислотность можно рассматривать как показатель почвенной кислотности, характеризующий количество кислотных компонентов в почве, а общую щелочность – как показатель щелочности, характеризующий количество основных компонентов в почве.
Принято считать, что потенциальная кислотность связана главным образом с обменными катионами ППК, которые проявляют свойства кислот – ионами Н+ и Al3+. Методы определения потенциальной кислотности основаны на обработке навески почвы растворами солей. В результате такой обработки эти катионы вытесняются из ППК вследствие ионного обмена. Их количество определяют титрованием щелочью.
Щелочность почв в основном связывают с анионами слабых кислот, которые проявляют свойства оснований вследствие гидролиза и присутствуют в почвах в составе различных солей – легко-, средне- и труднорастворимых. В соответствие с растворимостью эти соли переходят из твердых фаз почвы в почвенный раствор. Поэтому определение таких компонентов основано на анализе почвенных растворов, фильтратов из насыщенных водой почвенных паст, водных вытяжек. Количество извлеченных из почвы анионов-оснований определяют титрованием сильной кислотой и находят величину общей щелочности (ее иногда называют титруемой или титровальной). Кроме общей, определяют конкретные виды щелочности – карбонатную, боратную и др.
Таким образом, для оценки кислотности и щелочности используют две группы показателей. Первую группу составляют величины рН различных почвенных систем, вторую группу – потенциальная кислотность и общая щелочность. Эти показатели характеризуют разные аспекты кислотно-основных свойств почвы и не всегда взаимозаменяемы. Часто величину рН рассматривают как интенсивный показатель кислотно-основных свойств почвы ( фактор интенсивности), а потенциальную кислотность и общую щелочность – как экстенсивные показатели (факторы емкости).
(см.таблицу 15 стр210).
Способы оценки актуальной кислотности почв.
рН почвы прежде всего зависит от способности присутствующих в почве кислот к диссоциации. Чем сильнее выражена эта способность, чем большими константами диссоциации, или константами кислотности, характеризуются компоненты, тем большее влияние при прочих равных условиях они оказывают на рН.
С позиции теории кислот и оснований Бренстеда-Лоури аквакомплексы металлов рассматриваются как кислоты. Они вытесняют из воды ионы Н+. Однако однозарядные катионы щелочных металлов и двухзарядные катионы щелочно-земельных металлов проявляют очень слабые кислотные свойства и как кислоты практически не влияют на рН растворов. Кислотные свойства в воде проявляют двух- и особенно трехзарядные катионы переходных металлов. Например,
Al(H2O)63+ + H2O = Al(H2O)5OH2+ + H3O+ pKa0 =5,02
Fe(H2O)63+ + H2O = Fe(H2O)5OH2+ + H3O+ pKa0 =2,19
Для сравнения вспомним, что отрицательный логарифм константы кислотности уксусной кислоты (pKa0) равен 4,75. Следовательно, аквакомплекс железа более сильный донор протонов, чем аквакомплекс алюминия и даже более сильный, чем уксусная кислота.
Измерение рН непосредственно в почве проводят довольно редко. Обычно рН измеряют в почвенных суспензиях, приготовленных из воздушно-сухих почвенных проб. Это технически довольно удобно и позволяет стандартизовать условия проведение анализа.
Определение рН проводят потенциометрическим методом. Одним из осложняющих факторов такого определения является суспензионный эффект. Он связан с наличием в системе твердых фаз, несущих на своей поверхности электрический заряд. Суспензионный эффект проявляется в различии значений рН, измеренных в суспензии и в ее фильтрате и возникает при использовании электрода сравнения с жидкостным контактом. Вследствие различной скорости диффузии ионов через границу раздела жидкостного соединения электрода сравнения и анализируемой среды возникает разность потенциалов, или диффузный потенциал. Он возникает и при анализе истинных растворов. Для уменьшения диффузного потенциала резервуар электрода сравнения заполняют раствором хлорида калия, т.к. ион K+ и Cl- обладают практически одинаковой химической подвижностью. Однако, в почвенных суспензиях в присутствии заряженных коллоидов, подвижность K+ и Cl- становится различной, что приводит к возникновению суспензионного эффекта. Чтобы уменьшить его влияние рекомендуют проводить измерение рН после отстаивания суспензии, при этом индикаторный электрод опускают в суспензию, а электрод сравнения
- в надосадочную жидкость. Величина суспензионного эффекта уменьшается с уменьшением концентрации твердых частиц, поэтому при измерении рН стандартизируют соотношение почвы и воды в суспензии.
В России в качестве стандартных условий используют соотношение почва- вода равное 1:2,5 при заполнении электрода сравнения 1М раствором хлорида калия.
Для оценки актуальной кислотности часто измеряют рН в солевых вытяжках с низкой концентрацией электролита (0,01М CaCl2). В них значительно снижается суспензионный эффект, быстрее устанавливается равновесие. Кроме того, концентрация соли в такой суспензии близка к концентрации электролитов в почвенном растворе, а кальций преобладает среди обменных оснований ППК. Значение рНCaCl2 обычно на 0,5 единиц ниже рНН2О. В этом случае в качестве показателя актуальной кислотности используют известковый потенциал:
рНCaCl2 +1/2lg a CaCl2 или рН – 1/2рСа2+
Эта величина мало зависит от разбавления и концентрации солей, она достаточно стабильна и характеристична для почв. Однако нужно помнить, что в кислых почвах возможен обмен ионов кальция на ионы алюминия, т.е. этот процесс обязательно окажет влияние на величину актуальной кислотности.
Результаты измерения рН зависят от условий приготовления суспензии, в частности , от времени ее настаивания. В разных методиках это время различно ( от 5минут до 1 часа). В солевых суспензиях равновесие наступает быстрее, чем в водных. Независимо от свойств почв, для приготовления вытяжек используют воду, не содержащую СО2 !
Способы оценки потенциальной кислотности почв.
Потенциальная кислотность позволяет получить представление об общем содержании в почвах кислотных компонентов. В рамках потенциальной кислотности выделяют два вида почвенной кислотности: обменную и гидролитическую (рН-зависимую).
Обменная кислотность обусловлена относительно сильными кислотными компонентами – главным образом ионами Н+ и Аl3+, которые компенсируют постоянные (перманентные) отрицательные заряды ППК. Ее определяют, обрабатывая навеску почвы небуферным раствором нейтральной соли (KCl,NaCl). Вытеснение обменных катионов при этом происходит при значениях рН, обусловленным кислотно-основными свойствами почвы. Таким образом, обменная кислотность является той частью почвенной кислотности, которая может проявиться в реальной почве, например при внесении удобрений. В России обменную кислотность определяют при исследовании любых кислых почв. Почву обрабатывают однократно 1М раствором КСl при отношении почва-раствор 1:2,5. Количество кислотных компонентов определяю титрованием аликвоты вытяжки раствором NaOH по фенолфталеину. Так как однократная обработка навески в таком узком отношении почва – раствор не позволяет полностью вытеснить из ППК обменные ионы водорода и алюминия, результат иногда умножают на 1,75.
Гидролитическая кислотность связана с переменными (рН-зависимыми) зарядами ППК. В сущности, переменные заряды ППК или переменная емкость ионного обмена часто обусловлены компонентами, которые обладают свойствами слабых кислот. К ним относят гидроксокомплесы алюминия различного состава, аллофаноподобные вещества, закрепленные на поверхности и в кристаллической решетке минералов, функциональные группы органических соединений и пр. Слабые кислоты диссоциируют при довольно высоких значениях рН, часто не свойственных самой почве. При диссоциации в жидкой фазе почвы появляются ионы водорода, а ППК приобретает дополнительный отрицательный заряд.
РН-зависимую кислотность в России определяют, используя раствор гидролизующейся соли (1М раствор ацетата натрия), поэтому ее называют гидролитической. Однако при этом определяется суммарное значение рН-зависимой и обменной кислотности.
Таким образом, общепринятыми показателями потенциальной кислотности почв являются: обменная кислотность, характеризующая количество наиболее сильных кислотных компонентов, которые компенсируют перманентные отрицательные заряды ППК и вытесняются из ППК при значениях рН, свойственных реальным кислым почвам (фактор интенсивности); рН-зависимая кислотность, характеризующее общее количество кислотных компонентов, включая компоненты, обуславливающие обменную кислотность, и те, которые вытесняются из рН-зависимых позиций ППК; эта кислотность проявляется при более высоких, чем обменная, значениях рН. Разница показателей рН- зависимой и обменной кислотности может служить фактором емкости при оценке потенциальной кислотности почв.
Щелочность почв. Способы оценки.
Щелочность почв связывают с анионами слабых минеральных (S2-, PO43-, CO33-, HSiO3-, H2BO3-, HS-, HPO42-, HCO3-) и относительно более сильных, главным образом, органических кислот. Эти анионы проявляют свойства акцепторов протонов или оснований; при взаимодействии с водой они принимают от нее протон и в растворе появляются свободные гидроксил –ионы.(разобрать) В слабозасоленных почвах акцептором протонов может быть обменный натрий ППК, который взаимодействует с водой подобно соли слабой кислоты.(разобрать)
Актуальная щелочность и ее оценка.
Активность ОН- - ионов в жидких фазах почв, или актуальную щелочность, оценивают, измеряя рН различных почвенных систем: почвенных растворов, насыщенных водой почвенных паст, водных почвенных суспензий(1:1; 1:2,5; 1:5; 1;10). В России традиционно это рН суспензий 1:2,5. Однако при анализе засоленных почв методом водной вытяжки возможно использование суспензии 1:5 (ГОСТ 26423 – 85). Часто при анализе столь различных систем получают различные значения рН. Это связано не столько с суспензионным эффектом, сколько со смещением карбонатных равновесий. Ионы СО32- и НСО32- присутствуют в почвах в виде легкорастворимых солей NaHCO3 и Na2CO3 и в виде малорастворимого СаСО3. В соответствии с растворимостью последнего, карбонатные ионы в естественных условиях могут переходить из твердых фаз почв в жидкую, а при проведении анализа – в жидкие фазы паст и суспензий.
В растворах соотношение СО32- и НСО32- зависит от парциального давления СО2 в газовых фазах почвенных систем (РСО2):
2НСО3-↔ СО32- + СО2 + Н2О
Уменьшение РСО2 сдвигает равновесие в сторону образования СО32-, что приводит к росту рН вследствие того, что СО32- является более сильным донором протонов или более сильным основанием, чем НСО3-, и наоборот, увеличение РСО2 сдвигает равновесие в сторону образования гидрокарбонат-ионов и рН уменьшается.
Определение различных видов щелочности.
Для раздельного определения оснований, обуславливающих щелочность почвенных систем, обычно используют потенциометрическое титрование.
В зависимости от природы оснований кривые их потенциометрического титрования имеют различную форму. (см.рис)
Кривые титрования S2- и СО32- двухступенчаты. На кривой титрования РО43- также два скачка – один обусловлен переходом РО43-→ НРО42-, второй – переходом НРО42- → Н2РО4-. Третий скачок не выражен вследствие низкой основности иона Н2РО4-.
Продукты титрования S2- и СО32- летучи. Если эти продукты удалить и провести обратное титрование раствором NaOH, то кривые титрования будут иметь только один скачок, обусловленный титрованием избытка кислоты, добавленной при прямом титровании. Продукты титрования фосфатов нелетучи, поэтому кривые прямого и обратного титрования их имеют одинаковую форму. Кривые прямого и обратного титрования HSiO3-, H2BO3-, Al(OH)4- имеют одинаковую форму и один скачок.
Анионы органических кислот обладают очень слабыми основными свойствами, поэтому кривые их прямого титрования практически не имеют скачка. Щелочность, обусловленную анионами органических кислот, находят по объему NaOH, израсходованному на обратное титрование анализируемого раствора от рН=4 до рН=7.
В отсутствие сульфидов карбонатную щелочность рассчитывают по уравнению Щкарб = (V1С1(1/z кислоты) – V2C2(1/z щелочи)) V0 100/Val m , ммоль-экв/100г почвы.
где V1 – объем кислоты, пошедший на прямое титрование до рН=4,мл;
С1 – нормальная концентрация раствора кислоты,мол-экв/л;
V2 – объем щелочи, пошедший на обратное титрование до рН=7,мл;
С1 – нормальная концентрация раствора щелочи,мол-экв/л;
V0 – общий объем воды, добавленной к почве,мл;
Val – объем аликвоты вытяжки, взятый на титрование, мл;
m – масса навески почвы, г.
Общее содержание бора и боратную щелочность определяют титрованием в присутствии маннита. Если рН раствора, в котором проводили прямое и обратное титрование, довести до 7 и добавить манит, то в отсутствие бора рН не изменится, а при наличии бора (Н3ВО3 при РН=7) образуется более сильная борно-маннитовая кислота и рН понижается. В этом случае проводят титрование раствором NaOH до рН=7. Боратную щелочность рассчитывают по уравнению:
Щб = z V2C2(1/z щелочи)) V0 100/Val m , ммоль-экв/100г почвы.
где z – множитель, учитывающий диссоциацию борной кислоты в зависимости от рН вытяжки (справочные данные,табл.19,стр233)
Сульфидную щелочность можно ожидать в восстановленных почвах, если почвенные пробы хранились при естественной влажности в герметически закрытых сосудах. В таких случаях проводят анализ отдельной порции раствора. Аликвоту раствора подкисляют соляной кислотой до рН=3, переводя карбонаты в угольную кислоту, а сульфиды в сероводород. Газообразные продукты отгоняют с помощью инертного газа в раствор гидроксида бария. СО2 осаждается в виде ВаСО3, осадок отфильтровывают и в растворе определяют содержание сульфидов титрованием кислотой.
Общее содержание бора и боратную щелочность определяют титрованием в присутствии маннита. (табл.20,стр235).
Соотношение рН и общей щелочности почв.
В перечень показателей, уровни которых позволяют получить представление о природе щелочности почв, введено соотношение общей щелочности и суммы ммоль-экв кальция и магния, извлекаемых из почвы методом водной вытяжки. Принято считать, что их разность показывает содержание карбонатных ионов, присутствующих в почвах в виде легкорастворимых солей – карбонатов и гидрокарбонатов натрия и калия.
Если сумма кальция и магния равна или выше общей щелочности, то считают, что она связана с карбонатами щелочно-земельных металлов.
Контрольные вопросы.
1.Показатели и способы оценки актуальной кислотности и актуальной щелочности.
2. Актуальная кислотность. Химические соединения, наличием которых она определяется. Способы ее оценки в водных и солевых вытяжках (особенности измерения и расчета, связь с известковым потенциалом).
3. Потенциальная кислотность – обменная и гидролитическая. Химические соединения, наличием которых определяется каждая из них. Способы их оценки.
4. Общая щелочность. Химические соединения, наличием которых она определяется. Способы ее количественной оценки.
Лекция 14
Показатели и способы оценки катионообменных свойств почв.
Катионообменные свойства почв связаны с наличием отрицательных зарядов на поверхности минеральных и органических компонентов почвенно-поглощающего комплекса. Отрицательные заряды ППК компенсируются положительно заряженными противоионами – обменными катионами.
Среди зарядов ППК выделяют постоянные, или перманентные, и переменные. Постоянные заряды связаны с изоморфными замещениями в кристаллических решетках глинистых минералов. Их количество обусловлено структурными особенностями минералов и не зависит от рН и других внешних факторов. Переменные заряды часто называют рН-зависимыми. Их количество связано с ионизацией функциональных групп органических компонентов почв и поверхностных ОН- -групп оксидов и гидроксидов. Оно увеличивается с ростом рН, зависит от валентности противоионов, концентрации электролита и др.
Основные понятия, термины, показатели.
Наиболее общим показателем катионообменных свойств почвы является емкость катионного обмена (ЕКО). По существу его величина отражает количество отрицательных зарядов ППК или количество положительных зарядов обменных катионов, компенсирующих эти заряды. Часто под ЕКО понимают общее количество катионов одного рода, которое почва может удержать в способном к обмену состоянии в заданных условиях. Основной показатель – количество вещества положительных зарядов обменных катионов, компенсирующих отрицательные заряды ППК или количество вещества эквивалентов обменных катионов (ммоль-экв/кг, ммоль-экв/100г почвы). Т.к. ЕКО зависит от рН, определяют реальную, или эффективную ЕКО(ЕКОэфф), и стандартную (ЕКОст). ЕКОэфф характеризует емкость катионного обмена в кислотно-основных условиях, близких к реальным.
ЕКОст характеризует свойства почвы при заданном значении РН и позволяет сравнивать ЕКО почв с различными кислотно-основными свойствами.
Понятия, близкие по своему содержанию к ЕКО – сумма обменных катионов и сумма обменных оснований. Обменными катионами считают все катионы, которые находятся в ППК в состоянии, способном к обмену. Это могут быть катионы Н+, Al3+, Ca2+, Na+ и др. К обменными основаниям относят катионы, которые не способны проявлять кислотные свойства (Ca2+, Mg2+, Na+, К+), но могут вытеснять из ППК ионы, такими свойствами обладающие (Н+, Al3+).
Почвы, которые в составе обменных не содержат катионов с выраженными кислотными свойствами (Н+, Al3+), называют почвами, насыщенными основаниями. Почвы, содержащие в ППК такие ионы, называют почвами, не насыщенными основаниями.
При оценке катионообменных свойств, кроме ЕКО, суммы обменных катионов и суммы обменных оснований, определяют состав и содержание каждого из обменных катионов (ммоль-экв/100г почвы).
Эти показатели используют при характеристике степени выраженности некоторых почвенных процессов, например, степень солонцеватости почв оценивают по доле (%) обменного натрия от ЕКО, степень насыщенности почвы основаниями – по доле (%) обменных оснований от ЕКО.
Приемы оценки катионообменных свойств .
Для определения величины показателей этих свойств, навеску почвы обрабатывают растворами солей. В результате обменные катионы вытесняются из ППК, а их место занимает катион соли.
В истории учения о сорбционных процессах огромное практическое значение имеют работы выдающегося почвоведа К-К-Гедройца. Именно на почвах – природных ионообменниках устанавливались основные закономерности ионного обмена.
П-Na+ + NH4+ ↔ П- NH4+ + Na+
Константа равновесия этой реакции равна:
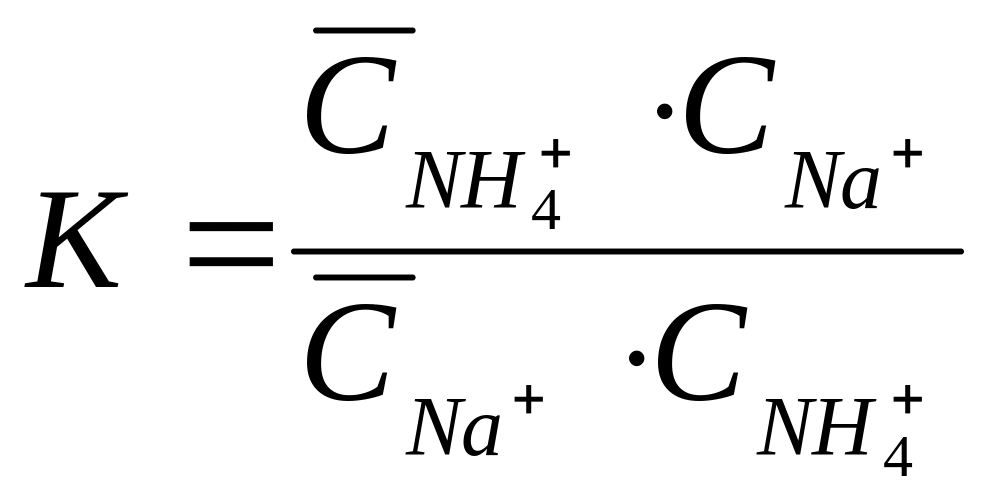 ,
где
,
где
![]() - количество ионов, адсорбированных
почвой;
- количество ионов, адсорбированных
почвой;
![]() -концентрация
ионов в жидкой фазе.
-концентрация
ионов в жидкой фазе.
Отсюда следует:
 ,
т.е. при обмене равновалентных катионов
отношение
,
т.е. при обмене равновалентных катионов
отношение
адсорбированных почвой ионов пропорционально отношению этих ионов в растворе независимо от концентрации. Это значит, что однократной обработкой навески почвы раствором катиона-вытеснителя невозможно удалить из ППК все обменные катионы. Часть их останется в соответствии с соотношением катионов, которое установится в жидкой фазе суспензии. С каждой последующей обработкой концентрация вытесняемых катионов в жидкой фазе суспензии будет уменьшаться, что приведет в конечном итоге к их полному вытеснению из ППК.
Количество вытесняемых катионов несколько возрастает с увеличением концентрации катиона-вытеснителя и объемом раствора, но это увеличение ограничено.
Методы оценки ЕКО.
1). Оценка ЕКОэфф.
Оценку эффективной ( реальной) ЕКО проводят, обрабатывая навеску почвы небуферным раствором нейтральной соли. При этом допускают, что РН почвенной суспензии, получаемой в процессе анализа, обусловлено свойствами почвы и результаты определения ЕКО отражают реальную катионообменную способность почвы. Однако необходимо учитывать, что при обработке почвы раствором соли из ППК вытесняются катионы, проявляющие кислотные свойства и рН увеличивается. Поэтому определяемое значение ЕКОэфф отличается от ЕКО почвы в реальных условиях. Обычно ЕКОэфф находят расчетным путем, суммируя результаты определения вытесненных из ППК обменных катионов или результаты определения обменных оснований и обменной кислотности.
Определение
ЕКО проводят в два этапа. На первом
насыщают ППК катионом - вытеснителем,
многократно обрабатывая навеску почвы
раствором соли, вытесняя обменные
катионы в раствор. На втором этапе
определяют количество поглощенного
почвой катиона – вытеснителя, по которому
получают представление о величине ЕКО.
В качестве катионов – вытеснителей
используют
![]() Концентрация
катиона – вытеснителя варьируется от
0,01 до1 моль-экв/л. В России оценку ЕКО
проводят при рН=6,5 растворами хлорида
бария, в иностранных методиках чаще
всего растворами ацетата аммония при
рН=7.
Концентрация
катиона – вытеснителя варьируется от
0,01 до1 моль-экв/л. В России оценку ЕКО
проводят при рН=6,5 растворами хлорида
бария, в иностранных методиках чаще
всего растворами ацетата аммония при
рН=7.
Определение количества сорбированного катиона- вытеснителя осуществляют двумя методами: 1) определяют его содержание в растворе до и после при каждой обработке навески, затем суммируют израсходованное количество; 2) после полного насыщения катион-вытеснитель полностью вымывают из ППК, используя его способности к образованию малодиссоциированных соединений. Катион – вытеснитель из ППК переводят в осадок или комплекс и определяют его содержание любым подходящим методом.
Очень интересны методы, основанные на использовании органических красителей катионного типа - метиленового синего или метиленового фиолетового При проведении анализа навеску почвы многократно обрабатывают раствором красителя заданной концентрации и по ее уменьшению в результате ионообменного поглощения находят ЕКО.
Концентрацию красителя находят фотометрически. Метод прост, производителен и пригоден для почв любого состава.(Попробовать!)
2.Определение суммы обменных оснований.
Для быстрой оценки суммы обменных оснований обычно используют метод Каппен-Гильковича. Навеску почвы взбалтывют с точно отмерянным объемом титрованного раствора 0,1н HCl, сусупензию фильтруют, аликвоту фильтрата титруют 0,1н раствором NaOH. Сумму обменных оснований находят по разности между количеством Н+ в исходном растворе кислоты и количеством Н+, оставшемся в растворе после взаимодействия с почвой.
Применение метода основано на допущении, что при однократной обработке почвы раствором кислоты ионы Н+ вытесняют все обменные основания и не разрушают ППК. Метод не используют, когда нужна точная оценка суммы обменных оснований.
Легкорастворимые соли, гипс карбонаты мешают определению обменных оснований. Поэтому для определения ЕКО и суммы обменных оснований в почвах различного типа разработаны различные варианты.
При анализе некарбонатных незасоленных почв обменные основания вытесняют из ППК растворами солей. Для вытеснения обменных оснований из почв, насыщенных основаниями рекомендуется использовать раствор хлорида аммония, для анализа почв, не содержащих легкорастворимых солей, карбонатов и гипса – раствор ацетата аммония. Это связано с тем, что одним из продуктов взаимодействия не насыщенных основаниями почв с хлоридом аммония является соляная кислота, которая способствует растворению почвенных компонентов и тем самым приводит к завышению результатов определения обменных оснований:
![]() +
+
![]()
При вытеснении обменных оснований из не насыщенных основаниями почв раствором ацетата аммония ион водорода связывается в слабую уксусную кислоту, которая не мешает определению:
![]()
![]()
При определении обменных оснований в карбонатных почвах необходимо учесть влияние карбонатов кальция на результаты анализа. Например, в методе Тюрина обменные основания вытесняют 1М раствором хлорида натрия. В фильтрате определяют общее количество кальция, магний, вытесненный из ППК и общую щелочность. Содержание обменного кальция находят по разности между общим количеством эквивалентов кальция (ммоль) и общей щелочностью фильтрата.
При оценке свойств степных почв часто определяют содержание обменного натрия. Оно служит оценкой солонцеватости почв и позволяет рассчитать дозы мелиорантов при мелиорации. Один из методов (метод Гедройца) основан на вытеснении обменного натрия ионом Са2+. К навеске почвы добавляют СаСО3, дистиллированную воду и суспензию активно перемешивают потоком СО2.
![]()
![]()
Контрольные вопросы
Факторы, определяющие катионообменные свойства почвы. Постоянные и переменные заряды ППК.
Основные показатели: ЕКО, сумма обменных катионов, сумма обменных оснований.
Методы оценки ЕКО.
Определение суммы обменных оснований.
Лекция 15.
Ю.С.Другов, А.А Родин. Анализ загрязненной почвы и опасных отходов. М.,БИНОМ.
Лаборатория знаний. 2007.
