
- •1. Понятие о гемобластозах, общая характеристика.
- •4. Гистиоцитарные опухоли
- •5. Опухоли из тучных клеток
- •2. Лейкозы: определение понятия, общая характеристика, принципы классификации.
- •Принципы классификации лейкозов
- •3. Этиология лейкозов: роль вирусов, химических канцерогенов, ионизирующего излучения.
- •4. Опухолевая природа лейкозов. Роль аномальной экспрессии онкогенов.
- •5. Особенности лейкозных клеток, их морфологическая, цитохимическая, цитогенетическая и иммунологическая характеристика.
- •6. Острые лейкозы: классификация. Особенности кроветворения и картины периферической крови. Характеристика понятий «ремиссия», «рецидив».
- •1. Острые миелоидные лейкозы (омл)
- •7. Хронические лейкозы: классификация. Особенности кроветворения и картины периферической крови. Бластный криз.
- •1. Хронические миелопролиферативные лейкозы:
- •2. Хронические лимфопролиферативные лейкозы:
- •8. Парапротеинемические гемобластозы (множественная миелома, первичная макроглобулинемия, болезнь тяжелых цепей).
- •9. Основные нарушения в организме при лейкозах, их механизмы.
- •10. Принципы диагностики и терапии лейкозов. Диагностика лейкозов
- •Лечение
- •Принципы современного лечения лейкозов
- •Основные лекарственные препараты, применяемые для лечения лейкозов:
4. Опухолевая природа лейкозов. Роль аномальной экспрессии онкогенов.
Клетки, экспрессирующие онкогены, которые являются факторами роста, могут размножаться в отсутствие этих факторов в определенных условиях. Некоторые онкогены служат рецепторами для факторов роста. Особенно интересны рецепторы с тирозинкиназной активностью — рецептор для ЭФР и HER2-neu. Оба рецептора становятся онкогенами при активации.
Онкоген c-ros относится к инсулиновым рецепторам, c-kit — к рецептору для ТцФР и, как упоминалось выше, рецептор для КСФ-1 представлен онкогеном c-fms. Точечные мутации в трансмембранной области HER2 приводят к трансформации этого рецептора в онкоген. В случае v-erbB и v-kit делеция экстрацеллюлярного связывающего домена приводит к потере негативного контроля за цитоплазматическим доменом, вызывая его активацию в качестве протоонкогена c-erb.
Другие рецепторные онкогены также являются продуктом различных структурных повреждений, таких как точечные мутации в цитоплазматическом домене, делеции, которые способствуют усилению или изменению трансформирующего сигнала.
Среди ранних (быстрых) рострегулирующих генов имеется несколько протоонкогенов: c-myc, c-fos и c-jun. Последние два являются транскрипционными факторами, которые играют важную роль в дополнительной активации стимулированных клеток. Ранние рострегулирующие гены повышают уровень мРНК в периоде Go — Gi- Поздние рострегулирующие гены представляют собой гены, повышающие уровень мРНК в середине фазы Gi — S. Описано достаточно большое число подобных генов.
Некоторые гены, имеющие большое значение в контроле пролиферации клеток, не идентифицированы как члены ДНК-синтезирующего аппарата, например c-myb в гемопоэтических клетках. Поздние рострегулирующие гены также вовлекаются в переход от фазы S к митозу.
Помимо этого, среди онкогенов выделяют группу трансдукторов: это гуанидинтрифосфат (ГТФ)-связывающие белки и белки с тирозинкиназной активностью. Среди ГТФ-связывающих белков выделяют семейство Ras, которое является одним из наиболее важных семейств онкогенов, возникающих в результате точечных мутаций. В нем выделяют Н-, К- и N-формы. Нормальные белки p21-ras всегда прикрепляются через липид к внутренней поверхности плазматической мембраны и могут выступать, подобно белку G, в роли трансдуктора.
Блокада ras-функции приводит к ингибированию пролиферативного ответа на многие митогены. В то же время точная роль ras в сигнальной трансдукции остается достаточно иллюзорной, поскольку хорошо описанные ростстимулирующие пути действия вторичных мессенджеров пока не определены как «мишени» для генетических мутаций в опухолях человека. Так, гены фосфолипазы С, чьи продукты генерируют двойной митогенный сигнал (увеличение содержания внутриклеточного Са2+ и активация протеинкиназы С), могут рассматриваться как кандидаты на роль онкогенов.
Сверхэкспрессия протеинкиназы С может вызывать трансформацию клеток in vitro.
Другая группа белков, прикрепленных к внутренней стороне плазматической мембраны, обладает тирозинкиназной активностью, подобно рецепторам для факторов роста, таким как ТцФР. Они часто служат мишенью трансдукции ретровирусами, среди которых идентифицированы scr, fps, yes, fgr, sea, syn и fos. Однако они слабо активированы в опухоли человека за исключением широко экспрессируемого scr.
Патогенез лейкозов.
Согласно мутационно-клоновой теории, в основе происхождения лейкозов лежат мутация и опухолевая трансформация ранних клеток-предшественниц гемопоэза (клеток II и III классов) под влиянием лейкозогенного фактора (ионизирующей радиации, химических веществ, вирусов и др.). В результате происходит выход кроветворных клеток из-под контроля регулирующих систем макроорганизма с активацией их деления на фоне подавления дифференцировки. Формируется клон опухолевых (лейкозных) клеток - потомков одной первоначально мутировавшей клетки (моноклоновая опухоль), которые заселяют (инфильтрируют) костный мозг. В моноклоновой стадии опухолевые клетки чувствительны к химиотерапии.
В процессе развития лейкоза (опухолевая прогрессия) происходят качественные изменения составляющих субстрат опухоли клеток, обусловленные нестабильностью их генетического аппарата, что проявляется нарушениями структуры хромосом, анэуплоидией, переходом части ранее неактивных в клетке генов в активное состояние (феномен дерепрессирования генов). Эти изменения ведут к появлению новых клонов опухолевых клеток, среди которых в процессе жизнедеятельности организма, а также под воздействием лечебных средств, применяемых в химиотерапии заболевания, «отбираются» наиболее автономные клоны. В результате моноклоновая опухоль превращается в поликлоновую злокачественную опухоль. На этой стадии развития лейкоза лейкозные клетки становятся устойчивыми к цитостатической терапии, метастазируют в органы и ткани, в норме не участвующие в гемопоэзе, образуя очаги экстрамедуллярного кроветворения (табл. 14-11).
О клоновой природе лейкозов свидетельствуют возможность перевивки лейкоза мышам путем введения одной лейкозной клетки; продукция гомогенного иммуноглобулина при парапротеинемических гемобластозах (миеломная болезнь, макроглобулинемия Вальденстрема и др.); однотипность лейкозных клеток (несущих на поверхности иммуноглобулины одного класса и подкласса) при хроническом лимфолейкозе; наличие специфических хромосомных изменений в опухолевых клетках (транслокации, делеции). Частным подтверждением клонового происхождения лейкозов является обнаружение в 80-90% случаев хронического миелолейкоза аномальной филадельфийской (Ph') хромосомы (рис. 14-12) в миелоидных клетках, включая гранулоцитарный, эритроидный и мегакариоцитарный ростки. Этот факт служит неоспоримым доказательством происхождения хронического миелолейкоза из одного патологического клона, родоначальницей которого является плюрипотентная стволовая клетка-предшественница миелопоэза (КОЕ-ГЭММ).
Таблица 14-11. Основные стадии патогенеза лейкозов
Стадия |
Характеристика |
Инициация |
Лейкозогенный фактор (радиация, вирусы и др.) действует на стволовые кроветворные клетки II-III классов, вызывая их опухолевую трансформацию в результате мутационного превращения протоонкогенов в онкогены и инактивации антионкогенов |
Промоция |
Активация и гиперпролиферация лейкозных клеток при действии промотора с формированием клона лейкозных клеток, идентичных по фенотипу и генотипу (моноклоновая стадия) |
Инфильтрация |
«Расселение» лейкозных клеток в костном мозгу с угнетением нормального гемопоэза |
Прогрессия |
Формирование множества клонов лейкозных клеток, различающихся по фенотипу и генотипу (поликлоновая стадия), и естественный отбор наиболее автономных из них, что ведет к «озлокачествлению» заболевания |
Метастазирование |
Образование очагов патологического кроветворения вне костного мозга за счет способности лейкозных клеток к инвазии, интра- и экстравазации, миграции по сосудистой системе, имплантации и пролиферации в различных тканях и органах |
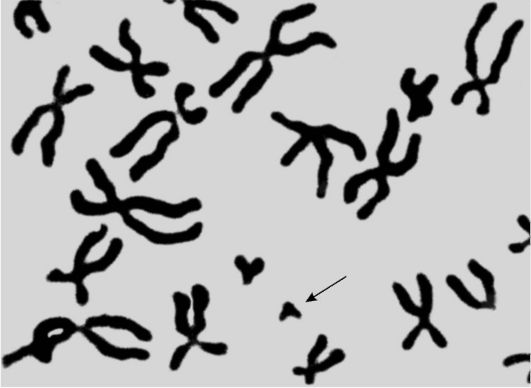
Рис. 14-12. Аномальная Ph'-хромосома в клетке больного хроническим миелолейкозом
Общие нарушения в организме при лейкозах проявляются следующими клиническими синдромами: анемическим (головокружение, слабость, повышенная утомляемость, одышка и т.д.), геморрагическим (кровотечения из десен, носа, кишечника, кровоизлияния в жизненно важные органы), инфекционным (рецидивирующие инфекции вследствие угнетения фагоцитоза, микробицидной функции лейкоцитов, синтеза антител и т.д.), интоксикационным (тошнота, рвота, снижение аппетита, уменьшение массы тела и т.д.) и гиперпластическим (увеличение размеров и нарушение функции различных органов) (табл. 14-12).
Причинами смерти при лейкозах являются резкое малокровие и тяжелая общая интоксикация, поражение жизненно важных органов (лейкозная инфильтрация, обширные кровоизлияния). Непосредственной причиной смерти больных могут стать инфекционные осложнения (пневмонии, сепсис, перитонит).
Таблица 14-12. Патогенез основных клинических синдромов лейкозов

Аномальная экспрессия протоонкогенов, продукты которых имеют трансмембранное, а также подмембранное расположение (c-src) и обладающих протеинкиназной или другой, пока неизвестной активностью (c-abl, c-fms, c-erb A, c-erb В, c-ras, c-trk, c-mas и др.) может приводить к злокачественной трансформации клеток.
Процесс этот тесным образом связан с нарушением регуляторных сигналов, поступающих на клеточную мембрану, и с аутокринной стимуляцией, нерегулируемой извне, что ведет к пролиферации клетки-мишени. Возможно, функция других трансформирующих генов, комплементирующих с данной категорией онкогенов, завершает процесс малигнизации.
Непосредственным образом с указанной группой онкогенов, работающих по «аутокринной схеме», связаны гены, продукты которых участвуют в переносе сигнала от рецепторов ФР (факторы риска) внутрь клетки, в ядро (например, c-ras и с-myc).
Продукты этих онкогенов способны, по-видимому, самостоятельно служить регуляторными сигналами или, другими словами, обеспечивать клеткам независимость от экзогенных ФР.
В этом случае онкобелки как бы сами выполняют роль эндогенных ФР, обеспечивая клетке необходимый побуждающий импульс и переход из G0 периода в G клеточного цикла. К этой категории онкогенов могут быть отнесены, по-видимому, c-myb, c-fos, c-ski, c-rel, продукты которых имеют ядерную локализацию.
Таким образом, превращение нормальных клеток в злокачественные в условиях in vivo и in vitro имеет сложный, кооперативный характер взаимодействия нескольких функций различных по своей природе клеточных онкогенезов. В качестве примера кооперации онкогенов вновь приведем новые данные, полученные при изучении трансформации первичных клеток животных и человека при помощи онкогена c-Ha-ras 1.
Фактор риска – это какое-либо свойство или особенность человека или какое-либо воздействие на него, повышающие вероятность развития болезни или травмы. Наиболее важными факторами риска являются пониженная масса тела, небезопасный секс, высокое кровяное давление, потребление табака и алкоголя и небезопасные вода, санитария и гигиена.
Общий патогенез и клеточная кинетика лейкозов
Схематическая цепь событий:
1. Воздействие мутагенного фактора на кроветворную клетку. Мутагенными факторами могут быть один, несколько или все перечисленные факторы риска.
2. Повышение мутабельности нормальных кроветворных клеток. В одной или нескольких из них появляется специфическая мутация, которая ведёт к опухолевой трансформации клетки - мутанта.
3. Клетка - мутант приобретает новые свойства, в частности способности к безграничной пролиферации, претерпевает новые мутации, постепенно увеличивает свою злокачественность (опухолевая прогрессия). Среди приобретённых новых свойств клетки - мутанта.
4. Созревание лейкозной клетки приостанавливается на той стадии, где произошла мутация, но сохраняется способность к пролиферации.
5. Вследствие остановки созревания нормальных клеток не образуется. Вместо них в костном мозге накапливаются лейкозные клетки, которые замещают и вытесняют сохранившиеся нормальные клетки.
6. Возникает недостаточность образования нормальных клеток и в периферической крови развивается лейкопения, анемия, тромбоцитопения.
7. Лейкозные клетки приобретают способность к метастазированию. Они проникают в другие органы и ткани, пролиферируют в них. Особенно выражена лейкозная пролиферация в тканях РЭС. Отсюда увеличение печени, селезёнки, лимфоузлов (т.е. гепато- и спленомегалия и лимфоаденопатия). Из особенностей патогенеза происходит общая симптоматика лейкозов.
Таблица 1. Основные стадии патогенеза лейкозов
Стадия |
Характеристика |
Инициация |
Лейкозогенный фактор (радиация, вирусы и др.) действует на кроветворные клетки II–III классов, вызывая их опухолевую трансформацию в результате мутационного превращения протоонкогенов в онкогены и инактивация антионкогенов |
Промоция |
Активация и гиперпролиферация лейкозных клеток при действии промотора с формированием клона лейкозных клеток, идентичных по фенотипу и генотипу (моноклоновая стадия) |
Инфильтрация |
«Расселение» лейкозных клеток в костном мозгу с угнетением нормального гемопоэза |
Прогрессия |
Формирование множества клонов лейкозных клеток, различающихся по фенотипу и генотипу (поликлоновая стадия), и естественный отбор наиболее автономных из них, что ведёт к «озлокачествлению» заболевания |
Метастазирование |
Образование очагов патологического кроветворения вне костного мозга за счёт способности лейкозных клеток к инвазии, интра- и экстравазии, миграции по сосудистой системе, имплантации и пролиферации в различных тканях и органах |
Общая симптоматика лейкозов складывается из 5-и синдромов, которые могут быть различной степени выраженности:
1. Анемический - связан с тем, что клон лейкозных клеток вытесняет и подавляет эритроидный росток, следовательно, падает количество эритроцитов и гемоглобин в крови.
2. Геморрагический - связан с тем, что клон лейкозных клеток вытесняет и подавляет мегакариоцитарный росток, следовательно, падает количество тромбоцитов и появляется наклонность к кровотечениям.
3. Склонность к инфекциям (бактерии, вирусы, грибки) связана с подавлением гранулоцитарного или лимфоидного ростка, следовательно, выпадает специфическая (иммунитет) и неспецифическая (фагоцитоз) защита. Причём, инфекции могут быть одной из причин смерти таких больных.
4. Гиперпластический синдром - связан с метастазированием лейкозных клеток в другие органы, размножением и увеличением этого органа. Наиболее подвержены печень (гепатомегалия), селезёнка (спленомегалия), лимфоузлы (лимфоаденопатия), на втором месте кожа (кожные инфильтраты), мозговые оболочки (нейролейкоз), почки, миокард, лёгкие.
5. Интоксикация - лихорадка, потливость, слабость, похудание.
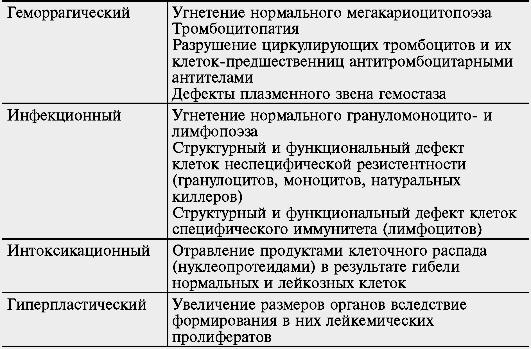
Таблица 2. Патогенез основных клинических синдромов лейкозов
Синдром |
Механизм развития |
Анемический |
Угнетение нормального эритропоэза Укорочение жизни эритроцитов вследствие качественного дефекта клеток, образующихся вне костного мозга в результате компенсаторной активации экстрамедуллярного эритропоэза Разрушение циркулирующих эритроцитов и их клеток-предшественниц антиэритроцитарными АТ
|
Геморрагический |
Угнетение нормального мегакариоцитопоэза Тромбоцитопатия Разрушение циркулирующих тромбоцитов и их клеток-предшественниц антитромбоцитарными АТ Дефекты плазменного звена гемостаза
|
Инфекционный |
Угнетение нормального грануломоноцито- и лимфопоэза Структурный и функциональный дефект клеток неспецифической резистентности (гранулоцитов, моноцитов, натуральных киллеров) Структурный и функциональный дефект клеток специфического иммунитета (лимфоцитов)
|
Интоксикационный |
Отравление продуктами клеточного распада (нуклеопротеидами) в результате гибели нормальных и лейкозных клеток
|
Гиперпластический |
Увеличение размеров органов вследствие формирования в них лейкемических пролифератов |
Опухолевая природа лейкозов человека была подтверждена многочисленными исследованиями и в настоящее время считается наиболее признанной.
Неопластические черты лейкозов подтверждаются многими фактами:
размножением незрелых клеток с подавленной способностью к дифференциации, атипичных по морфологическим свойствам, метаболизму и характеру роста;
сходством условий и закономерностей трансплантации лейкозной, саркоматозной и раковой ткани;
общими закономерностями развития иммунитета при лейкозе и других злокачественных заболеваниях;
аналогией в существовании как высоко- и низколейкозных линий, так и высоко- и низкораковых линий животных с возможностью выведения путем инбридинга линий животных, в большей или меньшей степени поражаемых лейкозом или раком; наличием в организме при лейкозе активных бластомогенных веществ;
снижением канцеролитических свойств сыворотки при лейкозе;
наличием опухолевидных форм лейкоза;
экспериментальным получением как лейкоза, так и других неоплазм с помощью одних и тех же экзогенных факторов;
временной задержкой развития лейкоза и рака одними и теми же средствами и др.
Признание неопластической природы лейкоза открыло новые возможности для изучения как этого заболевания, так и других новообразований.
Таким образом, краткий обзор истории изучения лейкоза показывает, что развитие представлений о проявлениях и сущности лейкоза человека и животных протекало параллельно: те положения, которые были установлены в результате изучения патологии лейкоза человека, оказались вполне приложимыми и к лейкозу животных.
Патогенез.
Этиология. Установлена роль в возникновении лейкоза ряда причинных факторов — онкогенных вирусов, ионизирующей радиации, химических канцерогенных веществ, генетических аномалий.
Онкогенные вирусы вызывают спонтанный лейкоз птиц, мышей, кошек, крупного рогатого скота, обезьян и других животных. Они относятся к С-типу РНК-содержащих вирусов. Вирус может передаваться через кал, мочу, отделяемое носа и глотки и от матери потомству (например, при висцеральном лимфоматозе кур). В эксперименте лейкоз воспроизводится путем введения бесклеточных фильтратов лейкозных клеток больных животных здоровым.
Вирусное происхождение лейкоза человека доказано в отношении злокачественной лимфомы Беркитта (ДНК-содержащий вирус Эпстайна — Барр) и Т-клеточного лейкоза (ретровирус типа C-HTLV). При этом обнаружен как вирус, так и антитела к нему не только у больных, но и у здоровых лиц, контактировавших с ними. Считается возможной горизонтальная передача вируса Т-клеточного лейкоза при переливании крови, половом контакте (подобно вирусу СПИДа — HTLV-3). Косвенным показателем этиологической роли РНК-содержащих онкогенных вирусов является наличие в лейкозных клетках больных обратной транскриптазы (РНК-зависимой ДНК-полимеразы). В структуре нормальной ДНК человека найдены участки так называемых протоонкогенов, гомологичных вирусным онкогенам и активирующихся при хромосомных и генных мутациях, что связывают с определенной формой лейкоза.
Общепризнана опухолевая природа лейкозов. Заболевание развивается из одного клона кроветворных клеток, подвергшихся хромосомной мутации (клоновая теория). Дальнейшее распространение лейкозного клона по всей кроветворной ткани и за ее пределами осуществляется путем метастазирования.
Основным признаком злокачественного роста является необратимость патологических изменений в клетках, составляющих субстрат опухоли, и дальнейшее нарастание этих изменений (опухолевая прогрессия; Foulds, 1949). Сущность опухолевой прогрессии при лейкозах сводится к тому, что по мере прогрессирования лейкозного процесса нарастает его малигнизация, появляются новые патологические клоны, нечувствительные к цитостатическим препаратам.
(Проявлениями прогрессирования лейкозов являются угнетение нормальных ростков кроветворения, способность лейкозных клеток расти вне органов гемопоэза, скачкообразная или постепенная утрата бластными элементами ферментной и морфологической специфичности.
