- •1. Понятие о гемобластозах, общая характеристика.
- •4. Гистиоцитарные опухоли
- •5. Опухоли из тучных клеток
- •2. Лейкозы: определение понятия, общая характеристика, принципы классификации.
- •Принципы классификации лейкозов
- •3. Этиология лейкозов: роль вирусов, химических канцерогенов, ионизирующего излучения.
- •4. Опухолевая природа лейкозов. Роль аномальной экспрессии онкогенов.
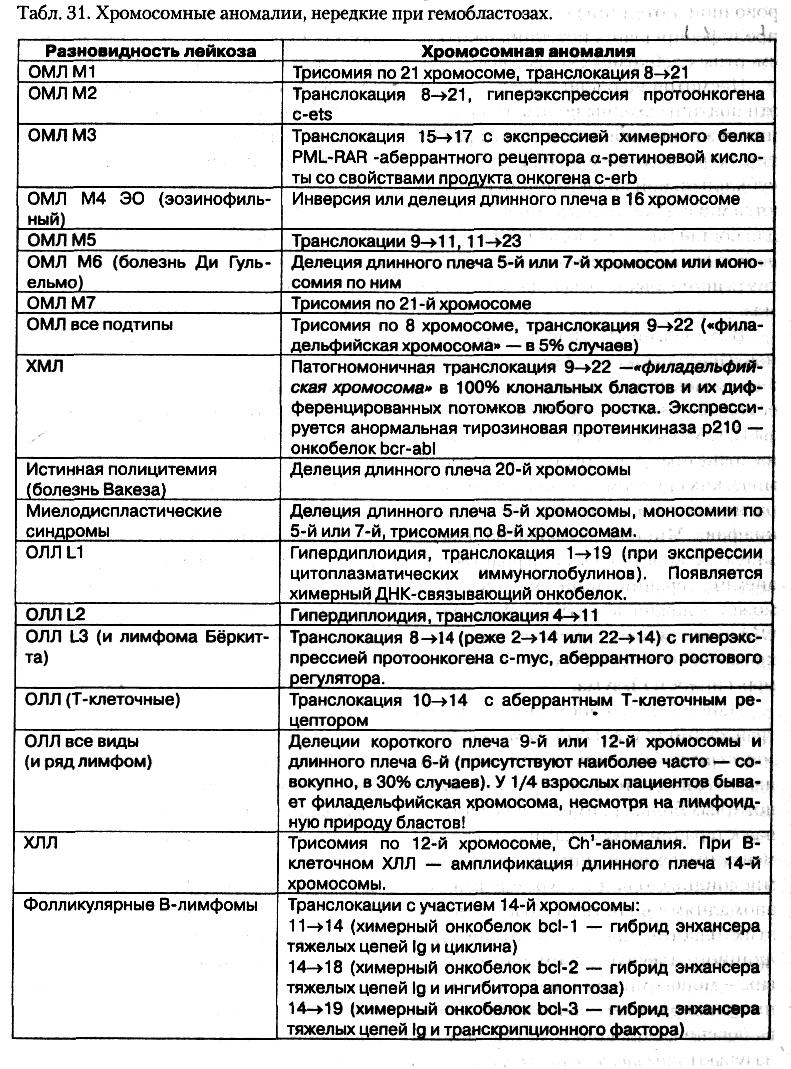
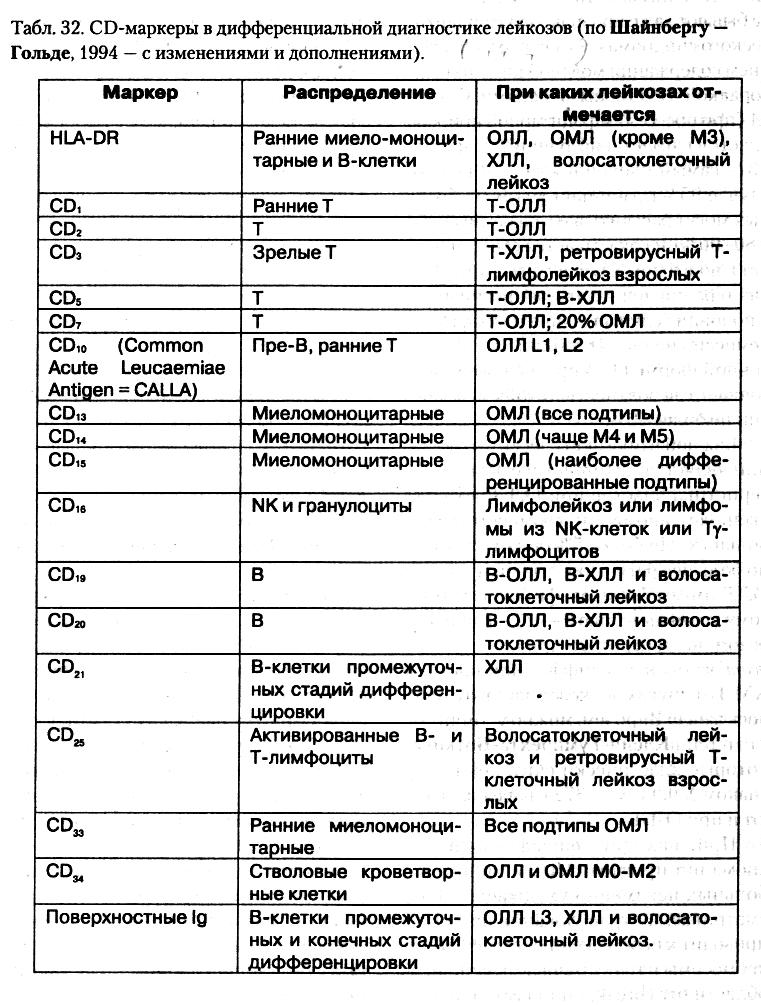
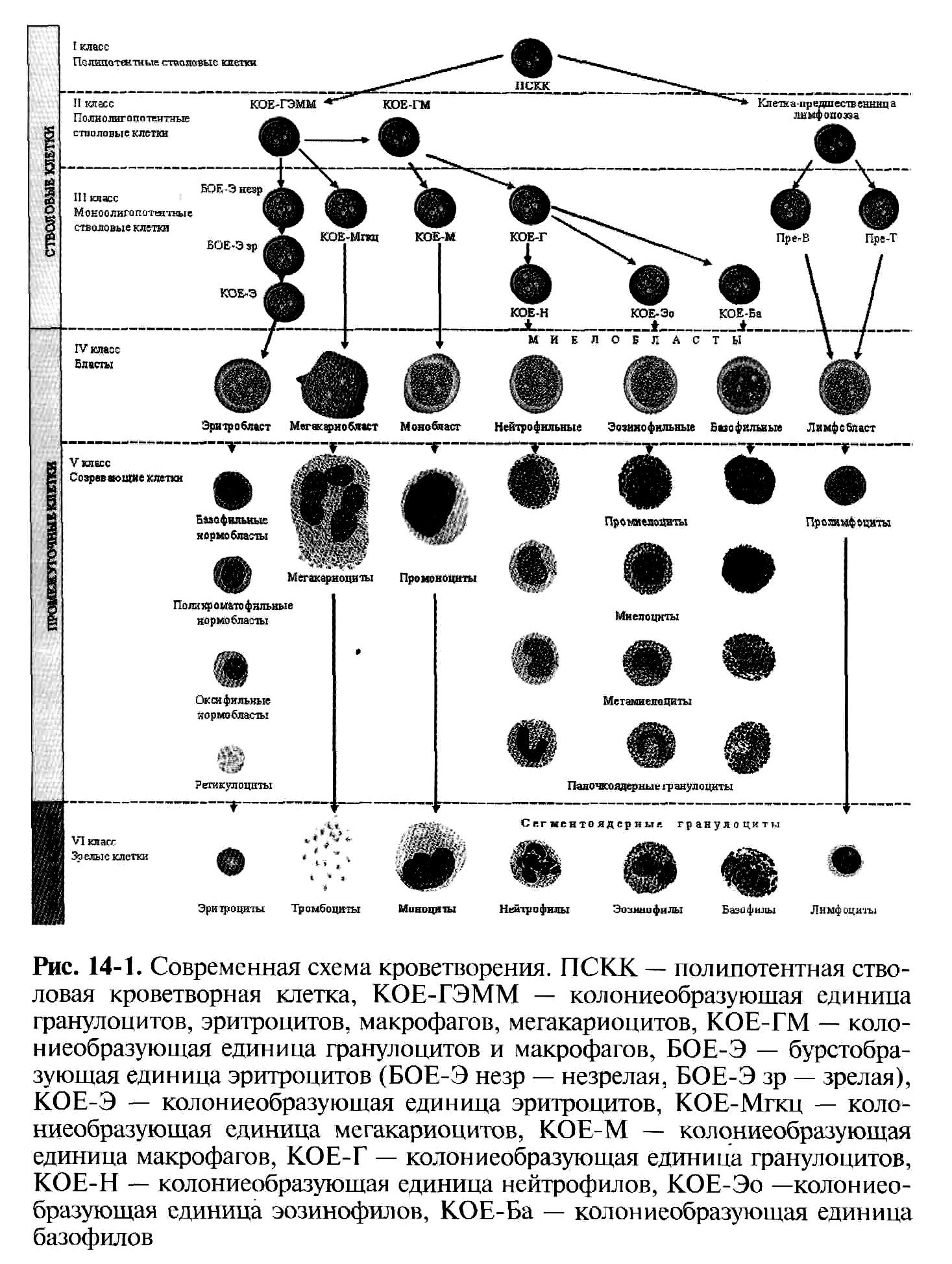
- •5. Особенности лейкозных клеток, их морфологическая, цитохимическая, цитогенетическая и иммунологическая характеристика.
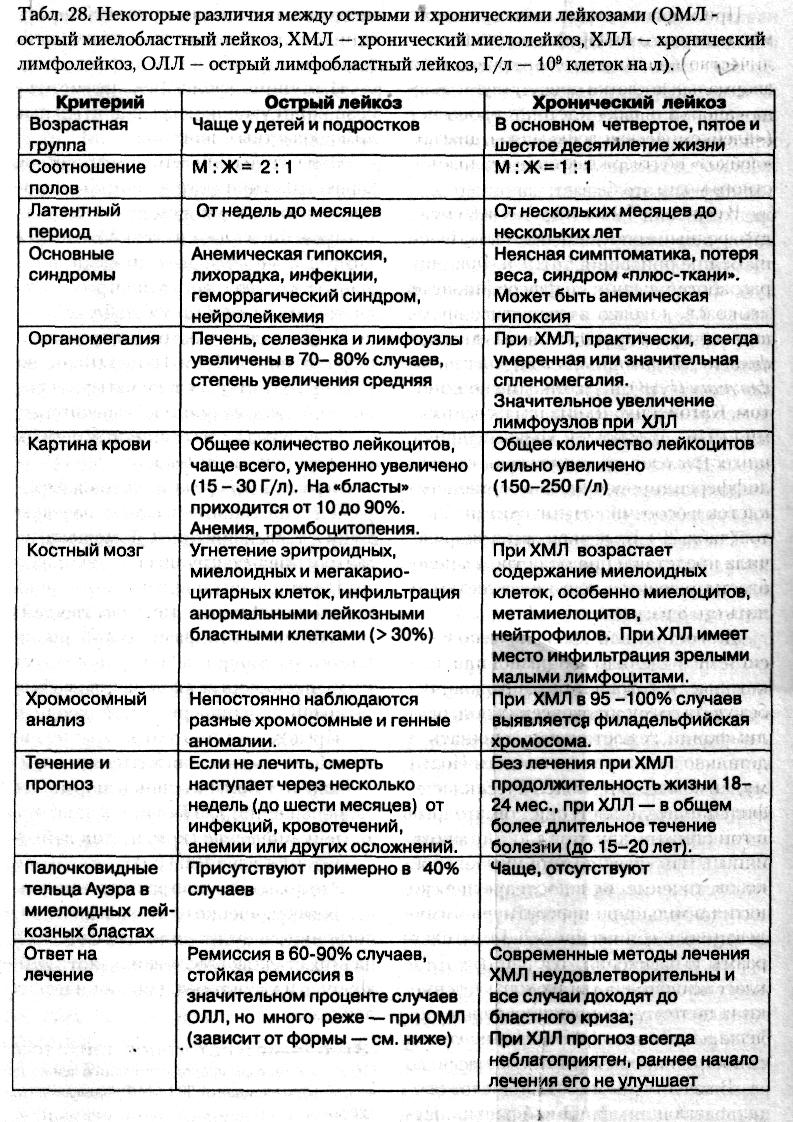
- •6. Острые лейкозы: классификация. Особенности кроветворения и картины периферической крови. Характеристика понятий «ремиссия», «рецидив».
- •1. Острые миелоидные лейкозы (омл)
- •7. Хронические лейкозы: классификация. Особенности кроветворения и картины периферической крови. Бластный криз.
- •1. Хронические миелопролиферативные лейкозы:
- •2. Хронические лимфопролиферативные лейкозы:
- •8. Парапротеинемические гемобластозы (множественная миелома, первичная макроглобулинемия, болезнь тяжелых цепей).
- •9. Основные нарушения в организме при лейкозах, их механизмы.
- •10. Принципы диагностики и терапии лейкозов. Диагностика лейкозов
- •Лечение
- •Принципы современного лечения лейкозов
- •Основные лекарственные препараты, применяемые для лечения лейкозов:
Лечение
При хронических лейкозах врач выбирает поддерживающую тактику, цель которой — отсрочить или исключить развитие осложнений. Острый лейкоз требует немедленного лечения, которое включает в себя прием больших доз и большого числа лекарств (химиотерапия), радиотерапию, иногда назначают подавление иммунитета, чтобы дать возможность организму очиститься от раковых клеток с последующей трансплантацией здоровых донорских клеток.
Принципы современного лечения лейкозов - Программность химиотерапии.
Под программностью следует понимать строгое соблюдение всех компонентов выбранной для лечения терапевтической схемы (программы).
Большинство схем включает в себя:
индукцию клинико-гематологической ремиссии, консолидацию, реиндукцию (повторную индукцию) и поддерживающую терапию.
Цель химиотерапии - индукция ремиссии (менее 5% бластов в костном мозге) и последующая элиминация резидуальных бластных клеток посредством консолидирующей терапии
Химиопрепараты нарушают способность злокачественных клеток к делению, а комбинирование двух или трех препаратов повышает эффективность терапии и снижает риск развития резистентности бластов к терапии.
Принципы современного лечения лейкозов
Недопустимость изменение доз химиопрепаратов, предусмотренных программой лечения,
Строгое применение только тех препаратов, которые предусмотрены протоколом лечения
Необходимость точного соблюдения времени введения химиопрепаратов
Проведение сопроводительной (поддерживающей) терапии лейкозов. Она включает в себя психологическую помощь пациенту, его родителям и другим членам семьи, профилактику инфекционных осложнений и заместительную терапию препаратами крови.
Основные лекарственные препараты, применяемые для лечения лейкозов:
Алкилирующие агенты
Противоопухолевые антибиотики
Антиметаболиты
Алкалоиды
Ферментные препараты
Глюкокортикоиды
Алкилирующие агенты
Представляют группу синтетических препаратов, таких как циклофосфан, циклофосфамид, ифосфамид, мельфалан, производные нитрозомочевины, тиотепа и другие.
Механизм их противоопухолевого действия основан на реакции алкилирования, т. е. замещения атома водорода на алкильную группу.
Это приводит к повреждению и подавлению синтеза ДНК и РНК опухолевых клеток и, в результате, к их гибели.
Препараты этой группы подвергаются метаболизму и выводятся из организма в течение суток.
К побочным действиям алкилирующих агентов относятся угнетение кроветворения, иммунодепрессия, реакции со стороны желудочно-кишечного тракта (тошнота, рвота), нейротоксичность в виде головокружения, парестезий, цистит, что необходимо учитывать при его назначении.
Противоопухолевые антибиотики
Представляют группу производные антрациклинов (даунорубицин, идарубицин, адриамицин, рубомицин), антрацендиона (митоксантрон), а также другие химические соединения.
Основным механизмом их противоопухолевого действия является нарушение синтеза нуклеиновых кислот, а некоторые препараты (например, блеомицин) вызывают одиночные разрывы ДНК.
Время элиминации противоопухолевых антибиотиков из организма может составлять несколько суток.
Кроме общих для цитостатических средств побочных проявлений антрациклины могут оказывать довольно выраженное кардиотоксическое действие.
Антиметаболиты
Представляют группу антагонисты веществ, необходимых для нормальной жизнедеятельности клеток (прежде всего опухолевых), а также аналоги этих веществ, которые участвуют в конкурентном синтезе.
Механизм действия – данные вещества нарушают синтез предшественников нуклеиновых кислот, путем конкуренции с последними в лейкозной клетке.
К препаратам, используемым в лечении острого лейкоза, относят метотрексат (антагонист фолиевой кислоты), 6-меркаптопурин, 6-тиогуанин (антагонисты пуриновых оснований), цитозинарабинозид (аналог пиримидина), гидроксимочевина (ингибитор рибонуклеотидредуктазы).
Соединения характеризуются быстрым метаболизмом.
Из побочных действий помимо угнетения кроветворения отмечают развитие тяжелых поражений слизистых оболочек желудочно-кишечного тракта на фоне приема препаратов, а также поражение почек.
Алкалоиды
Вещества растительного происхождения,
Представлены винкаалкалоидами (винкристин, винбластин), производными эпиподофилотоксина (этопозид, тенипозид) и камптотецина, таксанами. В лечении лейкозов наиболее широко применяют винкаалкалоиды (винкристин).
Эти препараты оказывают антимитотическое действие на быстроделящиеся опухолевые клетки за счет повреждения тубулина - белка, входящего в состав микротрубочек. Воздействует на все фазы покоящейся клетки, предотвращают вхождение клетки в митоз.
Период полувыведения составляет 20-85 ч, метаболизм происходит в основном в печени.
Среди побочных действий наблюдается угнетение кроветворения, особенно нейтропения, кишечная непроходимость, нейротоксичность (в тяжелых случаях развитие парезов), некрозы при попадании препаратов под кожу.
Ферментные препараты.
L-аспарагиназа - представляет собой фермент, который является важным составляющим противолейкозной терапии.
Опухолевые клетки не способны синтезировать аспарагин - аминокислоту, необходимую для их жизнедеятельности. Разрушая аспарагин, L-аспарагиназа вызывает гибель бластных клеток.
Период полувыведения составляет 8-30 ч, но остаточная активность фермента сохраняется в течение 10 дней.
К наиболее частым побочным действиям относятся аллергические реакции различной степени выраженности, нарушение свертываемости крови, панкреатит, энцефалопатия.
Глюкокортикоидные гормоны
Используются в химиотерапевтических схемах - преднизолон и дексаметазон,
Обладают цитолитическим действием на лейкозные клетки (лимфобласты и недифференцируемые бласты) и не вызывает разрушения нормальных лимфоцитов.
Связываясь в клеточном ядре с хроматином, гормональные вещества вызывают нарушение синтеза нуклеиновых кислот, оказывая, таким образом, антипролиферативное действие.
Лечение лейкозов. Основные принципы.
Дозировка медикаментов осуществляется в соответствии с площадью поверхности тела пациента.
Каждый раз перед началом нового этапа лечения вновь определяется площадь поверхности тела и рассчитывается соответственно доза препаратов.
При эндолюмбальной инъекции и при облучении головы дозировка осуществляется в соответствии с возрастом.
Полихимиотерапия больных со стандартным и средним факторами риска длится в течение 6-ти месяцев.
Профилактика инфекций
размещение больных в отдельных палатах (максимально по два человека в одной палате),
соблюдения санитарно-гигиенических мер как медицинским персоналом, так и самим пациентом, в том числе тщательный, регулярный уход за кожными покровами и слизистыми оболочками, ряд диетических особенностей, специальный уход за внутривенным катетером.
оральная деконтаминация, цель - подавление условно-патогенной флоры в организме больного во время выраженной иммуносупрессии, что значительно снижает риск возникновения тяжелых инфекций. Оральная деконтаминация проводится по определенной схеме, включающей несколько антибактериальных и противогрибковых средств.
Профилактика инфекций
При развитии инфекционных осложнений требуется немедленное начало системной антибиотикотерапии.
Необходимо назначение комбинации антибиотиков широкого спектра действия. При этом обычной является комбинация цефалоспоринов третьего поколения или уреидопенициллинов с аминогликозидами.
При отсутствии эффекта к комбинации добавляют гликопептидный антибиотик, а в ряде случаев - противогрибковые препараты.
Такие схемы антибиотикотерапии являются весьма эффективными, хотя и довольно дорогостоящими.
Вирусные инфекции, прежде всего вызванные вирусами группы герпеса, представляют собой грозное осложнение, требующее немедленного начала противовирусной терапии.
Новое в лечении лейкозов
Мабтера*
Трансплантация костного мозга
трансплантация (пересадка) гемопоэтических стволовых клеток
*МАБТЕРА - препарат, созданный на основе человеческих моноклональных антител. За изобретение технологии их получения была присуждена Нобелевская премия. Руководитель отдела химиотерапии лейкозов и трансплантации костного мозга Центра гематологии профессор Валерий Савченко сравнивает традиционную химиотерапию цитостатиками и «Мабтеру» так: «Если химиотерапия - это ковровое бомбометание, при котором поражаются не только злокачественные, но одновременно и здоровые клетки, то применение моноклональных антител - это точечные удары, направленные против белковых молекул, содержащихся преимущественно в опухолевых клетках.» Моноклональные антитела помогают иммунной системе человека обнаруживать и убивать опухолевые клетки.
«Мабтера» стала принципиально новым средством лечения в гематологии. В 1999 году она получила фармацевтический аналог Нобелевской премии - премию Галена. Обычно сначала проводится химиотерапия, а потом достигается закрепляющий эффект с помощью «Мабтеры». Она оказывает целенаправленное повреждающее действие на опухолевую клетку, дает эффект не только на ранних, но и на более поздних стадиях болезни.
«Мабтера» не вызывает таких побочных эффектов, как традиционные прпараты- пациент продолжает вести обычную, повседневную жизнь, ему вовсе не обязательно лечиться стационарно. Введение, хотя и длительное (несколько часов), можно проводить амбулаторно. Так как «Мабтера» не воздействует на нормальные ростки кроветворения, она не вызывает такого тяжелого иммунодефицита, при котором возможны серьезные побочные явления.
Но к сожалению, у этого замечательного, без сомнения, препарата есть один, но очень серьезные недостаток - его цена. В среднем, за флакончик со 100 миллиграммами придется отдать от 30 до 40 тысяч рублей, а курс «Мабтеры» может длиться годами, поэтому подавляющему большинству российского населения она не по карману, хотя в крупных аптеках найти ее вполне возможно.
Токсичность терапии
Ранняя токсичность – развивается вследствие непосредственн6ого действия лекарственных препаратов. Включает тошноту, рвоту, мукозиты, выпадение волос, нейропатии, печеночную и почечную недостаточность, выраженное угнетение кроветворения.
Поздняя токсичность – является следствием изменения функционирования органов и систем организма после длительного воздействия химиотерапевтических средств. Может проявляться поражениями различных органов:
сердце - аритмии, кардиомиопатии;
легкие - фиброз;
эндокринная система - задержка роста, гипотиреоидизм, бесплодие;
почки - снижение гломерулярной фильтрации;
психика - эмоциональные и интеллектуальные нарушения;
вторичные опухоли;
катаракта.
Принципы патогенетической терапии лейкозов
Основные принципы терапии лейкозов сводятся к следующему.
1. Воздействия (рентгеновское облучение, химиотерапевтические препараты из группы цитостатиков, кортикоиды, обладающие антианаболическим действием и т. д.), подавляющие пролиферацию клеток костного мозга.
На основании изучения кинетики лейкозных клеток было установлено, что эти клетки образуют две популяции, одна из которых находится в митотическом цикле (пролиферирующая) и разрушается полихимиотерапевтическим комплексом, компоненты которого действуют на отдельные фазы митотического цикла, а другая (непролиферирующая) может безгранично долго пребывать в стадии митотического покоя, но, активируясь, пополняет пролиферирующую популяцию по мере уничтожения той цитостатическими воздействиями. Поэтому данный вид терапии должен быть достаточно длительным, чтобы обеспечить уничтожение как активно пролиферирующих клеток, так и клеток, вступающих в митотический цикл из непролиферирующей популяции. Лечение цитостатиками эффективнее при острых, нежели при хронических лейкозах. Большинство схем химиотерапии, применяемых при острых лейкозах, позволяет уничтожить свыше 99% лейкозных клеток. Однако даже при достижении ремиссии, эту терапию (в сниженных дозах) надо продолжать, иначе лейкозные клетки вновь начинают пролиферировать.
2. Во-вторых, проводится так называемое вспомогательное лечение. Оно заключается в переливании (по соответствующим показаниям) компонентов крови и купировании инфекций. Гемотрансфузии обычно проводят для восполнения эритроцитарной массы при резком снижении гемоглобина. При тромбоцитопениях проводят переливание тромбоцитарной массы. Переливание гранулоцитарной массы эффекта не дает. Профилактика инфекций достигается в основном антибиотикотерапией. Сюда же относится и терапия повышенной кровоточивости (геморрагических диатезов) препаратами, направленными на повышение свертываемости крови.
3. Витаминная терапия: витамином В12, фолиевой кислотой и др. (исходя из роли витаминов в нарушении обмена триптофана и роли метаболитов последнего в развитии лейкозов).
4. При острых лимфолейкозах и миелолейкозах эффективна трансплантация костного мозга.
Этот метод лечения лейкозов может дать эффект при соблюдении некоторых правил.
При выборе донора необходимо проводить тест на тканевую совместимость. Несовместимость по эритроцитарным антигенным системам не является противопоказанием для трансплантации костного мозга.
Наиболее приемлемы для получения костного мозга кости таза, хотя его можно получить и при пункциях грудины, а у детей - при пункции большой берцовой кости. У взрослых объем получаемой при этом смести крови и костного мозга составляет 500 - 800 мл. Инфузия трансплантата также осуществляется внутрикостно (преимущественно в подвздошные кости таза).
Трансплантированный костный мозг начинает продуцировать нормальные клетки через 2-4 недели после инфузии. О приживлении костного мозга свидетельствует увеличение в крови количества гранулоцитов и тромбоцитов, а также появление ретикулоцитов. В среднем количество гранулоцитов достигает уровня 1•109/л за 26 дней. Число тромбоцитов увеличивается на 1-2 недели позже. Регенерирующий костный мозг обычно полностью представлен донорскими клетками, однако, у некоторых больных обнаруживаются немногочисленные клетки костного мозга хозяина; лишь в редких случаях количество клеток хозяина прогрессирующе возрастает с неизбежной репопуляцией собственного костного мозга.
В качестве осложнений процесса трансплантации костного мозга надо указать следующие:
- отторжение трансплантата (преимущественно у больных с апластической анемией);
- инфекции;
- острая реакция «трансплантат против хозяина»;
- хроническая реакция «трансплантат против хозяина»;
- рецидив лейкоза;
- множественные осложнения в виде геморрагического цистита, кардиомионатии, формирования катаракты, лейкоэнцефалопатии, бесплодия, веноокклюзионной болезни. Указанная полипатия может быть результатом развития болезни рант у взрослых особей при трансплантации агрессивного в иммунном отношении трансплантата.
При хронических лейкозах также применяется трансплантация костного мозга, но она является менее эффективной, нежели при острых. Кроме того, трансплантация костного мозга больным с хроническим миелолейкозом в период рецидива давала очень высокую летальность.
Вероятность успешной аллогенной трансплантации костного мозга обратно пропорциональная возрасту реципиента.
Лечение
По данным ряда авторов трансплантация костного мозга при лейкозах приводит к длительным ремиссиям у 35% выживших после этой манипуляции больных. Однако сложность и дороговизна этого метода пока не дают возможности широко его применять.
Наиболее грозным осложнением трансплантации костного мозга является острая или хроническая РТПХ (реакция "трансплантат против хозяина"). В связи с этим для лечения лейкозов применяю аутологичную трансплантацию (от предварительно взятого костного мозга у самого больного), причем костный мозг берется у него в период ремиссии, а трансплантируется после интенсивной химиотерапии или радиотерапии. Получен эффект от такой трансплантации у больных острыми лимфолейкозами и миелолейкозами во время первой или второй ремиссии, однако, достаточно объективно оценить эффективность этого метода пока не представляется возможным.
Эффективность терапии оценивается по ряду выработанных в настоящее время критериев, согласно которым должны быть достигнуты следующие результаты:
- костномозговой критерий: в пунктате костного мозга количество «бластных» форм не должно превышать 5% от общего количества клеток;
- кровяной критерий: отсутствие «бластных» форм; количество лейкоцитов в пределах 15 000 - 20 000; количество гранулоцитов - более 1500; тромбоцитов - более 100 000; эритроцитов - более 3 000 000; гемоглобина - более 10.4 г%;
- клинический критерий: исчезновение всех объективных болезненных симптомов;
- субъективный критерий: исчезновение жалоб.
Эти критерии, выработанные для лечения острых лейкозов, справедливы в значительной степени и для хронических лейкозов. хотя при хронических лейкемиях на критерии эффективности терапии накладывает отпечаток специфика каждого процесса в зависимости от его этиопатогенетической формы.
Несмотря на достигнутые в последние годы определенные успехи, тем не менее, лечение острых лейкозов на сегодняшний день остается трудной проблемой, требующей большого психо-эмоционального напряжения, материальных средств и соответствующих условий.
Лечение заключается в первую очередь в специфической химиотерапии. Одновременно проводится:
а) сопутствующая терапия — антибактериальная терапия, борьба с агранулоцитозом, токсическими проявлениями;
б) заместительная терапия — трансфузия тромбоконцентрата при глубокой тромбоцитопении, эритроцитов при анемии, борьба с коагулопатией и трансплантация костного мозга или стволовых клеток.
Назначать лечение ОЛ до установления его варианта нельзя. После установления варианта ОЛ проводится оценка общего состояния, выявление факторов риска и выбор программы ПХТ. При лечении ОЛ выделяют группу стандартного риска (пре- и пре-пре-В- и Т-клеточного ОЛ, ранее нелеченные, с числом лейкоцитов < 30•109/л, в возрасте 15—35 и 51—65 лет) и группу высокого риска (ранее леченные формы пре-пре-В-клеточного ОЛ, билинейные ОЛ, при генетических аномалиях — t (9/22), экспрессией миелоидных маркеров на лимфобластах, с числом лейкоцитов > 30 • 109/л, если при лечении не получена ремиссия на 28-й день терапии).
Основным методом лечения острого лейкоза является циклическая полихимиотерапия (ПХТ), которая рассчитана на эрадикацию (искоренение) лейкозного клона.
Схематически лечение всех форм ОЛ осуществляется поэтапно: этап индукции и этапы поддерживающего лечения (реиндукция и консолидация) на протяжении нескольких лет (при выживании до 3—5 лет).
I. Индукция ремиссии. На первом этапе преследуется цель — достижение ремиссии.
Для лечения больных острым лимфобластным лейкозом групп стандартного риска проводится программа Хольцера (в первой фазе с 1-го по 29-й день по схеме назначаются винкристин, рубомицин, преднизолон, L-аспарагиназа. При плохой переносимости, аллергических реакциях аспарагиназа заменяется на ПЭГ-аспарагиназу, которая оказывает более длительное действие, в связи с чем реже вводится; во второй фазе с 29‑го по 57‑й день — циклофосфан 3 введения, цитозар 4 цикла по 4 дня, 6‑меркаптопурин ежедневно). Ремиссию иногда удается получить к 29-му дню. Больным из группы высокого риска и при рецидивах индукция проводится по протоколу RACOP 2-мя курсами по 7 дней с интервалами 4—5 недель (рубомицин, цитозар, циклофосфан, винкристин, преднизолон).
Для нелимфобластных (миелоидных) лейкозов базисной программой является схема 7 + 3 (непрерывно 7 дней в/в вводится цитозар (цитозина арабинозид) и первые 3 дня — рубомицин (идарубицин)). Схему усиливают вепезидом или митоксантроном (7 + 3 + 7). При неэффективности данных схем применяются высокодозные схемы: НАМ, FLAG и др., проведение которых требует серьезной сопроводительной терапии. Если по каким-то причинам невозможно проводить базисные схемы, назначают курс МДЦ (малых доз цитозара). При промиелоцитарном лейкозе высокоэффективна ATRA-трансретиноевая кислота (7 дней в дозе 25 мг/кг) совместно с курсами ПХТ.
Программы разработаны с учетом синхронного влияния цитостатиков на лейкозные клетки, находящиеся в различных фазах митотического цикла.
Действие цитостатиков в различных фазах митотического цикла
В фазе покоя G0 клетка плохо воспринимает влияние цитостатиков; в пресинтетической фазе G1 действуют метотрексат, преднизолон; в фазе синтеза S — метотрексат, 6-меркаптопурин, рубомицин, цитозар, оксимочевина, L-аспарагиназа; в премитотической фазе G2 — циклофосфан; в фазе митоза — винкристин. Преднизолон и циклофосфан действуют во все фазы митотического цикла.
II. Одновременно с началом лечения ОЛ проводится первичная профилактика нейролейкоза — интралюмбальное введение цитостатиков (метотрексат и цитозар) с интервалом в 2 недели, так как при внутривенном введении цитостатики не проникают в мозг через гематоэнцефалический барьер. Лечение должно проводиться строго по разработанному протоколу.
III. В случае, если после первого курса терапии получена клинико-гематологическая ремиссия (в костном мозге бластов менее 5 %), начинается новый этап — консолидация ремиссии. В полном соответствии с протоколом проводятся циклы тех же самых цитостатических программ каждый месяц в течение первого года (или реже), каждые 3 месяца в течение последующих лет. Через 5 лет, если в костном мозге сохраняется до 5 % бластов, лечение считается законченным.
Одновременно проводят и другие лечебные мероприятия, которые носят вспомогательный характер, но обязательны: профилактика инфекционных и грибковых осложнений, борьба с анемией, трансфузии концентратов тромбоцитов, колониестимулирующих препаратов. Большинство цитостатиков обладает эметогенным (тошнотворным) эффектом, что доставляет больным выраженные неудобства. Для купирования тошноты и рвоты успешно применяются селективные антагонисты серотониновых 5-НТ3-рецепторов.
Если в любом периоде лечения увеличивается бластоз костного мозга, вновь проводится гистохимический анализ бластов, определяется вариант лейкоза, отменяется первичная программа и подбирается программа с другими цитостатиками для реиндукции и для реконсолидации ремиссии вновь на 5 лет лечения.
Критерии полной ремиссии
1. Ликвидированы клинические проявления ОЛ, в том числе экстрамедулярные поражения (ЦНС, яичек и т. д.).
2. ОАК: нормальные или близкие к ним показатели, а именно: Hb > 100 г/л, Лe > 1,5 • 109/л, из них лимфоцитов не более 40 %, Тр > 100 • 109/л.
3. Миелограмма: не более 5 % бластов (особенно в исследовании костного мозга через 2 недели после достижения ремиссии).
4. В спиномозговой жидкости отсутствует цитоз и, безусловно, бластоз.
При строгом выполнении программы при остром лимфобластном лейкозе можно получить до 80 % ремиссии, при остром нелимфобластном лейкозе — значительно реже.
Больным в стадии ремиссии наиболее целесообразно провести трансплантацию костного мозга.
Новые направления в лечении лейкозов
В последнее время разрабатываются новые подходы к лечению лейкозов. Это:
— применение новых цитостатиков: липосомальная форма антрациклиновых антибиотиков, пэгилированные формы (ПЭГ-аспарагиназа, ПЭГ-интрон), аналоги нуклеозидов (флудара, 506U), гипометилирующие средства и др.;
— применение новых нецитостатических препаратов и их сочетаний: индукторы дифференцировки — весаноид (ATRA), INFα, триоксид мышьяка (при остром промиелоцитарном лейкозе), циклоспорин, моноклональные антитела, «антисенсы» (подробнее см. специальную литературу);
— преодоление резистентности.
Кроме новых медикаментов, разрабатываются также новые стратегические подходы: трансплантация стволовых клеток периферической крови (ауто-, алло-), трансфузии лимфоцитов донора при рецидивах после аллогенной ТКМ, мини-трансплантация.
Лечение
Задачи терапии - свести до минимума клон патологических клеток, нормализовать гемопоэз и тем самым индуцировать ремиссию и как можно дольше удержать ее.
1. Антиметаболиты: 6 - меркаптопурин: цитозинарабинозид; тиогуанин; метатрексат и аметоптерин.
2. Противоопухолевые антибиотики: дианорубомицин (рубомицин); блеомицин, адриомицин.
3. Блокаторы митозов; винкристин: винбластин (международное название - онкавин).
4. Глюкокортикоиды: преднизолон; триамцинолон..
5. Антиферментные препараты: аспаргиназа.
Все перечисленные препараты, за ислючением блеомицина, винбластина и преднизолона, действуют на все клетки и на лейкозные и на нормальную ткань. Многие препараты вызывают массу побочных эффектов, например: метотрексат может вызывать язвы по ходу ЖКТ, токсический гепатит. Винкристин - парез кишечника, неврологические расстройства. Циклофосфан - тяжелый геморрагический цистит. Рубомицин обладает кардиотоксическим действием.
Препараты действуют на клетку в различные периоды ее жизни. Так преднизолон тормозит переход клетки из фазы D 1 в фазу S.
Существуют различные схемы применения препаратов: BAMП (винкристин + аметоптерин 1 меркаптопурин + преднизолон) ABAMП, ЦBAMП и др.
Смысл таких комбинаций - подействовать на все фазы жизненного цикла клетки и тем самым вызывать ремиссию, свести до минимума клон патологических клеток и удержать ремиссию. Другой задачей лечения является предотвращение возможных осложнений. Ремиссия - это такое состояние, когда в костном мозге содержится не более 5% бластов, а состояние гемопоэза приближается к норме.
При остром лимфобалстном лейкозе применяют схему BAMП в течение 7 дней с последующим 2 - х недельным перерывом. Смотрят на картину крови. Если удалось добиться ремиссии, то проводят еще курс консолидирующей терапии.
Паралельно основной терапии проводят профилактику осложнений:
а) Больных желательно помещать в изолированные палаты.
б) Мощная антибактериальная терапия препаратами широкого спектра действия.
в) При эндотоксической энтеропатии - канамицин, ристамицин.
г) При нейролейкемии цитостатики вводят эндолюмбально.
д) При геморрагическом диатезе - дицинон 0,25 или 12,5% 2,0 в/м.