- •Дмитровский Государственный Политехнический Колледж Реферат по физике на тему
- •Твердые тела и жидкости Кристаллическая структура твердых тел
- •Макс Теодор Фелик Фон Лауэ (1879–1960)
- •Cтруктурные дефекты твердых тел
- •Деформация
- •Виды деформации
- •Деформация металла. Упругая и пластическая деформация
- •Типы кристаллических связей
- •Энергия поверхностного слоя и поверхностное натяжение жидкостей
- •Капиллярные явления.
Типы кристаллических связей
В природе встречаются кристаллы различной структуры. Некоторые из них состоят из нейтральных атомов — это атомные (ковалентные) кристаллы, другие состоят из разноименно заряженных ионов — это ионные кристаллы. Металлические кристаллы построены из положительно заряженных ионов и свободных электронов, а молекулярные кристаллы состоят из молекул. Различие в структуре определяет различие свойств кристаллов. Рассмотрим структуру указанных кристаллов, а также некоторые их свойства.
|
|
|
Атомные (ковалентные) кристаллы образуются путем плотной упаковки атомов. Рассмотрим упаковку одинаковых атомов. Естественно, что при этом ионы не образуются, но возникают ковалентные связи путем спаривания валентных электронов. Такие связи характерны для элементов IV группы Периодической системы химических элементов Д. И. Менделеева: углерода, кремния, германия и др. На рисунке изображена плоская модель связей в кристалле германия. На внешней оболочке атома этого вещества находится 4 электрона, а для заполнения необходимо 8. Поэтому атом взаимодействует с четырьмя соседними; при этом пара валентных электронов одновременно принадлежит двум соседним атомам. Заметим, что в этом типе кристаллов нет отдельных молекул, весь кристалл — гигантская молекула. |
|
Ионные кристаллы образуются путем плотной упаковки ионов, заряженных разноименно. К числу ионных кристаллов относится большинство неорганических соединений, например соли. Рассмотрим строение кристалла поваренной соли — хлорида натрия NаСI. Известно, что атом натрия легко отдает свой валентный электрон, а атом хлора его принимает. Образуются два иона: положительный Nа+ и отрицательный Сl-. У обоих ионов внешняя электронная оболочка оказывается заполненной, ибо она содержит по 8 электронов. Электроны располагаются сферически, симметрично относительно ядер, так что оба иона можно считать шариками, но с разными радиусами: ион хлора больше иона натрия. Между разноименно заряженными ионами действуют кулоновские силы притяжения, удерживающие их в узлах кубической кристаллической решетки. Каждый ион натрия окружен шестью ионами хлора, и, наоборот, каждый ион хлора окружен шестью ионами натрия. В кристалле нет молекул NаСl. Аналогично образуется ионная химическая связь и в других случаях, чаще всего между металлами и галогенами — фтором и хлором. |
|
Металлические кристаллы образуются следующим образом. При кристаллизации атомы сближаются, валентные электроны отделяются от атомов и коллективизируются — они уже принадлежат не отдельным атомам, а кристаллической решетке в целом. Совокупность этих свободных электронов образует электронный газ. Кристаллическая решетка состоит из плотно упакованных положительно заряженных ионов, которые удерживаются в узлах решетки за счет взаимодействия с отрицательно заряженным электронным газом. Наличие свободных электронов и служит причиной того, что металлы — хорошие проводники электричества. Все три вида рассмотренных выше химических связей — ионная, ковалентная и металлическая — обеспечивают значительную механическую прочность соответствующих кристаллов, их малую сжимаемость. Все они имеют электрическое происхождение, ибо связаны с перераспределением электронов между атомами. |
|
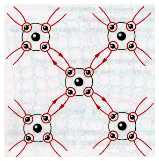
Молекулярные кристаллы Существует широкий класс кристаллов, состоящих из молекул. Типичными примерами являются лед, иод, бром, твердая углекислота (сухой лед), нафталин и т. п. В узлах кристаллической решетки здесь располагаются молекулы. Примером может служить модель кристалла льда. Здесь атомы кислорода условно изображены в виде светлых шариков, атомы водорода — в виде темных шариков. Каждый атом кислорода окружен четырьмя атомами водорода, атом водорода служит связующим звеном между двумя соседними атомами кислорода. Формула для молекулы воды Н2О, конечно, сохраняется, но выделить в кристалле отдельную молекулу невозможно. Молекулярные связи значительно слабее ионных, ковалентных или металлических. Поэтому молекулярные кристаллы легко плавятся, а при низком атмосферном давлении испаряются, не переходя в жидкое состояние.Такой процесс называется сублимацией или возгонкой. |