
- •22222222Биофизика мышечного сокращения
- •Структура скелетной мышцы
- •Молекулярный механизм мышечного сокращения
- •Взаимодействие миозина, актина и кальция в процессе мышечного сокращения
- •Энергетика мышечного сокращения
- •Связь скорости сокращения мышцы с приложенной нагрузкой
- •Виды сокращений скелетной мышцы
- •Взаимодействие мышц с костной системой
- •Список использованной литературы:
Взаимодействие миозина, актина и кальция в процессе мышечного сокращения
При возбуждении мышечного волокна из саркоплазматического ретикулума выходят в большом количестве ионы кальция. Они связываются с молекулами тропонина, вызывая конформационные перестройки их структуры. Это приводит к изменению взаимодействия между тропонин-тропомиозином и молекулами актина. В результате активные центры актиновой спирали становятся открытыми и способными взаимодействовать с поперечными мости -
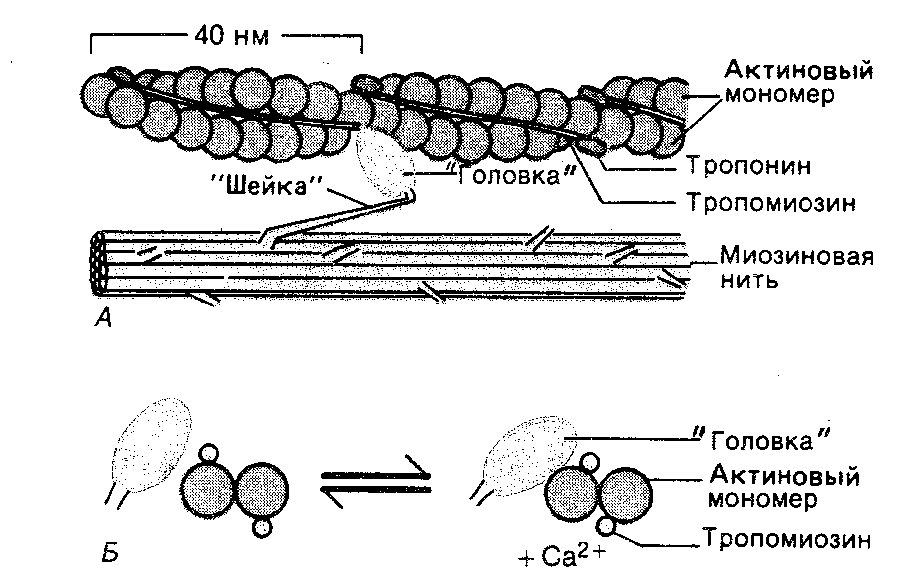
Рис. 4. Взаимное расположение актиновых и миозиновых филаментов: продольное сечение (А); поперечное сечение (Б).
ками миозина, что и запускает мышечное сокращение.
Как только актиновые филаменты активируются ионами кальция, головки поперечных мостиков миозиновых молекул присоединяются к активным центрам актиновых филаментов. В настоящее время известно, что во взаимодействии поперечных мостиков миозина с актином играют роль электростатические силы и гидрофобные взаимодействия. Сначала головка каждого поперечного мостика «подключается» к активному центру актинового филамента под прямым углом, и тут же наклоняется примерно до угла 450 (рис. 5). При этом головка действует как рычаг, приводя в напряжённое состояние шейку поперечного мостика. В результате развивается упругое натяжение, смещающее актиновый филамент приблизительно на 10 нм. После этого головка отсоединяется от активного центра актинового филамента, и, возвращаясь в свою нормальную позицию, формирует связь с новым активным центром молекулы актина. В этом процессе расходуется свободная энергия, которая высвобождается в результате гидролиза молекулы АТФ.
Такой процесс наступает снова и снова, пока актиновые фи -
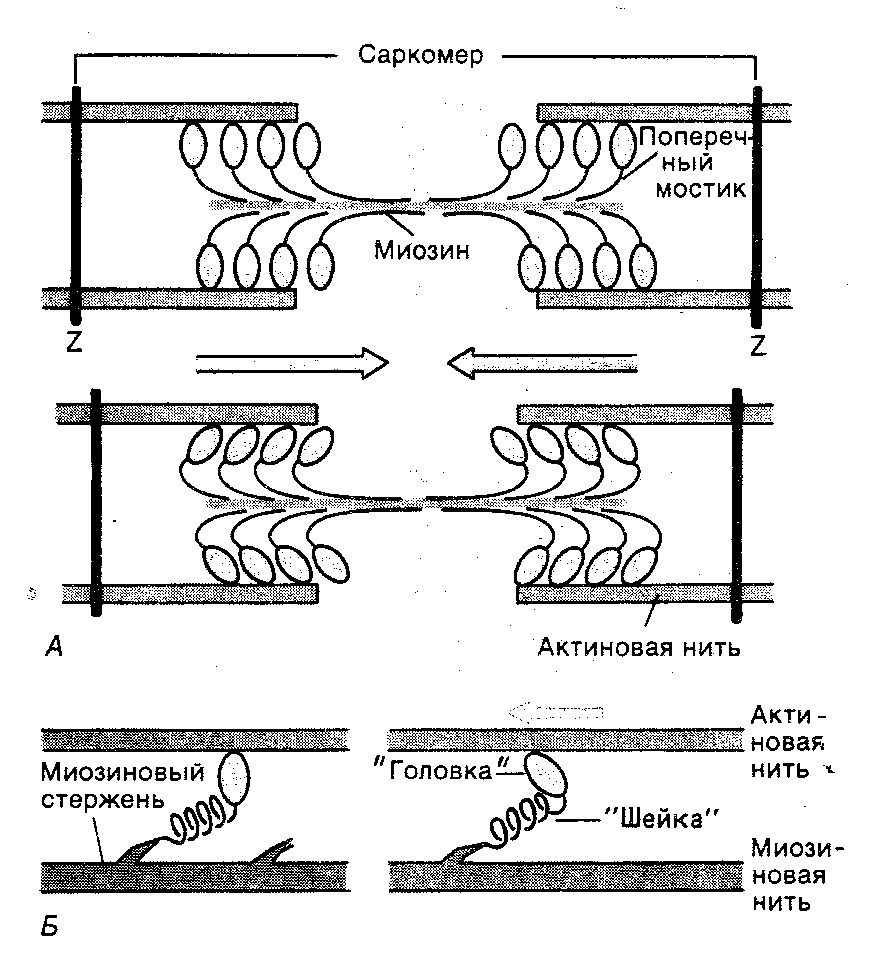
Рис. 5. Функция поперечных мостиков: А). «подключение» поперечных мостиков к актиновому филаменту под прямым углом и изменение угла до 450; Б). модель развития напряжения в поперечных мостиках во время сокращения мышечного волокна.
ламенты не втянутся практически полностью между миозиновыми филаментами, подтягивая Z-мембраны к концам миозиновых филаментов (рис.2). Сокращение каждого саркомера осуществляется большим числом поперечных мостиков. Каждый поперечный мостик действует независимо от других. Чем большое число поперечных мостиков формируют контакты с актиновыми филаментами, тем больше сила сокращения.
Энергетика мышечного сокращения
При сокращении мышцы выполняется работа, и на это требуется энергия, источником которой служит ATФ. Головки поперечных мостиков миозина в присутствие молекул актина функционируют как фермент аденозинтрифосфатаза (ATФаза). Это свойство позволяет головке гидролизовать ATФ и использовать выделившуюся при этом энергию для сокращения.
Гидролиз АТФ происходит в тот момент, когда поперечный мостик присоединён к актиновой молекуле под углом 450. Выделяющаяся энергия расходуется на отсоединение головки и изменение её конформации. В результате головка присоединяется под углом 900 к следующему активному центру молекулы актина. Таким образом, для каждого ″шага″ поперечного мостика необходима одна молекула АТФ.
Энергетическая эффективность любого двигателя вычисляется как отношение энергии, которая преобразуется в работу, к общему количеству затраченной энергии. В работу мышцы преобразуется не более 25% химической энергии, заключённой в продуктах питания, а основная часть этой энергии рассеивается в форме теплоты. Причина такой небольшой эффективности в том, что около половины энергии пищевых продуктов теряется в процессе образования ATФ. Только 40-45% энергии ATФ может быть в дальнейшем преобразовано в мышечную работу.
К настоящему времени расшифрована структура саркомера и составляющих его белков, исследована механика и энергетика мышечного сокращения, изучена биохимия расщепления АТФ актомиозиновым комплексом. Но молекулярный механизм трансформации химической энергии АТФ в механическую работу продолжает оставаться неясным.
