
С.Ж.АСФЕНДИЯРОВ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ МЕДИЦИНА УНИВЕРСИТЕТІ |
|
КАЗАХСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ С.Д.АСФЕНДИЯРОВА |
«ФАРМАЦЕВТ-АНАЛИТИК» МОДУЛІ
АНАЛИТИКАЛЫҚ ХИМИЯ ПӘНІНЕН 051103-«ФАРМАЦИЯ» МАМАНДЫҒЫНА АРНАЛҒАН
ТЕСТ ТАПСЫРМАЛАРЫ
«КЕЛІСЕМІН» «БЕКІТЕМІН»
ОД «Фармация» директоры Фармацевтика факультетінің деканы
фарм.ғ.д. Г.О. Устенова фарм.ғ.д. У.М. Датхаев
_______________ ________________
«___» _________2013 ж. «___» _________2013 ж.
Фармацевтикалық факультеттің 5В051103- «Фармация» мамандығының 2 курс студенттеріне «Аналитикалық химия» пәнінен 2012-2013 оқу жылына арналған тест тапсырмалары
1. Макроталдауда қолданылатын заттың массасы (мг):
A) 100-99.
B) 100-10.
C) 10 -103.
D) < 10-3.
E) 10-10 5
2. Жартылай микроталдауда қолданылатын заттың массасы (мг):
A) < 10-2.
B) 10-2 – 10-3.
C) 10-3 - 10-6.
D) 10-6 – 10-11.
E) < 10-14.
3. Жартылай микроталдауда қолданылатын заттың көлемі (мл):
A) >10.
B) 1-10.
C) 1-10-1.
D) 10-3 - 10-6.
E) 30-40.
4. Фазалық талдау:
A) Бір-бірінен бөлу беті арқылы шектелген және физикалық қасиетімен, құрылысымен ажыратылатын көп компонентті қоспадағы жеке компоненттердің химиялық табиғатын анықтайтын сапалық
және сандық талдау әдістері.
B) Зерттейтін қоспадағы жеке компоненттерді анықтайтын сапалық және сандық талдау әдістері.
C) Зерттейтін қоспадағы функционалдық топтарды анықтайтын сапалық және сандық талдау
әдістері.
D) Зерттейтін қоспадағы молекулалық массасы тұрақты жеке химиялық қосылысты анықтайтын
сапалық және сандық талдау әдістері.
E) Гетерогендік жүйедегі бір компоненттің химиялық қасиетін анықтайтын әдістер тобы.
5. Элементарлық талдау:
A) Зерттейтін қоспадағы жеке компоненттерді анықтайтын сапалық және сандық талдау әдістері.
B) Зерттейтін қоспадағы функционалдық топтарды анықтайтын сапалық және сандық талдау әдістері.
C) Зерттейтін қоспадағы молекулалық массасы тұрақты жеке химиялық қосылысты анықтайтын сапалық және сандық талдау әдістері.
D) Бір-бірінен бөлу беті арқылы шектелген және физикалық қасиетімен ажыратылатын көп
компонентті қоспадағы жеке компоненттердің химиялық табиғатын анықтайтын сапалық және
талдау әдістері.
E) Гетерогендік жүйедегі бір компоненттің химиялық қасиетін анықтайтын әдістер тобы.
6. Функционалдық талдау:
A) Зерттелетін қоспадағы және компоненттерді анықтайтын сапалық және сандық талдау әдістері.
B) Зерттелетін қоспадағы функционалдық топтарды анықтайтын сапалық және сандық талдау әдістері.
C) Зерттелетін қоспадағы молекулалық массасы тұрақты жеке химиялық қосылысты анықтайтын сапалық және сандық талдау әдістері.
D) Бір-бірінен бөлу беті арқылы шектелген және қасиеті, физикалық құрылысымен ажыратылатын көп компонентті қоспадағы жеке компоненттердің химиялық табиғатын анықтайтын әдістер тобы.
E) Гетерогендік жүйедегі бір компоненттің химиялық қасиетін анықтайтын әдістер тобы.
7. Молекулалық талдау:
A) Зерттелетін қоспадағы және компоненттерді анықтайтын сапалық және сандық талдау әдістері.
B) Зерттелетін қоспадағы функционалдық топтарды анықтайтын сапалық және сандық талдау
әдістері.
C) Зерттелетін қоспадағы молекулалық массасы тұрақты жеке химиялық қосылысты анықтайтын сапалық және сандық талдау әдістері.
D Бір-бірінен бөлу беті арқылы шектелген және қасиеті, физикалық құрылысымен ажыратылатын көп компонентті қоспадағы жеке компоненттердің химиялық табиғатын анықтайтын сапалық және сандық талдау әдістер тобы.
E) Гетерогендік жүйедегі бір компоненттің химиялық қасиетін анықтайтын әдістер тобы.
8. Бір ионды басқа иондардың қатысында анықтауға болатын аналитикалық реакция :
A) Селективті.
B) Спецификалық.
C) Талғамды.
D) Топ реагентінің әсері.
E) Бөлу реакциясы.
9. Зерттейтін иондарды топқа бөліп, топты құрайтын иондарды белгілі бір ретпен анықтауға
негізделген талдау :
A) Бөлшектік.
B) Жүйелік .
C) Топ реагентінің әсері.
D) Бөлу реакциясы.
E) Тұнбаға толық түскенін тексеру әдісі.
10. Зерттейтін ерітіндінін бір бөлігінен, басқа иондардың қатысында спецификалық реакцияның көмегімен бір ионды анықтауға негізделген талдау:
A) Бөлшектік.
B) Жүйелік.
C) Топ реагентінің әсері.
D) Бөлу реакциясы.
E) Тұнбаға толық түскенін тексеру әдісі.
11. Химиялық талдауда заттың аналитикалық қасиетіне жатпайды:
A) Иісі.
B) Түсі.
C) ИК спектрде жұтылу жолының болуы.
D) Жалын түсінің боялуы.
E) Кристалдың пішіні мен түсі.
12. «Сулы» жолмен жүргізілетін талдау:
A) Элементарлық талдау.
B) Молекулалық талдау.
C) Иондық.
D) Фазалық.
E) Құрылымдық.
13. Аналитикалық реакцияның сезгіштігін сипаттайтын шама:
A) Ерігіштік көбейтіндісі.- KS.
B) Молярлық ерігіштік - S.
C) Ашу шегі - m.
D) Массалық концентрация – Cm.
E) Массалық үлес - w.
14. Өлшем бірлігі мкг болатын шама:
A) Концентрация.
B) Молярлық масса.
C) Титр.
D) Ашу шегі.
E) Көлем.
15. Анықтауға болатын заттың немесе ионның ең аз мөлшері:
A) Реакцияның сезгіштігі.
B) Реакцияның спецификалығы.
C) Ашу шегі.
D) Шекті сұйылту.
E) Минималды концентрация.
16. Аналитикалық реакцияның сезгіштігі жоғары болады, егер:
A) Аз мөлшерде шекті сұйылту болғанда.
B) Ашу шегі төмен болғанда.
C) Ерітіндінің үлкен концентрациясында.
D) Ерітіндінің рН < 0 болғанда.
E) Ерітіндінің рН > 0 болғанда.
17. Массасы 1г Ag+ ионың 25000г еріткішпен анықтауға болатын реакцияның шекті сұйылтуының
мәні :
A) 0,02 мг.
B)
4 ·
10-5
г.
·
10-5
г.
C) 0,8 мкг.
D) 25000:1.
E) 1:25000.
18. Ашу шегі 1,2 мкг болатын көлемі 0,02 мл ерітіндідегі Al3+ ионының шекті концентрациясы (г/мл) :
A) 6,0 * 10-5.
B) 1,0 * 10-5.
C) 6,6 * 10-5.
D) 10 * 10-5.
E) 66 * 10-5.
19. Шекті концентрациясы 1,2· 10-3 г/мл тең болатын K+ ионын анықтауға қажет ерітіндісінің
минимальды концентрациясы (моль/л) :
A) 2 * 10-1.
B) 2.3 * 10-1.
C) 3 * 10-1.
D) 1.6 * 10-5.
E) 1.6 * 10-1.
20. Ашу шегінің өлшем бірлігі:
A) Моль/л.
B) Моль.
C) Мг.
D) Мкг.
E) Кг.
21.
Clim
Vlim
 106
формуласымен
есептейді:
106
формуласымен
есептейді:
A) Ашу шегі.
B) Диссоциациялану константасы.
C) Иондану дәрежесі.
D) Концентрация.
E) pH.
22. Ашу шегін есептейтін формула:
A)

 ∑CiZi2.
∑CiZi2.
B) K = K1/K2.
C) f = a/c.
D)

 = Cдисс/Сжалпы.
= Cдисс/Сжалпы.
E) а = Clim *Vmin*106.
23. Өз қасиетін үздіксіз өзгертетін екі немесе бірнеше компоненттен тұратын гомогенді қоспа:
A) Тұнба.
B) Зат.
C) Материя.
D) Кристалл.
E) Ерітінді.
24. Электролиттердің идеал ерітінділерден айырмашылығы айқын байқалатын еріткіш:
A) Ацетон.
B) Су.
C) Метанол.
D) Этанол.
E) Сірке қышқылы.
25. Сұйытылған ерітіндідегі активті коэффиценттің мәні:
A) f < 1.
B) f = 1.
C) f >1.
D) f = 0.
E) f < 0.
26. Активтілік коэффициент f = 1 болады , егер :
A)
Ерітіндінің концентрациясы > 10-4
 M.
M.
B)
Ерітіндінің концентрациясы < 10-4 M.
M.
C) Күшті электролиттер үшін кез-келген концентрацияда.
D) Әлсіз электролиттер үшін концентрлі ерітіндіде
E) Диссоциацияланбаған молекулалар үшін кез-келген концентрацияда.
27. Активтілік коэффициентті есептейтін формула:
A)


B)
K =  .
.
C)
f =  .
.
D)
α
=  .
.
E)
m =  .
.
28. Активтілік коэффиценттері бірдей және иондық күші 0,5-ке тең иондар орналасқан қатар:
A) K+, NO3-, Br-, NH4+.
B) Hg2+, SO42-, Cl-.
C) PO43-, Na+, Ca2+, Zn2+.
D) Sr2+, Ba2+, NO2-, CN-.
E) SO32-, Pb2+, CO32-, Ag+.
29. Активтіліктің мәні концентрацияға тең болатын жағдай :
A) Күшті электролиттер үшін, егер ерітінді концентрациясы > 10-4 M.
B) Күшті электролиттер үшін, егер ерітінді концентрациясы < 10-4 M.
C) Күшті электролиттер үшін кез-келген концентрацияда.
D) Әлсіз электролиттер үшін кез-келген концентрацияда.
E) Диссоциацияланбаған молекулалар үшін кез-келген концентрацияда.
30. Концентрациясы 0,1моль/л, активтілік коэффициенті 0,51 тең болатын ионның активтілігі:
A) 5,100.
B) 0,510.
C) 0,051.
D) 0,196.
E) 0,019.
31. Ерітіндінің иондық күшін есептейтін формула:
A) I = Z * S * Ci.
B)
I
=  ∑
Ci
* Zi
2.
∑
Ci
* Zi
2.
C) I = Zi * Ci.
D)
I
= 
 .
.
E) I = ∑ Zi * Ci2.
32. Ерітіндінің иондық күшін есептеуге қажетті шамалар:
A) Zi,Сі.
B) С, r.
C) W, r.
D) Ks, Сі.
E) pH, Сі.
33. Концентрациясы 0,02 моль/л CaCl2 ерітіндісінің иондық күші :
A) 0.02.
B) 0.04.
C) 0.06.
D) 0.08.
E) 1.00.
34. Жалпы концентрациясы С болатын Na2SO4 ерітіндісінің иондық күші :
A) I = C.
B) I = 2C.
C) I = 3C.
D) I = 4C.
E) I = 6C.
35. Концентрациясы 0,005 моль/л барий нитратының иондық күші :
A) 0,00015.
B) 0,0015.
C) 0,015.
D) 0,15.
E) 1,5.
36. Күшті электролиттердің диссоциациялану константасының өрнегі:
A) Күшті электролиттер диссоциациялану константамен сипатталмайды. +
B) K = Cα 2/(1- α) .
C) K = (1- α)/Cα2.
D) K = α2/C(1-α).
E) K = C α2.
37. Концентрациясы С(СН3СООН) = 0,1моль/л, Ка = 10-5 тең ерітіндінің рН-ы:
A) 3.
B) 4.
C) 7.
D) 6.
E) 1.
38. СОН- = 10-11 ерітінді ортасы:
A) Қышқылдық.
B) Сiлтiлiк.
C) Әлсiз сiлтiлiк.
D) Бейтарап.
E) Негіздік.
39. Гидроксид ионының концентрациясы 1 * 10-4 тең болғанда, ерітінді ортасы:
A) Күшті сілтілік.
B) Әлсiз қышқылдық.
C) Әлсiз сiлтiлiк.
D) Күштi қышқылдық.
E) Бейтарап.
40. HCl қосқанда CH3COOH иондану дәрежесі:
A) Артады.
B) Кемидi.
C) Өзгермейдi.
D) Екi есе артады.
E) Екi есе кемидi.
41. 25°C температурадағы таза судағы гидроксид иондарының концентрациясы:
A) [OH-] = [H+], [OH-] = 1 ∙ 10-7.
B) [OH-] = 0,1∙10-5, [OH-] = 0,1∙10-9.
C) [OH-] = 1,4∙10-14, [OH-] = 1 ∙ 10-7.
D) [OH-] = 0,1∙10-7, [OH-] > [H+].
E) [OH-] =1,0∙ 10-6, [OH-] < [H+].
42. рН-тың мәнін бір бірлікке кеміту үшін сутек ионы концентрациясын өзгертеді:
A) 10 есе арттырады.
B) 0,1 есе арттырады.
C) 14 есе арттырады.
D) 100 есе кемiтедi.
E) 1000 есе кемiтедi.
43. Концентрациялары бірдей, иондану константалары K(CH3COOH) = 1,7 ∙ 10-5,
K(HNO2) = 5,1 ∙ 10-4, K(CH2ClCOOH) = 1,4 ∙ 10-3 тең қышқылдардың иондану дәрежесінің
өсу ретімен орналасқан қатар:
A) CH3COOH, HNO2, CH2ClCOOH.
B) HNO2, CH3COOH, CH2CICOOH.
C) CH2CICOOH, CH3COOH, HNO2.
D) HNO2, CH2CICOOH, CH3COOH.
E) Концентрациялары бiрдей болғанда иондану дәрежелерi тең болады.
44. Бренстед- Лоури протолиттік теориясы бойынша қышқыл :
A) Суда ерігенде H+ ионын бөліп диссоциацияланатын электробейтарап қосылыстар.
B) Басқа атомның бос электрон жұбын пайдалатып, электрондық топтасудан кейін тұрақты
атомдар түзетін қосылыстар.
C) Катионды бөліп шығаруға қабілетті бөлшек - протон, анионды бөліп шығаруға қабілетті
бөлшек - электрон.
D) Протонын беруге қабілетті бөлшек.
E) Сутегін еріткіштердің құрамындағы металл немесе электробейтарап бөлшектермен
алмастырғанда түзілетін жаңа қосылыстар.
45. Бренстед- Лоури протолиттік теориясы бойынша негіз:
A) Протонды қосып алуға қабілетті бөлшек.
B) Сутегін еріткіштердің құрамындағы металл немесе радикал бөлшектермен алмастырғанда түзілетін
жаңа қосылыстар.
C)
Суда ерігенде О ионын бөліп диссоциацияланатын
электробейтарап қосылыстар
ионын бөліп диссоциацияланатын
электробейтарап қосылыстар
D) Анионды бөліп шығаруға қабілетті бөлшек - электрон, катионды бөліп шығаруға қабілетті бөлшек-протон.
E) Басқа атомның бос электрон жұбын пайдаланып, электрондық топтасудан кейін тұрақты атомдар түзетін қосылыстар.
46. Протолиттік реакция:
A) Реагентің молекуласындағы байланыс санының өзгеруі.
B) Протонның бір бөлшектен екінші бөлшекке ауысуы.
C) Электрон жұбының ауысуынан комплексті қосылыстың түзілуі немесе бұзылуы.
D) Электронның бір бөлшектен екінші бөлшекке ауысуы.
E) Молекулалық бөлшектің бір реагенттен екінші реагентке ауысуы.
47. Бренстед- Лоури протолиттік теориясы тұрғысынан қышқылдық-негіздік реакцияға жатады:
A)
Cu2+
 +
NH30
↔
+
NH30
↔
 CuNH32+.
CuNH32+.
B) HCN + OH- ↔ HOH + CN-.
C) Fe3+ + Cl- ↔ FeCl2+
D) Ni2+ + NO3+ ↔ NiNO3+.
E) Ag+ + NH3 ↔ AgNH3+.
48. Протолиттік теория тұрғысынан қышқыл болып табылатын бөлшектер :
A) ОH-, H3O+.
B) NH4+, HClO4.
C) Cl-,HCl
D) NH3, NH4+.
E) SO42-, H3O+.
49. Протолиттік теория тұрғысынан негіздерге жататын бөлшектер:
A) NH4+, H2О.
B) H3O+, CO32-.
C) SO42-, CO32-.
D) НCO32-, H2SO4.
E) H2SO4, NH4+.
50. Протолиттік теория тұрғысынан лиат иондары:
A) OH-, C2H5O-.
B) Cl-, H3O+.
C) H3O+, C2H5O-.
D) NH4+, H3O+.
E) H3SO4+, OH-.
51. Протолиттік теория тұрғысынан қышқылдарға жатпайтын бөлшек:
A) Н2SO4.
B) H3O+.
C) NH4+.
D) NH3.
E) CH3COOH.
52. Протолиттік теория тұрғысынан негіздерге жатпайтын бөлшек:
A) CH3COO-.
B) NH4+.
C) NH3 .
D) OH-.
E) SO32-.
53. Протолиттік теория тұрғысынан амфолитке жатпайтын бөлшек:
A) NH4+.
B) Н2РО4-.
C) Н2О.
D) HS-.
E) HSO3-.
54. Протолиттік теория тұрғысынан лионий иондары:
A) H3SO4+, C2H5OH2+.
B) NH4+, H3O+.
C) HSO4-, H3SO4+.
D) CH3COO-, H3SO4+.
E) S2-, HSO4-.
55. Бренстед - Лоуридің протолиттік теориясы тұрғысынан сулы ерітінділердегі амфолит:
A) Na2C2O4.
B) H2S.
C) KH2PO4.
D) Na3PO4.
E) HCN.
56. Бренстед- Лоридің проттолиттік теориясы тұрғысынан қышқылға жататын қосылыстар:
A) C6H5OH, CH3SH , C6H5NH3+.
B) Al(OH)2+·5H2O, Zn(OH)+ * 5H2O, (CH3)3P, (C2H5)3P.
C) Al(OH)(CH3COO)2, C3H5N, C4H4O62-.
D) Na2SO3, C6H5O-, HSO4-, CH3NH2.
E) C5H5N, NH3, Zn(OH)-*5H2O.
57. Протолиттік теория тұрғысынан C6 H5СOOH қышқылына қосарланған негіз :
A) NH3 сұйық..
B) C6H5NH2
C) C6H5OO-.
D) C6H5N.
E) ( C6H5)2NH.
58. Диссоциациялану константасының мәндерін салыстыра қарағанда ең күшті негіз:
A) Аммоний гидроксиді, Kb = 1,76*10-5.
B) Гидразин, Kb = 9,8*10-7.
C) Гидроксиламин, Kb = 9,6*10-9.
D) Дифениламин, Kb = 7,1*10-14.
E) Күміс гидроксиді,Kb = 5,0*10-3.
59. Диссоциациялану константасының мәндерін салыстыра қарағанда ең әлсіз негіз:
A) Аммоний гидроксиді, Kb = 1,76*10-5.
B) Гидразин, Kb = 9,8*10-7.
C) Гидроксиламин ,Kb = 9,6*10-9)
D) Дифениламин Kb = 7,1*10-14.
E) Күміс гидроксиді Kb = 5,0*10-3.
60. Концентрациясы 0,001 моль/л азот қышқылы ерітіндісінің рН-ы:
A) lg10-3
B) 11.
C) ln10-3.
D) – lg10-3.
E) 4.
61. Эквивалентінің молярлық концентрациясы 0,1 моль/л Са(ОН)2 ерітіндісінің рН-ы:
A) 15.
B) 14 + lg10-1.
C) 14.
D) Kw /10-1.
E) 1.
62. СОН- = 10-13 болғанда ерітінді ортасы:
A) Күшті қышқылдық.
B) Сiлтiлiк.
C) Бейтарап.
D) Әлсiз негiздiк.
E) Әлсiз қышқылдық.
63. Сілтілік ортаға сәйкес келеді:
A) СН+ = 10-1.
B) СН+ = 10-11.
C) СН+ = 10-4.
D) СОН- = 10-7.
E) СОН- = 10-3.
64. Қышқылдық ортаға сәйкес келеді:
A) СН+ = 10-12.
B) СН+ = 10-11.
C) СН+ = 10-7.
D) СОН- = 10-14.
E) СОН- = 10-12.
65. Қышқылдық ортада:
A) [H+] > 10-7.
B) [H+] < 10-7.
C) [H+] = 10-7.
D) [ОH-] = 10-7.
E) [H+] = [ОH-] = 10-14.
66. Сілтілік ортада [ОH-]:
A) [ОH-] ≈ 10-7.
B) [ОH-] < 10-7.
C) [ОH-] > 10-7.
D) [ОH-] = 10-7.
E) [ОH-] = 10-14.
67. Күшті электролиттер арасындағы бейтараптану реакциясын сипаттайтын теңдеу:
A)
NH3
+
H2O
↔ NH4+
+ OH-.
B)
H2O
+ H2O
↔ H3O+
+ OH-.
H2O
↔ H3O+
+ OH-.
C) NH3 + CH3COOH ↔ NH4+ + CH3COO-.
D) CH3COOH+ H2О ↔ CH3COO- + H3O+.
E)
H3O+
+
OH-
↔  2H2O.
2H2O.
68. Концентрациясы 0,1 моль/л тең Al2(SO4)3 ерітіндісіндегі катион мен анион концентрациясы:
A) С(Al3+) = 2*0,2 моль/л; С(SO42-) = 3*0,3 моль/л.
B) С(Al3+) = 0,2 моль/л; С(SO42-) = 0,3 моль/л.
C) С(Al3+) = 0,3моль/л; С(SO42-) = 0,2 моль/л.
D) С(Al3+) = 0,1моль/л; С(SO42-) = 0,1 моль/л.
E) С(Al3+) = 0,3моль/л; С(SO42-) = 0,3 моль/л.
69. Күшті қышқыл ерітіндісінің рН-ның мәнін есептейтін қатынас:
A) pH= - lgCH+.
B)
pH = 14 – pKb
+  .
.
C)
pH
= 
D)
pH
=  .
.
E)
pH= 14+ lg .
.
70. Сілті ерітіндісіндегі рН-тың мәнін есептейтін қатынас:
A) pH= - lgCH+.
B) pH = 14 – pKb + .
C) pH =
D) pH = .
E) pH= 14 + lg .
71. Д.И Менделеевтің ерітінділер туралы физика - химиялық теориясы негізделген:
A) Әрекеттесуші массалар заңына.
B) Ле‑Шателье принципі.
C) Еріген зат бөлшектерінің су молекуласымен әрекеттесіп гидраттануына.
D) Бастапқы қосылыстардағы байланыстардың үзіліп, өнімдердегі жаңа байланыстың түзілуіне.
E) Эквиваленттер заңына.
72. Химиялық өзгерістерге негізделген талдауды атайды:
A) Физикалық.
B) Химиялық.
C) Физика-химиялық.
D) Радиациялық.
E) Инструменталдық .
73. Қышқыл күшінің көрсеткіші:
A) pKw.
B) pМе.
C) pKa.
D) pKB .
E) CH+
74. Негіз күшінің көрсеткіші:
A) pKw.
B) pМе.
C) pKa.
D) pKb.
E) CH+ .
75. Қышқыл диссоциациясының термодинамикалық константасы КТ мен концентрациялық
константасы Кс арасындағы байланыс:
A) K1 / K2 қатынасы ерітіндінің иондық күшіне тәуелді.
B) К1 мен K2 арасында байланыс жоқ.
C) Ерiтiндi концентрациясы артқанда KK/KT қатынасы кемидi.
D) KK/KT қатынасы тұрақты шама, концентрацияға тәуелдi емес.
E) KK = KT.
76. Гомогенді аА + bB → cC+ dD реакциясы үшін концентрациялық константа
термодинамикалық константаға тең болады:
A) с > а.
B) с = а.
C) f* > 0.
D) с < а.
E) f < 1.
77. Тепе-теңдік константасын анықтайтын өрнек:
A) К = К1 / К2.
B) a = C.
C) a = f · c.
D) [H2O] = C(H2O) .
E) KW = 1,0 * 10-14.
78. Ерітіндіде канша Ag + мен СІ - -болса, осы иондардан дәл сондай мөлшерде АgCI
түрінде тұнбаға түседі, осы кездегі ерітінді күйін атайды:
A) Концентрленген ерітінді.
B) Сұйытылған ерітінді .
C) Гомогенді жүйе.
D) Қаныкқан ерітіндіде орнаған динамикалык тепе-тендік.
E) Қаныкпаған ерітінді.
79. Тепе-теңдік константасы Кт-т = 10-8 тең болатын, А + B ↔ D + E реакциясы үшін:
A) Реакция оңнан солға қарай жүреді.
B) Реакция жүрмейдi.
C) Реакция солдан оңға қарай жүредi.
D) Тура және керi бағыттағы реакциялардың жылдамдықтары тең.
E) Тура бағыттағы реакция жылдамдығы керi бағыттағы реакция жылдамдығынан артық.
80. mА + nВ pС + qD реакциясының тепе-теңдік күйіне сәйкес өрнек:
A) K= k1*k2 = [A]m[B]n*[C]p[D]q.
B)
K
=

 >
> .
.
C)
K
=

 =
=

 .
.
D) k1[A]m[B]n = k2[C]p[D]q.
E) k1 > k2
81. Химиялық тепе теңдік күйге сәйкес келетін дұрыс тұжырым:
A) Тура реакцияның жылдамдығы кері реакцияның жылдамдығынан аз шамада жоғары.
B) Тура реакцияның жылдамдығы кері реакцияның жылдамдығынан әлдеқайда жоғары.
C) Тура реакцияның жылдамдығы кері реакцияның жылдамдығына тең.
D) Тура реакцияның жылдамдығы кері реакцияның жылдамдығынан аз шамада төмен.
E) Тура реакцияның жылдамдығы кері реакцияның жылдамдығынан әлдеқайда төмен.
82. Әрекеттесушіетуші массалар заңына сәйкес келетін тұжырым:
A) Реакция жылдамдығы стехиометриялық коэффиценттері дәреже түрінде алынған
әрекеттесуші заттар концентрацияларының көбейтіндісіне тең.
B) Реакция жылдамдығы түзілетін заттардың концентрациясына тең.
C) Реакция жылдамдығы бастапқы заттардың концентрациясына тең.
D) Реакция жылдамдығы әрекеттесуші заттар концентрацияларының қосындысына тең.
E) Реакция жылдамдығы әрекеттесуші заттар концентрацияларына тең.
83. Әрекеттесуші массалар заңының химиялық талдауда қолданады:
A) Сұйытылған әлсіз электролит ерітінділеріне.
B) Концентрленген ерітінділерге.
C) Сұйылтылған күшті қышқылдардың сулы ерітінділеріне.
D) Сұйылтылған күшті электролиттердің сулы ерітінділеріне.
E) Кез келген сулы ерітінділеріне.
84. Әлсіз электролитке жататын қосылыстар қатары:
A) NH4OH, H2O, CH3COOH.
B) AgCl, CH3COOH, NH4Cl.
C) HCN, CH3COONa, Fe(CNS)3.
D) AgI, CH3COOH, CH3COONH4.
E) H2O, NH4Cl, KCl.
85. Күшті электролиттер ерітінділерінде иондану дәрежесі тең:
A) 0
B) < 1
C) < 0
D) > 1
E) 1
86. Сутегі ионының концентрациясының мәні иондану дәрежесіне тәуелді электролит :
A) H2SO4.
B) HNO3.
C) HCl.
D) CH3COOH.
E) HJ.
87. Гидроксид ионының концентрациясының мәні иондану дәрежесіне тәуелді электролит :
A) KOH.
B) HNO3.
C) NaCl.
D) NH4OH.
E) K2SO4.
88. Күкіртті қышқыл ерітіндісіндегі [H+] есептейтін теңдеу:
A) [H+] = C(H2SO3).
B)
[H+]
= 
 .
.
C) [H+] = с + a
D) Тотықсыздандырғыштық қасиеті.
E) Тотықтырғыштық қасиеті.
89. 0.01моль/л HClO хлорлылау қышқылы ерітіндісінің pH-ы (K= 10-8) :
A) 4,0.
B) 3,0.
C) 7,0.
D) 6,0.
E) 5,0.
90. Концентрациясы 0,0001моль/л NaOH ерітіндісінің pH-ы:
A) 2.
B) 5.
C) 7.
D) 9.
E) 10.
91. 0,00001н HCl ерітіндісінің pOH-ы:
A) 2.
B) 5.
C) 7.
D) 3.
E) 9.
92. Ерітінді рН-ның мәні 7 болғандағы [H+] иондарының концентрациясы:
A) 3.
B) 10-7.
C) 3 · 103.
D) 11.
E) 10-9.
93. Концентрациясы 10-3 н HCl ерітіндісінің pOH-ы:
A) 2.
B) 5.
C) 7.
D) 9.
E) 11.
94. Эквивалентінің молярлық концентрациясы 0,1моль/л натрий гидроксиді ерітіндісінің рН-ы:
A) 14-ln 10-1.
B) 14- lg 10-1.
C) 14+ln10-1.
D) 14+ lg10-1.
E) 10-14.
95. Сутектік көрсеткіші 5-ке тең ерітіндідегі сутегі ионының концентрациясы:
A) 10-1.
B) 10-3.
C) 10-5.
D) 10-7.
E) 10-9.
96. Сутектік көрсеткіші 4-ке тең ерітіндідегі гидроксил ионының концентрациясы:
A) 10-2.
B) 10-4.
C) 10-6.
D) 10-8.
E) 10-10.
97.
Концентрациясы [H+
] =  4,5·10-9
моль/л ерітіндідегі гидроксид ионының
концентрациясы:
4,5·10-9
моль/л ерітіндідегі гидроксид ионының
концентрациясы:
A) 2,2· 10-4.
B) 2,2 · 10-5.
C) 2,2 · 10-6.
D) 2,2 · 10-7.
E) 2,2· 10-8.
98. Эквивалентінің молярлық концентрациясы 0,01 моль/л күкірт қышқылы ерітіндісінің рН-ы:
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
99. НСl ерітіндісін 100 есе сумен сұйылтқанда рН-тың мәні:
A) 2 есе артады.
B) 2-ге артады.
C) Өзгермейді.
D) 2 есе кемиді.
E) 2-ге кемиді.
100.
CH
> CM
 болатын
қосылыс :
болатын
қосылыс :
A) HCl.
B) NaCl.
C) NaOH.
D) KNO3.
E) H3PO4.
101. CH = CM болатын қосылыстар:
A) HCl, NaOH.
B) Na2SO4, NaOH.
C) H3PO4, КОН.
D) KNO3, Н2SO4,
E) H3PO4, HCl.
102. Химиялық тепе-теңдік константасының сандық мәні төмендегі көрсеткіштердің біреуін
анықтауға мүмкіндік бермейді:
A) Химиялық реакцияның жылу эффектісін.
B) Изотондық коэффицентті.
C) Бастапқы заттардың өзгеру дәрежесін.
D) Тепе-теңдік жағдайындағы реакция өнімдерінің шығымын.
E) Бастапқы заттың диссоциациялану дәрежесін.
103.
= 
 қатынасына сәйкес келеді :
қатынасына сәйкес келеді :
A) Освальдтың сұйылту заңы.
B) Аррениус теңдеуі.
C) Нернст теңдеуі.
D) Илькович теңдеуі.
E) Вант-Гофф теңдеуі.
104. Автопротолиз реакциясы:
A) C2H5OH + C2H5OH ↔ C2H5OH2+ + C2H5O-.
B) NH3+H2O↔ NH4+ +OH-.
C) NH4+ + H2O↔NH3 +H3O+.
D) NH4+ +CH3COOH↔ NH3+ CH3COOH2+.
E) CH3COO- H2O↔ CH3COOH +OH-.
105. Әлсіз электролиттердің иондану константасының мен иондану дәрежесімен байланысын
көрсететін теңдеу:
A)
 .
.
B)
 .
.
C)
 .
.
D)
 .
.
E)
 .
.
106. Күшті электролиттердің бейтараптану реакциясын сипаттайтын теңдеу:
A) NH3 + H2O ↔ NH4+ + OH-.
B) H+ + OH- ↔ H2O; H3O+ + OH- ↔ 2H2O.
C) NH3 + CH3COOH ↔ NH4+ + CH3COO-.
D) CH3COOH +H2O ↔ H3O+ + CH3COO-.
E) NH3 + CH3COO-↔ NH4+ + CH3COOH
107. Иондану константасының мәндерін салыстырғандағы ең күшті қышқыл:
A) K (HNO2) = 5.1· 10- 4.
B) K (HBrO) = 2.5·10- 9
C) K (HIO3) = 1.6· 10- 1.
D) K (HIO) = 2.3·10- 11.
E) K (HF) = 6.8 · 10- 4.
108. Диссоциациялану константасының мәндерін салыстыра қарағанда ең әлсіз қышқыл :
A) K(HNO2) = 5.1· 10- 4.
B) K(HBrO) = 2.5·10- 9
C) K(HIO3) = 1.6· 10- 1.
D) K(HIO) = 2.3·10- 11.
E) K(HF) = 6.8 · 10- 4.
109. Диссоциациялану константасының мәндерін салыстыра қарағанда ең күшті негіз:
A) Аммоний гидроксиді, Kb = 1,76*10-5.
B) Гидразин, Kb = 9,8*10-7.
C) Гидроксиламин, Kb = 9,6*10-9.
D) Дифениламин, Kb = 7,1*10-14.
E) Күміс гидроксиді,Kb = 5,0*10-3.
110. Диссоциациялану константасының мәндерін салыстыра қарағанда ең әлсіз негіз:
A) Аммоний гидроксиді, Kb = 1,76*10-5.
B) Гидразин, Kb = 9,8*10-7.
C) Гидроксиламин ,Kb = 9,6*10-9)
D) Дифениламин Kb = 7,1*10-14.
E) Күміс гидроксиді Kb = 5,0*10-3.
111. K(NH4OH) =10-5 тең 0,001 н. NH4OH ерітіндісінің рН-ы:
A) 1.
B) 2.
C) 3.
D) 4.
E) 10.
112. 0.001моль/л сірке қышқылының (Ka = 10-5) иондану дәрежесі (%) :
A) 13.
B) 1.
C) 12.
D) 6.
E) 2.
113. Иондану дәрежесі 4,2% концентрациясы 0,01М аммиак ерітіндісінің тепе-теңдік концентрациясы (моль/л) :
 A)
4,2 · 10-1
моль/
л.
A)
4,2 · 10-1
моль/
л.
B) 4,2 · 10-2 моль/л.
C) 4,2 · 10-3 моль/л.
D) 4,2 · 10-4 моль/л.
E) 4,2 · 10-5 моль/л.
114. 0,01М әлсіз бірқышқылды негіз ерітіндісінің рН=10. Негіздің диссоциациялану константасы:
A) 1· 10-20.
B) 1· 10-18.
C) 1· 10-10.
D) 1· 10-8.
E) 1· 10-6.
115. 0,1М әлсіз бірнегізді қышқыл ерітіндісіндегі сутегі ионының концентрациясы 10-5 моль/л.
Қышқылдың диссоцииялану константасы :
A) 1 · 10-1.
B) 1 · 10-5.
C) 1 · 10-6.
D) 1 · 10-10.
E) 1 · 10-9.
116. K(СH3СОOH) = 10-5 тең 0,001н СH3СОOH ерітіндісінің рН-ы:
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
117.
Экивалентінің молярлық концентрациясы
0,1 моль /л ,
 =
=  0,01
тең болатын сірке қышқылы ерітіндісінің
рН-ы:
0,01
тең болатын сірке қышқылы ерітіндісінің
рН-ы:
A) 1.
B) 0,5.
C) 3.
D) 2
E) 2,5.
118. Әлсіз қышқыл ерітіндісінің pH-ын есептейтін формула:
A) pH = - lgCH+.
B)
 .
.
C)
pH
=14 - pKB + lg
 .
.
D) pH = pKа - lgCа.
E) pH =14 + lgCOH-.
119. Әлсіз негіз ерітінділеріндегі рН-тың мәнін есептейтің қатынас:
A)

B)
pH = 14+ lgCOH- .
.
C) pH = -lgCH+.
D)
pH=  -
-  -
- 
 .
.
E) pH = 14- pKВ + lg .
120. Әлсіз бір қышқылды негіз ерітінділеріндегі рОН-тың мәнін есептейтін теңдеу:
A)
[H+]
=  .
.
B)
pH = 14+
+  .
.
C) pH =14 - - .
D) pOH = pKВ +lg CВ

Гидролиз
121. Тұз иондарының сумен әрекеттесіп әлсіз электролит түзу нәтижесінде реакция ортасының өзгеруі:
A) Иондану.
B) Ассоциация.
C) Гидролиз.
D) Тотығу-тотықсыздану.
E)Электролиз.
122. Ортасы сілтілік болатын тұз ерітіндісінің [OH-] есептейтін қатынас :
A)

B)

C)

D)


E)

123. Ортасы қышқылдық болатын тұз ерітіндісінің [H+] есептейтін қатынас:
A)

B)

C)

D)
E)

124. Ортасы бейтарап болатын тұз ерітіндісінің [H+] есептейтін қатынас:
A)
B)
C)
D)
E)
125. Гидроиз константасын белгілейді:
A) Ks
B) Ka
C) Kb
D) Kh
E) β.
126. Қайтымсыз гидролизденетін тұз реакциясының теңдеуі:
A) CaCI2 + H2C2O4 = CaC2O4 + 2HCI.
B) AI2S3 + 6H2O = AI(OH)3 +3H2S.
C) NaOH + HCI = NaCI + H2O.
D) Fe + 2HCI = FeCI2 + H2.
E) Na2CO3 + 2HCI = 2NaCI + CO2 + H2O.
127. Қайтымсыз гидролизденетін тұз реакциясының теңдеуі:
A) CaCI2 + H2C2O4 = CaC2O4 + 2HCI.
B) 2AICI3 + 3Na2CO3 + 3H2O = 2AI(OH)3 +6NaCI + 3CO2.
C) NaOH + HCI = NaCI + H2O.
D) Fe + 2HCI = FeCI2 + H2.
E) Na2CO3 + 2HCI = 2NaCI + CO2 + H2O.
128. Катион бойынша гидролизденетін тұз:
A) КCI
B) К2 SO4
C) AICI3.
D) Na2SO4
E) NaNO3.
129. Анион бойынша гидролизденетін тұз:
A) КCI
B) NaAIO2
C) AICI3
D) Na2SO4.
E) NaNO3
130. Әлсіз қышқылдан және күшті негізден түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН = 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН = 7 орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН = 7 болады.
131. Әлсіз негізден және күшті қышқылдан түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН = 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН = 7 орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН = 7 болады.
132. Әлсіз негізден және әлсіз қышқылдан түзілген тұздардың гидролизін сипаттайтын дұрыс жағдай:
A) Тұздың анионы сумен әрекеттесіп әлсіз қышқылдың түзілуінен реакция ортасы рН > 7 болады.
B) Тұздың катионы сумен әрекеттесіп әлсіз негіздіңң түзілуінен реакция ортасы рН < 7 болады.
C) Тұздың катионы да, анионы да сумен әрекеттесіп әлсіз қышқыл және әлсіз негіз түзілуінен
реакция ортасы рН ≈ 7 болады.
D) Реакция нәтижесінде әлсіз қышқыл түзіледі, рН ≈ 7 .орта.
E) Реакция нәтижесінде әлсіз негіз түзіледі, орта рН ≈ 7 .болады.
133.
 теңдігімен
есептейтін бинарлы тұздар тұрады:
теңдігімен
есептейтін бинарлы тұздар тұрады:
A) Әлсіз қышқылдан және күшті негізден түзілген.
B) Әлсіз негізден және әлсіз қышқылдан түзілген.
C) Күшті негіз бен күшті қышқылдан түзілген.
D) Әлсіз негізден және күшті қышқылдан түзілген.
E) Қос тұздан түзілген.
134.
 теңдігімен
есептейтін бинарлы тұздар тұрады:
теңдігімен
есептейтін бинарлы тұздар тұрады:
A) Әлсіз қышқылдан және күшті негізден түзілген.
B) Әлсіз негізден және әлсіз қышқылдан түзілген.
C) Күшті негіз бен күшті қышқылдан түзілген.
D) Әлсіз негізден және күшті қышқылдан түзілген.
E) Қос тұздан түзілген.
135.
Гидролизденгенде ерітінді ортасын  қатынасымен
есептейтін тұз:
қатынасымен
есептейтін тұз:
A) КCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
E) NH4 Cl.
136.
Гидролизденгенде ерітінді ортасын  қатынасымен
есептейтін тұз:
қатынасымен
есептейтін тұз:
A) NaCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
D) NH4 Cl.
137.
Гидролизденгенде ерітінді ортасын  қатынасымен
есептейтін тұз:
қатынасымен
есептейтін тұз:
A) NaCl.
B) NaNO3.
C) KCN.
D) CH3COONH4.
E) NH4Cl.
138. Алюминий хлориді тұзының гидролизін арттыру үшін қолданады:
A) Na2CO3.
B) NaNO3.
C) KCl.
D) K2SO4.
E) NaCl.
Буферлік ерітінділердегі тепе-теңдік
139. Буферлік жүйе:
A) Аз мөлшерде күшті қышқыл немесе сілті қосқанда, сұйылтқанда ортаның сутектік көрсеткішін өзгертпейтін жүйе.
B) Әлсіз негізден және оның әлсіз қышқылдан түзілген тұзы қоспасынан тұратын жүйе.
C) Әлсіз қышқылдан және оның әлсіз негізден қосылған тұзынан тұратын жүйе.
D) Кез келген қышқылдан және оның тұзынан тұратын жүйе.
E) Кез келген негiзден және оның тұзынан тұратын ерiтiндi.
140. Магний ионын натрий гидрофосфатымен анықтауда қолданылатын буферлік жүйе:
A)
Na2HPO4
 +
NaH2PO4.
+
NaH2PO4.
B)
CH3COOH
 +
CH3COONa.
+
CH3COONa.
C) HCOOH + HCOONa.
D) NH4OH + NH4Cl.
E)
H2CO3
 +
NaHCO3.
+
NaHCO3.
141.
2BaCl2 +
K2Cr2O7+
H2O
+
K2Cr2O7+
H2O =
2BaCrO4
+
2KCl +2HCl реакциясын жүргізу үшін қажетті
буферлік жүйе:
=
2BaCrO4
+
2KCl +2HCl реакциясын жүргізу үшін қажетті
буферлік жүйе:
A) Na2HPO4 + NaH2PO4.
B) CH3COOH + CH3COONa.
C) HCOOH + HCOONa.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
142. Қышқылдық буферлік жүйе:
A) Әлсіз қышқыл және оның әлсіз негізден түзілген тұз ерітінділерінің қоспасы.
B) Күшті негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
C) Күшті қышқыл және оның әлсіз негізден түзілген ерітінділерінің қоспасы.
D) Әлсіз қышқыл және оның күшті негізден түзілген тұз ерітінділерінің қоспасы.
E) Күшті қышқыл және оның күшті негізден түзілген тұз ерітінділерінің қоспасы.
143. Негіздік буфер жүйесі:
A) Күшті негіз және оның күшті қышқылдан түзілген тұз ерітінділерінің қоспасы.
B) Күшті қышқыл және оның әлсіз негізден түзілген тұз ерітінділерінің қоспасы.
C) Әлсіз негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
D) Әлсіз негіз және оның күшті қышқылдан түзілген тұз ерітінділерінің қоспасы.
E) Күшті негіз және оның әлсіз қышқылдан түзілген тұз ерітінділерінің қоспасы.
144. Ацетат буферінің қышқылмен өзара әрекеттесуінің молекулалық теңдеуі:
A)
CH3COOH+
HCl → CH3COOCl
CH3COOCl + H2O
.
+ H2O
.
B)
CH3COOH
+ HCl
 CH3COONa
+ NaCl.
CH3COONa
+ NaCl.
C) CH3COONa+ HCl CH3COOH + NaCl.
D)
CH3COONa
+ 2HCl
CHCl2
COOH + 2NaCl.
+ 2NaCl.
E) CH3COONa + HCl CH2Cl COOH + NaCl.
145. 0,01 моль/л сірке қышқылы (Ка = 1,8*10-5) және 0,01 моль/л натрий ацетаты ерітінділерінің
бірдей көлемдерін араластырған кезде түзілген ерітіндінің рН-ы:
A)1,00.
B) 2,00.
C) 3,00.
D) 4,75.
E) 9,25.
146. 0,1 моль/л сірке қышқылы (Ка = 1,8*10-5) және 0,01 моль/л натрий ацетаты ерітінділерінің
бірдей көлемдерін араластырған түзілген ерітіндінің рН-ы:
A) 1,25.
B) 2,75.
C) 5,75.
D) 4,75.
E) 3,75.
147. Қышқылдық буфер ерітінділерінің рН мәнін есептеу үшін қажет шамалар:
A) ақ-л және СНAn/CKtAn.
B) Kқ-л және СНAn/CKtAn.
C) Kқ-л және СKtAn/CНAn.
D) h және СНAn/CKtAn.
E) h гидролиз дәрежесі және a.
148. Негіздік буферлік жүйе ерітіндісінің рН –ын есептейтін Гендерсон-Гассельбах теңдеуі:
A) pH = -lgCH+.
B)
 +lg
+lg
C) pH= 14- pOH.
D)
pH=  -
-  .
.
E)
pH=  -
-
-
- .
.
149. Көлемі 100 см3, 0,2 моль/л CН3COOH (K(CН3COOH)=10-5) ерітіндісінің көлемі100 см3,
0,2моль /л CН3COONa ерітіндісін қосқанда түзілген ерітіндісінің рН-ы:
A) 1.
B) 2.
C) 3.
D) 4.
E) 5.
150. С н= 0,05 моль/л , Ст = 0,5 моль/л , Kн= 10-7 тең буфер жүйесінің pH-ның мәні :
A) 2.
B) 4.
C) 6.
D) 8.
E) 10.
151. Негіздік буфер жүйесін 100 есе сұйылтқанда рН мәні қалай өзгереді:
A) 10 есе артады.
B) 2 есе артады.
C) Өзгермейді.
D) 2 есе кемиді.
E) 10 есе кемиді.
152. Қышқылдық буфер жүйесін 100 есе сұйылтқанда рН-тың мәні:
A) 10 есе артады.
B) 2 есе артады.
C) Өзгермейді.
D) 2 есе кемиді.
E) 10 есе кемиді.
153. Буферлік әсері бар қоспаға жатпайды:
A) СН3СООNa + СН3СООК .
B) СН3СООН + СН3СООNа .
C) NH4ОН + NH4Сl .
D) НСООН + НСООNа.
E) NаНСО3 + Н2СОЗ .
154.
Негіз концентрациясы 0,05 моль/л (Kb =
10-7),
тұз концентрациясы 0,5моль/л тең болатын
=
10-7),
тұз концентрациясы 0,5моль/л тең болатын
буферлік жүйенің рН-ы:
A) 2.
B) 4.
C) 6.
D) 8.
E) 10.
155. Буферлік жүйелердің рН-ның минималды мәнінен максималды мәнге дейін өзгерту үшін
қолданатын қатынас :
A)
 .
.
B)
 .
.
C)
 .
.
D)
 .
.
E)
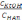 .
.
156. Қышқылдық буферлі жүйенің сутектік көрсеткішін біртіндеп өзгеретін ерітінді даярлау
үшін өзгертіліп отыратын қатынас:
A) Kb.
B) Снегіз.
C) Стұз.
D) Сқышқыл / Стұз.
E) СOH-
157. Негіздік буферлі жүйенің сутектік көрсеткіші біртіндеп өзгеретін ерітінді даярлау үшін
өзгертіліп отыратын қатынас:
A) KB.
B) Снегіз.
C) Стұз.
D) Снегіз / Стұз.
E) СOH-
158. Реакция ортасы pH = 4,7 болу үшін қолданатын буферлік жүйе:
A) Ацетат буфері.
B) Аммоний буфері.
C) Формиат буфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
159. Реакция ортасы pH = 9,3 болу үшін қолданатын буферлік жүйе:
A) Ацетат буфері.
B) Аммоний буфері.
C) Формиат буфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
160. Реакция ортасы pH = 3,7 болу үшін қолданатын буферлік жүйе:
A) Ацетат буфері.
B) Аммоний буфері.
C) Формиат буфері.
D) Гидрокарбонат буфері.
E) Фосфат буфері.
161. Буферлік сыйымдылық сақталатын аудан:
A) pH = pK.
B) pH = pK ± 2.
C) pH = pK ± 1.
D) pH = pK ± 3.
E) pH = pK ± 4.
Ерігіштік көбейтіндісі
162. А + B ↔ D + E теңдеуінің тепе-теңдік константасы 10-6 тең болса, реакция:
A) Оңнан солға қарай жүреді.
B) Жүрмейді.
C) Солдан оңға қарай жүреді.
D) Тура реакцияның жылдамдығы кері реакцияның жылдамдығына тең.
E) Тура реакцияның жылдамдығы кері реакцияның жылдамдығынан жоғары.
163. Қосылыстың ерігіштігі бойынша ерігіштік көбейтіндісін есептегенде активтілік коэффицентті ескеретін тұз:
A) Кs (СаSO4 = 2,37 · 10-5.
B) Кs(AgCl)=1,78·10-10.
C) Кs (PbSO4)=1,60·10-8.
D) Кs (CaCO3)=4,80·10-9.
E) Кs (PbS)=2,50·10-27.
164. Күміс хлориді тұнбасының ерітіндісіне NaNO3, Cd(NO3)2, Al(NO3)3 тұздарының ерітінділерін қосқан кезде AgCl тұзының ерігіштігі өзгереді:
A) Барлық тұздар AgCl ерігіштігін бірдей мөлшерде өзгертеді.
B) NaNO3 тұзы ерiгiштiгiн төмендетедi.
C) Ca(NO3)2 тұзы ерiгiштiгiн төмендетедi.
D) Барлық тұздар AgCl ерiгiштiгiн бiрдей мөлшерде өзгертпейді.
E) Барлық тұздар AgCl ерiгiштiгiне әсер етпейдi.
165. mA + nB ↔ AmBn қатты реакция теңдеуіндегі AmBn қосылысының ерігіштік көбейтіндісі:
A) Ks = [An+]m * [Bm+]n.
B) Ks =([A]m*[B]n)/[AmBn].
C) Ks =[A]m+[B]n .
D) Ks =m[A]*n[B].
E) Ks =m[A]+n[B].

166. Тұнбаның ерігіштігіне 1,5 есе артық қосылған тұндырғыштың әсері :
A) Ерігіштікті арттырады.
B) Ерігіштікті төмендетеді.
C) Ерігіштік максимум мәнге жетеді.
D) Ерігіштік минимум мәнге жетеді.
E) Ерігіштік өзгермейді.
167. Кальций фосфатының ерігіштігін есептейтін формула :
A)
S(Ca3(PO4)2)
=

 .
.
B)
S(C
 .
.
C)
S(C
 .
.
D)
S(C
 .
.
E)
S(C
 .
.
168. Нашар еритін қосылыстардың ерігіштігіне аттас иондардың әсері:
A) Әсер етпейді.
B) Ерігіштік төмендейді.
C) Ерігіштік артады.
D) Тұнба толық ериді.
E) Қанықпаған ерітінді түзіледі.
169. Нашар еритін қосылыстардың ерігіштігіне аттас емес иондардың әсері:
A) Ерігіштік артады.
B) Ерігіштік төмендейді.
C) Тұнба толық ериді.
D) Әсер етпейді.
E) Қанықпаған ерітінді түзіледі.
170.
AmBn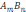 жүйесі үшін тұнбаның түзілу жағдайы
(I≠0):
жүйесі үшін тұнбаның түзілу жағдайы
(I≠0):
A)
[A]m
 [B]n
[B]n
 ≤ KS.
≤ KS.
B) [An+]m [Bm-]n ≥ KS.
C) [ A]m [B]n = KS.
D) [A]m [B]n жүйесі KS мәніне тәуелсіз.
E) KS = 10- 4 тең болғанда тәуелділік сақталады.
171.
Әрекеттесуші массалар заңы бойынша
Al(O H)3
↔
H)3
↔ Al3+
+ 3OH-
тепе-теңдіктегі жүйенің ерігіштік
көбейтіндісі:
Al3+
+ 3OH-
тепе-теңдіктегі жүйенің ерігіштік
көбейтіндісі:
A)
[Al3+]
=
[OH- ].
].
B) [Al3+] = [OH- ]³.
C) KS = [ Al3+] = [ OH-].
D) KS = [Al3+] * [OH-]³.
E) KS = [ Al(OH)3] = [Al3+] = [OH-]³.
172. KNO3 қосқанда PbSO4 тұзының ерігіштігі :
A) Кемиді.
B) Кемиді , содан соң артады.
C) Артады , содан соң кемиді.
D) Өзгермейді.
E) Артады.
173. Кs (AgCl) = 10-10 тең, AgCl ерігіштігі :
A) 10-10 моль/л.
B) 10-7 моль/л.
C) 10-5 моль/л.
D) 10-3 моль/л.
E) 1 моль/л.
174. Ерігіштігі 5 • 10-5моль/л тең Ag2CrO4 тұзының ерігіштік көбейтіндісі :
A) 5 • 10-15.
B) 10-15.
C) 5 • 10-13.
D) 10-10.
E) 5 • 10-5.
175. Ерігіштігі 5 • 10-4моль/л болатын Mg (OH)2 тұзының ерігіштік көбейтіндісі :
A) 5 • 10-10.
B) 5 • 10-8.
C) 10-7.
D) 5 • 10-4.
E) 2,5• 10-2.
176. Қай қосылыстың ерігіштігіне ортаның рН әсер етеді:
A) AgCl.
B) Mg(OH)2.
C) BaSO4.
D) Al.
E) Барлық нашар еритін қосылыстарға.
177. Төмендегі қай қосылыстардың әсерінен KClO3-ның ерігіштігі төмендейді:
A) HCl.
B) NH4Cl.
C) CaCl2.
D) NaClO3.
E) NaCl.
178. Төмендегі қай қосылыстардың әсерінен PbSO4-ның ерігіштігі артады:
A) K2SO4.
B) Na2SO4
C) Li2SO4.
D) (NH4)2SO4.
E) NaNO3.
179. K2SО4 ерітіндісі қосылғанда BaSО4 тұзынын ерігіштігі қалай өзгереді:
A) Өзгермейді.
B) Артады.
C) Төмендейді.
D) Бастапкы кезде артады содан соң өзгермейді .
E) Бастапкы кезде төмендейді содан соң өзгермейді.
180. Қорғасынның концентрациясы көп болатын қаныққан ерітінді:
A) Кs(PbMoO4) = 4.0*10-6.
B) Кs(PbSO) = 1.6*10-8.
C) Кs(PbS) = 2.5*10-27.
D) Кs(PbCO) = 1.0*10-13.
E) Кs(PbCrO) = 1.8*10-14.
181. Анықтайтын ионды қосылыс түрінде тұнбаға түсіру үшін тұндырғыш реагентті қосады:
A) Реакция теңдеуін теңестіргеннен кейінгі қажет мөлшерден кішкене аз алады.
B) Реакция теңдеуін теңестіргеннен кейінгі эквивалент мөлшерін.
C) 1,5 есе артық.
D) 5 есе артық.
E) Көп мөлшерде артық.
182. Концентрациясы 6*10-2 моль/л MgCl2 ерітіндісінен рН-тың қандай мәнінен бастап Mg(ОН)2 түрінде тұнбаға түсе бастайды KS (Mg(ОН)2) = 6*10-10 :
A) 2.
B) 4.
C) 6.
D) 8.
E)10.
183. Концентрациясы 5*10-4 моль/л Сu(NO3)2 ерітіндісінен рН қандай мәнінен бастап Cu(ОН)2 түрінде тұнбаға түсе бастайды KS(Cu(ОН)2) = 5*10-20 :
A) 2.
B) 4.
C) 6.
D) 8.
E) 10.
184. Концентрациялары 0,01 моль/л Cl- және I- - иондары бар ерітіндіге концентрациясы 0,01 моль/л AgNO3 ерітіндісімен әсер еткенде бірінші тұнбаға түседі KS (AgCl) = 1,78*10-10; KS (AgI) = 8,3 *10-17:
A) AgCl.
B) AgI.
C) Екі тұз бірге.
D) Екі тұз да тұнбаға түспейді.
E) Ag2Cl.

185.
Ерігіштік көбейтіндісі ( KS(PbI2)=
1,1· 10-9
тең болатын Pb
10-9
тең болатын Pb I2
ерігіштігі (моль/л) :
I2
ерігіштігі (моль/л) :
A)
4 ·
10-9
.
B)
1·
10-9
.
C)
1·
10-6
.
 D)
1·
10-3
.
D)
1·
10-3
.
E) 1· 10-1 .
186. Массасы 0,0069 г кальций карбонаты еріген 1 л қаныққан ерітіндінің ерігіштік көбейтіндісі
Ks(M(CaCO3) = 100 г/моль):
B)
2,3 10-8.
10-8.
C) 7,5 10-3.
D) 4,8 10-9.
E) 1,1 10-5.
187. Ерігіштігі S = 1 10-3 моль/л тең , AB2 тұзының ерігіштік көбейтіндісі Ks:
A) 1 10-3.
B) 4 10-9.
C) 2 10-6.
D) 3 10-6.
E) 4 10-6.
188. Қаныққан ерітіндіде :
A) ИК = Ks.
B) ИК > Ks.
C) ИК < Ks.
D) Белгілі бір заңдылық жоқ.
E) Тұнба түзілмейді.
189. Қанықпаған ерітіндіде:
A) ИК = Ks.
B) ИК > Ks.
C) ИК < Ks.
D) Белгілі бір заңдылық жоқ.
E) Тұнба түзіледі.
190. Аса қаныққан ерітіндіде:
A) ИК = Ks.
B) ИК > Ks.
C) ИК < Ks.
D) Белгілі бір заңдылық жоқ.
E) Тұнба түзілмейді.
191. ИК > Ks ерітіндіде:
A) Қаныққан, тепе теңдік орнайды.
B) Аса қаныққан, тұнба түзіледі.
C) Қанықпаған, тұнба түзілмейді.
D) Спирт қосылған.
E) Су қосылған.
192. ИК < Ks болған жағдайда ерітінді:
A) Қаныққан, тепе теңдік орнайды.
B) Аса қаныққан, тұнба түзіледі.
C) Қанықпаған, тұнба түзілмейді.
D) Спирт қосылған.
E) Су қосылған.
193. ИК = Ks ерітіндіде:
A) Қаныққан, тепе теңдік орнайды.
B) Аса қаныққан, тұнба түзіледі.
C) Қанықпаған, тұнба түзілмейді.
D) Спирт қосылған.
E) Су қосылған.
194. Ерігіштік көбейтіндісінің өлшем бірлігі:
A) Өлшемсіз шама.
B) г-моль/л.
C) г/л.
D) г-моль/мл.
E) г/мл.
195.
Гетерогенді "тұнба ерітінді " жүйесіне аттас ионды қосса
тепе-теңдік қалай ығысады :
ерітінді " жүйесіне аттас ионды қосса
тепе-теңдік қалай ығысады :
A)Тепе-теңдік ығыспайды.
B)Тепе-теңдік оңға ығысады.
C)Тепе-теңдік солға ығысады, аз мөлшерде тұнба түзіледі.
D)Тепе-теңдік оңға ығысады, тұнба түзілмейді.
E)Тұнба аз мөлшерде ериді.
196. A3B тұнбасының ерігіштігін есептейтін теңдеу :
A)
S
=  .
.
B)
S = 
C)
4S = 
 .
.
D)
S = 
 .
.
E)
S = 
 .
.
197. Тұнбаға түсіруші реагенттің артық мөлшерінен тұнбаның ерігіштігі :
A) Артады.
B) Кемидi.
C) Ерiгiштiгi минимум арқылы өтедi.
D) Ерiгiштiгi максимум арқылы өтедi.
E) Өзгермейдi.
198. Ерігіштіктің өлшем бірлігі:
A) г/см3, моль/дм3, моль/л.
B) г/моль, кг/моль.
C) г/моль.
D) кг/м3, г/см3, мг/мл.
E) моль/кг.
199. Тұнба түзілетін жағдай:
A) ИК > Ks, аса қаныққан ерітіндіден.
B) ИК < Ks, қанықпаған ерітіндіден.
C) ИК = Ks, аса қаныққан ерітіндіден.
D) ИК < Ks, қаныққан ерітіндіден.
E) ИК = Ks, қаныққан ерiтiндiден.
200. Аса қаныққан ерітіндіде тұнба :
A) ИК > Ks, тұнба түзіледі.
B) ИК = Ks,тұнба түзіледі.
C) ИК = Ks, тұнба ериді.
D) ИК < Ks, тұнба ериді.
E) ИК > Ks, тұнба түзiлмейдi.
201. Қанықпаған ерітіндідегі тұнбаның жағдайы:
A) ИК < Ks, тұнба ериді.
B) ИК > Ks, тұнба ериді.
C) ИК = Ks, тұнба түзіледі.
D) ИК > Ks, тұнба ерімейді.
E) ИК = Ks,тұнба ерiмейдi.
202. Тұнбаның ерігіштігі кемитін жағдай:
A) Аттас ионды қосқанда.
B) Қышқыл қосқанда.
C) Аттас емес ионды қосқанда.
D) Негiз қосқанда.
E) Су қосқанда.
203. Тұз эффектісі:
A) Аттас емес ионның тұнбаның ерігіштігіне әсері.
B) Аттас ионның тұнбаның ерiгiштiгiне әсерi.
C) Аттас ионы бар қышқылдың әсерi.
D) OH- тобы бар негiздiң әсерi.
E) Аттас ионы бар негiздiң әсерi.
204. Хлорсутек қышқылында ең нашар еритін негіз:
A) Ks (Mg(OH)2)= 1,0 ∙ 10-10.
B) Ks (AlOH)3 )= 1,0 ∙ 10-32.
C) Ks (Mn(OH))= 1,9 ∙ 10-13.
D) Ks (Ni(OH)2 )=2,0 ∙ 10-13.
E) Ks (Sb(OH)3)= 4,0 ∙ 10-42 .
205. Хлорсутек қышқылында ең жақсы еритін негіз:
A) Ks (Mg(OH)2 )=1,0 ∙ 10-10.
B) Ks (AlOH)3) =1,0 ∙ 10-32.
C) Ks (Mn(OH))= 1,9 ∙ 10-13.
D) Ks (Ni(OH)2 )=2,0 ∙ 10-13.
E) Ks (Sb(OH)3)= 4,0 ∙ 10-42.
206. Тұнба бетіндегі күміс ионының концентрациясын үш есе арттырса Ag2C2O4 тұнбасының
ерігіштігі:
A) 3 есе кемидi.
B) Өзгермейдi.
C) 3 есе артады.
D) 9 есе кемиді.
E) 9 есе артады.
207. Комплексті қосылыс түзетін жағдайда тұнбаның ерігіштігі тұнбаға түсіруші реагенттің
мөлшерінен:
A) Артық болады.
B) Кем болады.
C) Ерiгiштiгi минимум арқылы өтедi.
D) Ерiгiштiгi максимум арқылы өтедi.
E) Әсер етпейдi.
208. Барий сульфатының (Ks (BaSO4) = 1,0 · 10-12) таза судағы молярлық ерігіштігі оның 0,01 моль/л натрий сульфаты ерітіндісіндегі ерігіштігінен неше есе артық:
A) 10000.
B) 2200.
C) 3500.
D) 20.
E) 4772.
209. Күміс ионы толық тұнбаға түскен болып саналады:
A) AgI; Ks (AgI) = 1,0 · 10-16.
B) AgCl; Ks (AgCl)=1,78·10-10.
C) Ag2CrO4; Ks (Ag2CrO4)=1,1·10-12.
D) Ag2CO3; Ks (Ag2CO3)=6,2·10-12.
E) Ag3PO4; Ks (Ag3PO4)=1,8·10-18.
210. Ерігіштік көбейтіндісі 1,08 · 10-23 тең. А2В3 тұзының ерігіштігі (моль/л):
A) 1 · 10-5.
B) 2·10-23.
C) 1·10-3.
D) 1·10-7.
E)1·10-4.
211. Кейіннен тұнбаға түсетін изоморфты қоспалардан тұнбаны тазарту үшін:
A) Тұнбаны қайтадан тұндырады.
B) Тұнбаны жуады.
C) Комплекс түзу әдісімен зарядын өзгертеді.
D) Тұнба бетіндегі ерітіндіні қышқылдандырады.
E) Су қосады.
212. Нашар еритін электролиттің ерігіштігін өзгерту мақсатында гетерогенді жүйеге аттас емес
электролитті енгізуді атайды:
A) Тұздық эффект.
B) Сілтілік эффект.
C) Негіздік эффект.
D) Қышқылдық эффект.
E) Оксидтік эффект.
213. Гетерогенді жүйедегі Ag2CrO4 ↔ Ag+ + CrO42- тұнбаның еруіне сәйкес келетін өрнек:
A) [Ag+]2[CrO42-] ≠ КS(Ag2CrO4).
B) [Ag+]2[CrO42-] < КS(Ag2CrO4).
C) [Ag+]2[CrO42-] = √ КS(Ag2CrO4).
D) [Ag+]2[CrO42-] = КS(Ag2CrO4).
E) [Ag+]2[CrO42-] > КS(Ag2CrO4).
214. Pb(IО3)2 тұнбасына Pb2+ қосқанда қаныққан ерітіндідегі Pb2+ ионының концентрациясы:
A) Төмендейді.
B) Кешенді қосылыс түзеді және Pb(IО3)2 ерігіштігі төмендейді.
C) Жоғарылайды.
D) Өзгермейді.
E) Кешенді қосылыс түзеді және Pb(IО3)2 ерігіштігі артады.
Комплексті қосылыстар ерітінділеріндегі тепе-теңдік
215. Сулы ерітіндідегі комплексті қосылыстың иондануы:
A) Күшті электролиттер сияқты толық ионданады.
B) Алдымен әлсіз электролиттер сияқты ионданады, түзілген комплексті ион күшті электролиттер сияқты толық ионданады.
C) Әлсіз электролиттер сияқты ионданады.
D) Алдымен күшті электролиттер сияқты ионданады, содан соң түзілген комплексті ион әлсіз электролиттер сияқты сатыланып ионданады.
E) Бірінші және екінші сатысында да әлсіз электролиттер сияқты
ионданады.
216. Монодентатты комплексті қосылыс:
A) K3[Fe(CN)6].
B)
Na2[Fe(SO4)2
].
C) K3[Fe(C2O4)3].
D)
Na3[Fe(PO4)3].
E)
[Fe(NH3 )CO3]Cl.
)CO3]Cl.
217. Полидентатты комплексті қосылыс:
A) K3[Fe(CN)6].
B) Na2[Fe(SO4)2 ].
C) K4[Fe(CN)6].
D)
Na3[Co(NO2)6].
E) [Ag(NH3 )2]Cl.
218. Кобальттың тотығу дәрежесі +3-ке тең [Co(NH3 )4(CN)2]x комплексті ионының заряды:
A) 0.
B) +.
C) 2+.
D) -.
E) 2-.
219. Комплекстүзушінің тотығу дәрежесі +4-ке тең [Pt (NH3 )4(CN)4] x комплексті ионының заряды:
A) 0.
B) 1+.
C) 2+.
D) 1-.
E) 2-.
220.
[Co(NH3)5Br] SO4
комплексті қосылысындағы комплекстүзуші
ионның тотығу дәрежесі:
SO4
комплексті қосылысындағы комплекстүзуші
ионның тотығу дәрежесі:
A) +2.
B) -2.
C) +3.
D) -5.
E) -3.
221.
K3[Fe(C2O4)3]қосылысындағы
 комплексіндегі комплекс түзушісінің
кординациялық саны:
комплексіндегі комплекс түзушісінің
кординациялық саны:
A) 0.
B) 2.
C) 3.
D) 5.
E) 6.
222. [Cu(NH3)4 ]SO4 комплексіндегі комплекс түзушісінің кординациялық саны және лиганда дентаттылығы :
A) 2; 1.
B) 2; 2.
C) 4; 4.
D) 3; 3.
E) 4; 1.
223.
Cd2+
 ионының мөлшері көп болатын комплексті
ион :
ионының мөлшері көп болатын комплексті
ион :
A)
Kт-сыз
 ([Cd(CN)4]2-
([Cd(CN)4]2- )
= 7,8 ·10-18.
)
= 7,8 ·10-18.
B) Kт-сыз ([Cd(CN)4]2- ) = 2,8 ·10-7.
C) Kт-сыз ([CdCl4]2- ) = 2,0 ·10-2.
D) Kт-сыз ([CdI4]2- ) = 3,0 ·10-6.
E) Kт-сыз ([Cd(N2H4)4]2- ) = 1,3 ·10-4.
224. Орталық ион – комплекстүзушісінің айналасына жиналған лигандалар саны :
A) Ішкі сфера заряды.
B) Комплексті ионының заряды.
C) Координациялық сан.
D) Лиганда заряды.
E) Комплекстүзуші заряды.
225. Тұрақсыздық константасының мәні неғұрлым жоғары болса, соғұрлым:
A) Кешенді қосылыс тұрақсыз.
B) Кешенді қосылыс тұрақты.
C) Реакция тез жүреді.
D) Процесс баяу өтеді.
E) Реакцияға қатыспайды.
226. Комплексті қосылыстың тұрақтылық константасын белгілейді:
A) Ks
B) Ka
C) Kb
D) Kh
E) β.
227. Комплексті қосылыстардың ерітінділеріндегі тепе-теңдікті сипаттайтын шама:
A) Ka.
B) Kb.
C) Ks.
D) S.
E) Kтұр-дық
228. Комплексті қосылыстардың ерітінділеріндегі тепе-теңдікті сипаттайтын шама:
A) Ka
B) Kb
C) Ks
D) Kh
E)
 .
.
229. Тұрақты комплексті ион:
A) КТ[Cd(CN)4]2- = 7,66*10-18.
B) КТ[Ag (CN)2]- = 1,0*10-21.
C) КТ[Cu (CN)2]- = 1,0*10-24.
D) КТ[Ni (CN)4]2- = 1,0*10-22.
E) КТ[Fe (CN)6]3- = 1,0*10-31.
230. [Ag(NH3)2]Cl қосылысының тұрақтылық константасының өрнегі :
A)
β
=
 .
.
B)
β
=
 .
.
C)
β =
[Ag(NH3)2]+
/ [Ag+]2
* [NH3]2
=
[Ag(NH3)2]+
/ [Ag+]2
* [NH3]2
 .
.
D)
β
=[
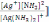 .
.
E)
β
=
 .
.
231. Комплексті қосылыстардың ішкі және сыртқы сфераларының арасындағы байланыс:
A) Иондық.
B) Сутектік.
C) Металдық.
D) Донорлы-акцепторлы.
E) Молекулалық.
232. Ішкі сферадағы комплекстүзуші мен лиганда арасындағы байланыс :
A) Металдық.
B) Иондық.
C) Полярсыз ковалентті.
D) Сутектік.
E) Донорлы-акцепторлы.
233. NH4SCN ерітіндісіне концентрациясы 0,01 моль/л келесі тұздар ерітінділерін қосқанда темір тиоцианатының қызыл түсті бояуы пайда болмайды:
A) K3[Fe(PO4)2].
B) FeCl3.
C) KFe(SO4)2·12H2O.
D) Fe2(SO4)3.
E) Fe(NO3)3.
234. [Ag(NH3)2]+ комплексті ионын бұзуға пайдаланылатын қосылыс:
A) NaI; Ks(AgI) = 1,0 · 10-16.
B) NaCl; Ks (AgCl)=1,6·10-10.
C) NaBr; Ks (AgBr)=7,0·10-13.
D) NaSCN; Ks (AgSCN)=1,0·10-12.
E) NaOH; Ks (AgOH)=2,0·10-8.
235. Комплекстүзу реакциясын химиялық анализде пайдаланылмайтын жағдай:
A) Нашар еритін тұнбаларды ерітуде.
B) Иондарды бүркеуде.
C) Иондарды ашуда.
D) Қосылыстардың тотығу-тотықсыздану қасиеттерін өзгертуге.
E) Ерітінді рН-ын анықтауда.
236. Аммиакаттардың ыдырауына себеп болатын жағдай:
A) Қыздыру.
B) Сұйылту.
C) Аммиактың артық мөлшерiн қосу.
D) Тотықтыру.
E) Тотықсыздандыру.
237. Комплекстүзуші реагентті қосқанда комплексті ионның электролиттік диссоциациясы:
A) Кемиді.
B) Кемидi содан соң артады.
C) Артады.
D) Артады содан соң кемидi.
E) Өзгермейдi.
238. Иминодисірке қышқылының НООС-СН2-NН- СН2-СООН дентаттылығы:
A) Тридентатты.
B) Монодентатты.
C) Тетрадентатты.
D) Бидентатты.
E) Гексадентатты.
239. Комплекс түзуші реакция арқылы ерітіндіге өткізуге болмайтын тұнба:
A) KS(AgBrO3) = 5.5*10-10.
B) KS (AgCl) = 1.78*10-10 .
C) KS (AgBr) = 5.3*10-13 .
D) KS (AgI) = 8.3*10-17 .
E) KS (Ag2S) = 6, 03*10-50 .
240. Комплекс түзуші реакция арқылы оңай ерітіндіге өткізуге болатын тұнба:
A) KS(AgBrO3) = 5.5*10-10.
B) KS (AgCl) = 1.78*10-11 .
C) KS (AgBr) = 5.3*10-13 .
D) KS (AgI) = 8.3*10-17 .
E) KS (Ag2S) = 603*10-50 .
241. [Cu(NH3)2(SCN)2] комплексті қосылысының дұрыс аталуы:
A) Дитиоцианатодиаммин мыс(ІІ).
B) Мыс тиоцианатоаммиакаты.
C) Мыс тиоцианатоаммині.
D) Тиоцианатоамминкупраты.
E) Мыс тиоцианатодиаммині.
Тотығу-тотықсыздану тепе-теңдігі
242. Стандартты тотығу-тотықсыздану жұбының потенциалына сәйкес келетін жағдай:
A) Т > 298 К.
B) Т < 293 К.
C) n > 1.
D) [Ox] = [Red] = 1.
E) [Red] < 1.
243. Әлсіз тотықсыздандырғыш қасиет көрсететін қосылыс және оған сәйкес жұп:
A) (NH4)2S2O8 , φo (S2O82- / 2SO42-) = +2,01 В.
B) KIO4, φo (IO4-/I3-)=+1,28 B.
C) O20 , φo(O2/H2O2)=+0,69 B.
D) Br2o, φo(Br2/2Br-)=+1,09 B.
E) KMnO4, φo(MnO4-/Mn2+)=+1,51B.
244. Күшті тотықтырғыш қасиет көрсететін қосылыс және оған сәйкес жұп:
A) KBr, φo (Br2 / 2Br-) = +1,09 В.
B) SnСl2, φo(Sn4+/Sn2+) = + 0,15 B.
C) H2O2, φo(O2/H2O2) = + 0,69 B.
D) CrСl2, φo(Cr3+/Cr2+) = - 0,41 B.
E) Na2S2O3 , φo(S4O62-/2S2O32-) = + 0,09 B.
245.
Стандартты электродтық потенциалы
φ0 (MnO4
-/Mn2+)
= +1,29 В және тотыққан,
(MnO4
-/Mn2+)
= +1,29 В және тотыққан,
тотықсызданған түрлерінің концентрациялары 1моль/л тең , рН=1 болатын MnO4-/ Mn2+ жұбының потенциалының мәні:
A) -1,29 В.
B) - 1,408 В.
C) +1,172 В.
D) +1,231 В.
E) +1,349 В.
246. [Fe3+] / [Fe2+] жұбы төмендегі қай қатынасқа тең болғанда редокс жұбының потенциалы стандарттан кіші болады (φ°( (Fe3+/Fe2+) < φ°(Fe3+/Fe2+)):
A) 1:10.
B) 1:1.
C) 10:1.
D) 5:2.
E) 5:5.
247. [Fe3+] / [Fe2+] жұбы төмендегі қай қатынасқа тең болғанда редокс жұбының потенциалы стандарттан үлкен болады (φ°( (Fe3+/Fe2+) < φ°(Fe3+/Fe2+)):
A) 1:10.
B) 1:1.
C) 10 : 1.
D) 5:2.
E) 5:5.
248. Ерітіндінің рН мәнінің өзгеруі қай редокс жұбының потенциалына әсер етпейді:
A) I2/2I-.
B) NO3-/NO2-.
C) AsO43-/AsO33-.
D) SO42-/H2S.
E) 2IO3-/I2.
249. Стандартты жағдайда (рН = 1 және Т = 298 К) сутек электродының потенциалы:
A) +0,00 В.
B) +0,029 В.
C) -0,029 В.
D) -0,058 В.
E) +0,058 В.
250. Ерітінді рН мәнінің өзгеруі потенциалына әсер етпейтін редокс жұбтары:
A) J20 / 2J-, Fe3+ / Fe2+.
B) NO3- / NO, Cr2O72- / 2Cr3+.
C) Cr2O72- / 2Cr3+, Fe3+ / Fe2+.
D) NO3- / NO, J20 / 2J-.
E) SO32- / H2S, NO3- / NO.
251. Тотықтырғыш KMnO4 –тың күшті қышқылдық ортада тотықсыздану реакциясы және оған
сәйкес редокс потенциалы:
A) MnO4- + 8H+ +5e → Mn2+ + 4H2O, φ0 = +1,51B.
B) MnO4- + 4H+ + 3e- →MnO20 + 2H2O, φ° = +1,69 B.
C) MnO4- + 2H+ + 3e- → MnO20 + 4OH-, φ° = + 0,59 B.
D) MnO4- + 4OH- + e- → MnO42- + 2H2O + O20, φ° = + 0,58 B.
E) MnO4- - e- → Mn0 + 2O20, φ°= +1,18 B.
252.
Стандартты редокс потенциалдары φ°
(BrO3-/Br-)
= + 1,45 B және φ°
(Br20/2Br- )
= + 1,09 B
)
= + 1,09 B
тең болған жүйедегі ЭҚК :
A) +0,36 В.
B) +1,58 В.
C) +1,33 В.
D) +0,75 В.
E) +2,54 В.
253. Стандартты электродтық потенциалары φ° (MnO4 -/Mn2+) = +1,51 B және
[MnO4-] [Mn2+] = 1моль/л, рН = 5 тең болатын MnO4-/ Mn2+ жұбы үшін потенциалдың мәні:
A) + 1,569 В.
B) + 1,451В.
C) +1,038 В.
D) -1В.
E) -10-5 В.
254. Стандартты редокс потенциалдары φ°(BrO3-/Br-) = +1,42 B және φ°(Br20/2Br-) = +1,09 B тең
жүйеде BrO3- + 5Br- + 6H+ → 3 Br20 + 3H2O реакциясы:
A) Солдан оңға қарай жүреді. +
B) Оңнан солға қарай жүредi.
C) Реакция жүруi мүмкiн емес.
D) Редокс потенциалы ешқандай мәлiмет бермейдi.
E) Тепе-теңдiкте болады.
255. Электронды иондық теңдеуге Cr2O72- + 14H+ + 6e → 2Cr3+ +7H2O сәйкес өрнектелген
Нернст теңдеуі:
A) φ = φ° + 0, 059/6 lg[Cr3+]2/[Cr2O72-] [H+]14.
B) φ = φ° + 0, 059/6 lg[Cr2O72-] [H+]14/ [Cr3+]2.
C) φ = φ° + 0, 059/14 lg [Cr2O72-] [H+]6/ [Cr3+]2.
D) φ = φ° + 0, 059/14 lg[Cr3+]2/ [Cr2O72-] [H+]6.
E) φ° = E - 0, 059/6 lg[Cr2O72-] [H+]14/ [Cr3+]2.
256. Стандартты редокс потенциалдары φ°(Sn4+/Sn2+) = + 0,15 B, φ°(Hg2+/Hg0) = + 0,854 B тең.
жүйенің электрқозғаушы күші:
A) + 0,704 B.
B) + 1,004 В.
C) - 0,704 В.
D) - 1,004 В.
E) + 1,00 В.
257. Ең күшті тотықтырғыш:
A) φ0 (Ag+/ Ag) = + 0,79 В.
B) φ0 (Zn4+ /Zn2+) = + 0,15 В.
C) φ0 (S2О82-/ SО42-) = +2,05 В.
D) φ0 (PbО2 /Pb2+) = +1,45 В.
E) φ0 (Fe3+/ Fe2+) = + 0,74 В.
258. Тепе-теңдік константасының үлкен мәні тотығу-тотықсыздану реакциясының:
A) Тепе-теңдігі оңға ығысқан және реакция іс жүзінде аяғына дейін жүреді.
B) Тепе-теңдік солға ығысқан және реакция іс жүзінде аяғына дейін жүрмейді.
C) Реакция жүрмейді.
D) Реакция өте тез жүреді.
E) Реакция өте баяу жүреді.
359. Тотығу-тотықсыздану потенциалының мәніне сутегі ионы максимал әсер ететін
жартылай реакция:
A) Mn2+ + 2H2O - 2ē → MnO2 + 4H+.
B)
Mn2+
+ 2H2O
- 5ē
→ MnO4- + 8H+.
+ 8H+.
C)
MnO2
+
 2H2O
- 3ē → MnO4-
+ 4H+.
2H2O
- 3ē → MnO4-
+ 4H+.
D) MnO2 + 4OH- - 2ē → MnO42- + 2H2O.
E)
MnO42-
- ē  → MnO4-.
→ MnO4-.
260. Тотығу-тотықсыздану потенциалы мәніне сутегі ионы максималды әсер ететін жартылай
реакция :
A)
Cr2+
+
2ē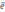 → Cro.
→ Cro.
B) Cr3+ + 3ē → Cro.
C) Cr3+ + ē → Cr2+.
D) CrO42- + 4H2O + 3ē → Cr(OH)3 + 5OH-.
E) Cr2O72- + 14H+ + 6ē → Cr3+ + 7H2O.
261. Экстракцияны аналитикалық химияда пайдаланады:
A) Қоспа түрiнде болатын аз мөлшердегi металдарды концентрлеуге.
B) Тек металдарды бөлуге.
C) Тек маталл ионының концентрациясын анықтауға.
D) Металдарды бөліп алуға, концентрлеуге және ондағы иондарды анықтауға.
E) Қоспа түрiнде болатын иондарды бөлуге.
262. Компоненттің сулы фазадан органикалық фазаға толық өтуін сандық сипаттайтын шама:
A) Таралу коэфиценті.
B) Иондану дәрежесі.
С) Гидролиздену дәрежесі.
D) Изотонды коэффициент.
E) Изотондық коэффициент.
Сапалық талдау
263. Қыздырғанда түссіз газ беретін ион:
A) CO32-.
B) NO3-.
C) NO2-.
D) J-.
E) Br-.
264. Темір (III) ионымен қызыл түсті ерітінді түзетін, ал түзілген ерітіндіні сумен қыздырғанда қоңыр тұнба беретін анион:
A) Ацетат.
B) Хлорид.
C) Сульфат.
D) Сульфид.
E) Карбонат.
265. Ерітіндідегі Ag+, Zn2+, Cu2+, Ni2+, Co2+ иондар қоспасына HCl ертіндісін қосқанда тұнбаға түсетін ион:
A) Ag+.
B) Zn2+.
C) Cu2+.
D) Ni2+.
E) Co2+.
266. Ертіндідегі Al3+, Zn2+, Cr3+, Fe3+, Sn4+ иондар қоспасына NaOH ертіндісінің артық мөлшерін қосқанда тұнбаға түсетін катион:
A) Al3+.
B) Zn2+.
C) Cr3+.
D) Fe3+.
E) Sn4+.
267. Ертіндідегі Al3+, Zn2+, Cr3+, Fe3+, Ва2+, Na+ иондар қоспасына K2CrO4 ертіндісінің артық мөлшерін қосқанда тұнбаға түспейтін катион:
А) Al3+.
B) Zn2+.
C) Cr3+.
D) Fe3+.
E) Na+.
268. Ертіндідегі Al3+, Zn2+, Cr3+, Hg2+, Ba2+ иондар қоспасына KJ ертіндісінің артық мөлшері косылғанда комплекс түзетін катион:
A) Al3+.
B) Zn2+.
C) Cr3+.
D) Hg2+.
E) Ba2+.
269. Қызыл қан тұзының ионы:
A) [Fe(CN)6]3-.
B) [Fe(CN)6]4-.
C) [HgJ4]2-.
D) ClO3-.
E) NO2-.
270. Алюминий, мыс және мырыш тұздарының ерітінділерінің қоспасына аммикатың артық мөлшерін қосқанда тұнбаға түседі:
A) Al(OH)3; Cu(OH)2; Zn(OH)2.
B) Cu(OH)2; Zn(OH)2.
C) Zn(OH)2.
D) Al(OH)3.
E) Cu(OH)2.
271. Калий ионынмен микрокристаллоскопиялық реакция беретін реактив:
A) Na3[Co(NO2) 6].
B) Na2Pb[Cu(NO2)6].
C) K2[HgJ4].
D) NaHC4H4O6.
E) CH3COOН.
272. Калийдің ұшқыш тұздарынан жалын түсі боялады:
A) Қызыл.
B) Жасыл.
C) Күлгін.
D) Көгілдір.
E) Кармин-қызыл.
273. Калий бромидінің күміс нитратымен әрекеттесуінен түзілген қосылыс жақсы ериді:
A) HNO3.
B) NH4OH.
C) (NH4)2CO3.
D) Na2S2O3.
E) K2СО3.
274. Барий, стронций және кальций иондары бар ерітіндіге күкірт қышқылын қосқанда бірінші түзлетін тұнба:
A) Барий сульфаты.
B) Стронций сульфаты.
C) Кальций сульфаты.
D) Барлық тұнба бір мезгілде түзіледі.
E) Тұнбалар мүлде түзілмейді.
275. Тиосульфат-ионы жататын аниондар тобы:
A) Бірінші.
B) Екінші.
C) Үшінші.
D) Төртінші.
E) Бесінші.
276. Фосфат – ионының магнезиальды қоспамен реакция нәтижесінде түзілетін қосылыс.
A) Mg(OH)2 .
B) MgHPO4 .
C) Mg3(PO4)2.
D) MgNH4PO4.
E) MgCI2.
277. NH4OH және NH4Cl қатысында натрий гидрофосфатының магний тұздарымен түзетін ақ кристалды тұнба:
A) MgNH4PO4.
B) MgHPO4.
C) Mg3(PO4)2.
D) Mg(OH)2.
E) MgCI2.
278. Қышқыл орадағы калий броматы мен натрий иодиді реакциясының өнімі:
A) Бос иод.
B) Натрий бормиді.
C) Иод (IV) қосылысы.
D) Бром (IV) қосылысы.
E) Иод (V) қосылысы.
279. Марганец сульфатының күкірт қышқылы ерітіндісі қатысында бромат ионымен реакциясы нәтижесінде түзіледі:
A) Марганец тетрабромиді.
B) Mарганец хлориді.
C) Mарганцат пентабромиді.
D) Mарганец бромиді.
E) Mарганец (IV) сульфаты.
280. Мырыштың әсерінен сілтілік ортада нитраттар:
A) Нитратқа тотығады.
B) Аммиакқа дейін тотықсызданады.
C) Азот (IY) оксидіне дейін тотықсызданады.
D) Азот (IІ) оксидіне дейін тотықсызданады.
E) Азотқа дейін тотықсызданады.
281. Нитрат ионын ашатын реакциядағы органикалық реагент:
A) Дифениламин.
B) Ализарин.
C) Алюминий.
D) Диметилглиоксим.
E) Оксихинолин.
282. Күміс галогенидінің аммимактағы ерітіндісін қышқылдандырғанда қайтадан күміс галогениді тұнбаға түседі. Бұл реакцияны ашуға қолданады:
A) AgCl.
B) AgBr.
C) AgI.
D) Барлық галогенидтерге тән реакция.
E) Тек бірнешеуіне тән реакция.
283. Фосфат ионының бейтарап ортада барий тұзымен реакциясының өнімі:
A) BaHPO4.
B) Ba3 (PO4)2.
C) Ba (H2PO4)2.
D) Ba (OH)2.
E) BaOHPO4.
284. Марганец сульфатымен күкірт қышқылы қатысында қызыл түс беретін ион:
A) IO3-.
B) BrO3-.
C) Br-.
D) I-.
E) I2.
285. Күміс тиоцианаты ериді:
A) HNO3.
B) (NH4)2CO3.
C) KCN.
D) Na2SO4.
E) Na2СО3.
286. Тиоцианат ионын ашатын реактив:
A) Темір (III) қосылысы.
B) Қалайы (II) қосылысы.
C) Висмут (III) қосылысы.
D) Марганец (II) қосылысы.
E) Магний қосылысы.
287. I-, Cl- иондары бар қоспаға 2н. HNO3 қатысында AgNO3 қосқанда:
A) Газ бөлінеді.
B) Тұнба түзіледі.
C) Тұнба түзілмейді.
D) Хлор түзіледі.
E) Иод түзіледі.
288. Барлық аналитикалық топ катиондары ертіндісіне натрий гидроксидінің артық мөлшерін қосқанда тұнбаға түсетін катиондар тобы:
A) I,II,III.
B) II,III,IV.
C) III,IV,V.
D) V,VI.
E) IV,V,I.
289. IV,V,VI топ гидроксидтері ерітінділеріне концентрлі аммиак ерітіндісімен әсер еткенде ерітінідіге өтетін катиондар тобы:
A) II.
B) VI.
C) IV.
D) V.
E) III.
290. Калий ионын Na3 [Co(NO2)6] реактивімен ашуда кедергі келтіретін реагент:
A) H2O.
B) Na2SO4.
C) NH4Cl.
D) NaCl.
E) NaNO3.
291. Cu2+ ионын қышқылдық ортада Cd2+ ионынан бөлетін реагент:
A) NH3.
B) KCN.
C) Na2S2O3.
D) HCl.
E) NaOH.
292. NH4OH-тың артық мөлшерінде ерімейтін күмістің тұзы:
A) Ag3AsO4.
B) AgCl.
C) AgI.
D) AgCNS.
E) AgF.
293. CaSO4 тұнбасы еритін реагент:
A) CH3COOH.
B) NaOH.
C) С2H5OH.
D) (NH4)2SO4.
E) NH4OH.
294. Темірдің (III) ионын NH4CNS-пен ашатын реакцияға ашуға кедергі келтіретін ион:
A) Со2+.
B) K+.
C) Na+.
D) NH4+.
E) Fe2+.
295. (NH4)2SO4 етріндісінің артық мөлшерінен суда еритін комплекс беретін ион:
A) Ca2+.
B) Pb2+.
C) Sr2+.
D) Ba2+.
E) Hg22+.
296. II топ катиондары хлоридтері және III топ катиондары сульфаттарының ертіндісі ыстық суда өңдегенде ерітіндіге көшетін катион:
A) Ag+.
B) Pb2+.
C) Sr2+.
D) Ca2+.
E) Ba2+.
297. AgCl тұнбасын Hg2Cl2 тұнбасынан бөлетін реактив:
A) HNO3.
B) HCl.
C) NaOH.
D) NH4OH.
E) Ыстық су.
398. Ca2+ ионын Ba2+ ионынан бөледі:
A) Құмырсқа қышқылының еритін тұздары.
B) Калий хроматы.
C) Алдымен құмырсқа қышқылымен, кейін калий дихроматы.
D) Калий дихроматы (рН = 5).
E) Са2+ және Ba2+ бірге анықталмайды.
299. Ba2+, Sr2+, Ca2+ иондарын Cr3+, Al3+ иондарынан бөлетін топтық реагент:
A) H2SO4.
B) NaOH.
C) Na2HPO4.
D) Na2CO3.
E) HCl.
300. Ag+, Hg2+, Pb2+ иондарын Sn2+, As5+ иондарынан бөлетін топтық реагент:
A) H2SO4.
B) NaOH.
C) Na2HPO4.
D) Na2CO3.
E) HCl.
301. K2[HgJ4] реактивіне сезгіш ион:
A) Na+.
B) NH4+.
C) Mg2+.
D) K+.
E) Ca2+.
302. Сірке қышқылында да, тұз қышқылында да ерімейтін фосфат:
A) FePO4.
B) Ag3PO4.
C) BiPO4.
D) CrPO4.
E) AlPO4.
303. Жүйелік талдауда барий ионын калий дихроматымен K2Cr2O7 бөлетін және ашатын буферлік жүйе:
A) Na2HPO4 + NH2PO4.
B) CH3COOH + CH3COONa.
C) HCOOH + HCOONa.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
304. Магний ионын натрий гидрофосфатымен ашуда қолданатын буферлік жүйе:
A) Na2HPO4 + NaH2PO4.
B) CH3COOH + CH3CONa.
C) HCOOH +HCOONa.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
305. AgCl тұнбасын AgI тұнбасынан бөлу үшін өңдейтін ерітінді:
A) KCl.
B) HNO3.
C) NH4NO3.
D) HCl.
E) (NH4)2CO3.
306. Қорғасын ионын висмут ионы қатысында ашатын реактив:
A) NH4OH.
B) (NH4)2CO3.
C) Na2S2O3.
D) Na2HPO4.
E) H2SO4.
307. Кобальт және никель сульфиттерін еріту үшін қолданатын реактив:
A) H2SO4.
B) NaOH.
C) (NH4)2S.
D) HCl + H2O2.
E) H2O.
308. Хромит ерітінділерінен хром (IIІ) катионының тұзын алу үшін қосады:
A) Сілті.
B) Қышқыл.
C) Су.
D) Сода.
E) Аммиак.
309. Мырыш, қалайы және кадмий тұздары ерітінділері қоспасына KOH ерітіндісінің артық мөлшерін қосқанда тұнбаға түседі:
A) Zn(OH)2.
B) Sn(OH)2.
C) Барлық иондар тұнбаға бірге түседі.
D) Cd(OH)2.
E) Тұнбаға түспейді.
310. Алюминий, мыс және мырыш тұздары ерітінділері қоспасына аммиак ерітіндісінің артық мөлшерін қосқанда тұнбаға түседі:
A) Al(OH)3, Cu(OH)2.
B) Cu(OH)2, Zn(OH)2.
C) Al(OH)3.
D) Zn(OH)2.
E) Тұнбаға түспейді.
311. Барий, қорғасын және кальций тұздары ерітінділері қоспасына аммоний сульфаты ерітіндісінің артық мөлшерін қосқанда тұнбаға түседі:
A) PbSO4, BaSO4, CaSO4.
B) BaSO4.
C) PbSO4, BaSO4.
D) BaSO4, CaSO4.
E) PbSO4.
312. Мышьяк (III) және сурьма (III) сульфидтерін еріту үшін қолданатын реактив:
A) CH3COOH.
B) (NH4)2Sx.
C) (NH4)2CO3.
D) (NH4)2S.
E) H2S.
313. Ag2S тұнбасын ерітетін реактив:
A) HCl.
B) Na2S.
C) NaOH.
D) KCN.
E) H2SO4.
314. Қорғасын мен барий сульфаттарын бөлу үшін қолданатын реагент:
A) HCl.
B) NH4Cl.
C) CH3COONH4.
D) NH4OH.
E) NaOH.
315. MnO(OH)2 тұнбасы еру себебі :
A) Сұйытылған Н2SО4 әсерінен Мn(IV)→ Мn(VII) ауысуы.
B) Концентрлі CH3COOH әсерінен жақсы еритін Mn(CH3CОО)2 түзілуі.
C) 0,2 м HNO3 ерітіндісі әсерінен Мn(IV) → Мn(VII) ауысуы.
D) Сұйытылған CH3COOH әсерінен Мn (IV) → Мn(VII) ауысуы.
E) Қыздыру барысында 6м HCl әсерінен Мn (IV) → Мn(II) ауысуы.
316. Қышқылдық-негіздік талдау бойынша катиондарды VІ аналитикалық топқа біріктіру негізделген:
A) Гидроксидтерінің NaOH-тың артық мөлшерінде ерімеуіне.
B) Сульфидтерінің сірке қышқылында ерімеуіне.
C) Гидроксидтерінің NaOH-тың артық мөлшерінде еруіне.
D) Сульфидтерінің NaOH-тың артық мөлшерінде ерімеуіне.
E) Гидроксидтерінің концентрлі NH4OH-тың артық мөлшерінде еруіне.
317. Аммиакат қоспасынан Cu2+ ионын Cd2+ионынан бөлу үшін қолданатын реагент:
A) NH3.
B) KCN.
C) Н2SO4 + Na2S2O3.
D) HCl.
E) NaOH.
318. Аниондар SO42-, S2O32-, PO43- қоспасынан SO42- бөлу үшін өңдейді:
A) Барий тұздарымен.
B) Стронций тұздарымен.
C) Барий тұзы қосылғаннан соң алынған тұнбаны HCl-мен өңдейді.
D) Мырышпен қышқыл ортада SO2-ге тотықсыздандырады.
E) Кальций тұздарымен.
319. Hg2(NO3)2 ерітіндісіне SnCl2 реагентін қосқанда түзілетін өнімдер:
A) HgCl2+Sn0.
B) Hg0+SnCl4.
C) HgCl2+Sn(NO3)2.
D) Hg2Cl2+Sn0.
E) Hg0+Sn0.
320. Судағы ерігіштігін төмендету үшін ерітіндіден этил спирті қатысында күкірт қышқылымен тұндыратын сульфат:
A) SrSO4.
B) PbSO4.
C) CaSO4.
D) Ag2SO4.
E) BaSO4.
321. Ag2S пен HNO3 әрекеттескенде түзіледі:
A) AgNO3+ S+ NO.
B) Ag0+ S.
C) Ag2SO4+ NO.
D) Ag0 + S0 + NO2.
E) AgNO3 + S.
322. Al3+ ионымен ашық қызыл түсті қосылыс түзетін реактив:
A) Ализарин .
B) Несслер реактиві.
C) Дитизон.
D) Тиомочевина.
E) Бензидин.
323. Fe2S3+HCI =... реакция нәтижесінде түзіледі:
A) Fe2+.
B) S0.
C) H2SО4.
D) FeCI3.
E) H2O.
324. Ринман жасылының формуласы:
A) Na2 ZnO2.
B) NaAlO2.
C) CoZnO2.
D) Na2SnO2.
E) Na2 SnO3.
325 Тенар көгінің формуласы:
A) Na2ZnO2.
B) NaAlO2.
C) Na2SnO2.
D) Na2SnO3.
E) Co(AlO2)2.
326. Тиотұз қосылысының формуласы:
A) H2S.
B) SnS.
C) SnS2.
D) (NH4)2S.
E) (NH4)2SnS3.
327. Металл катиондарымен тұз түзетін бордың қосылысы:
A) Метабор қышқылы.
B) Бор қышқылы.
C) Бор (ІІ) оксиді.
D) Бор.
E) Бор (ІІІ) оксиді.
328. Спирттермен күрделі эфир түзеді:
A) Тетрабор қышқылы.
B) Бор қышқылы.
C) Метабор қышқылы.
D) Бор.
E) Бор (ІІІ) оксиді.
329. Бор қышқылының күрделі эфирінен жалын түсі боялады:
A) Жасыл.
B) Қызыл.
C) Сары.
D) Көк.
E) Қошқыл қызыл.
330. Күкіртсутектік жіктеу бойынша аналитикалық топтардың саны:
A) 3.
B) 4.
C) 5.
D) 6.
E) 7.
331. Аммиак-фосфатты жіктеу бойынша аналитикалық топтардың саны:
A) 4.
B) 5.
C) 6.
D) 7.
E) 8.
332. Алғашқы байқауда Fe (III) иондарын ашатын реактив:
A) Na3[Co(NO2)6.
B) NH4OH.
C) Na2S2O3.
D) K4[Fe(CN)6].
E) K3[Fe(CN)6].
333. VI аналитикалық топтың катиондарымен негіздік тұз түзетін реактив: A) Na2SO4.
B) NH4OH(конц).
C) NaOH.
D) NaH2PO4.
E) H2S.
334. Кадмийдің сары түсті косылысы:
A) Cd(OH)2.
B) [Cd(NH3)4]Cl2.
C) (CdOH)2CO3.
C) CdHPO4.
E) CdS.
335. Сынап тұзының түссіз ерітіндісі:
A) HgO.
B) [Hg(NH3)4]2+.
C) (HgOH)2CO3.
D) Hg3(PO4)2.
E) HgS.
336. Жүйелік талдауда никель ионын ашатын реактив:
A) Ильинский.
B) Чугаев.
C) Ринман.
D) Фишер.
E) Тенаров.
337. Жүйелік талдау бойынша кобальт ионын ашатын реактив:
A) Ринман.
B) Чугаев.
C) Ильинский.
D) Фишер.
E) Тенаров.
338. Хлорид хромил қосылысының формуласы:
A) CrCl3.
B) CrCl2.
C) CrO2Cl2.
D) Na2CrO4.
E) Na2Cr2O7.
339. Нитрит ионының металдық мыспен тотықсыздану реакциясы нәтижесінде түзіледі:
A) NH3 .
B) NO.
C) N2O.
D) N2O5.
E) N2O3.
340. Сірке қышқылының көмегімен анықтайтын ион:
A) SО42-.
B) J-.
C) NО3-.
D) СО32-.
E) СI-.
341. Топтық реагенттің Sb5+ ионымен әрекеттесуінен түзілетін қосылыс:
A) Sb2O3.
B) Sb2O5.
C) Sb(OH)5.
D) Sb(OH)3.
E) Na3SbO3.
342. Sb3+ ионының Н2О2 қатысында топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) Sb2O3.
B) Sb2O5.
C) Sb(OH)3.
D) SbO(OH)3.
E) Na3SbO3.
343. AI3+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) AI(OH)3.
B) AI2O3.
C) NaAIO2.
D) HAIO2.
Е) КAIO2
344. Cr3+ ионының Н2О2 қатысында топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) Cr2O3.
B) (CrOH)3.
C) Na2CrO4.
D) NaCrO2.
E) Na2Cr2O7.
345. Zn2+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) ZnO.
B) Zn(OH)2.
C) H2ZnO2.
D) Na2ZnO2.
E) ZnCI2.
346. Sn4+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) SnO.
B) SnO2.
C) Na2SnO2.
D) SnO(OH)2.
E) Na2SnO3.
347. Sn2+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) SnO
B) SnO2.
C) Na2SnO2.
D) SnO(OH)2.
E) Na2SnO3.
348. Mn2+ ионының Н2О2 қатысында топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) MnO
B) n(OH)2.
C) MnO(OH)2.
D) HMnO4.
E) MnCI2.
349. Hg2+ ионының Н2О2 қатысында NaOH-пен әрекеттесуінен түзілетін қосылыс:
A) HgO.
B) Hg(OH)2.
C) HgCI2.
D) HgSO4.
E) Hg(NO)3.
350. Топ реагентінің Co2+ ионымен әрекеттесуінен түзілетін қосылыс:
A) [Cо(NH3)6]2+.
B) Co(OH)2.
C) CoO.
D) Co(OH)3.
E) CoSO4.
351. Топ реагентінің Hg2+ ионымен әрекеттесуінен түзілетін қосылыс:
A) Hg(OH)2.
B) HgO.
C) HgNO3.
D) HgSO4.
E) [Hg(NH3)4]2+.
352. Сілтілік ортада Н2О2 қатысында тотықтырғанда ең жоғарғы тотығу дәрежесіне ие болатын иондар:
A) Al3+, Mg2+
B) Zn2+, Al3+.
C) Mg2+, Zn2+.
D) Sr2+, Mg2+
E) Sb3+, Co2+.
353. Pb2+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) PbO.
B) Pb(OH)2.
C) Na2PbO2.
D) PbCI2.
E) Pb(NO3)2.
354. Hg22+ ионының топ реагентімен әрекеттесуінен түзілетін қосылыс:
A) HgO.
B) Hg2(OH)2.
C) Hg(NO3)2.
D) Hg2CI2.
E) HgSO4.
355. Аммиакатты комплексті қосылыс түзетін катиондар:
A) Na+, Ca2+, Zn2+.
B) K+, Ba2+, Zn2+.
C) Ag+, Cd2+, Cu2+.
D) Ca2+, K+, Cu2+.
E) Ba2+, Na+, Cd2+.
356. Аммиакатты комплексті қосылыс түзетін иондар:
A) Na+, Ni2+, AI3+.
B) Co2+, Ni2+, Hg2+.
C) AI3+, Ca2+, Na+.
D) Ca2+, Na+, Co2+.
E) Sn2+, AI3+, Hg2+.
357.
К4 реактивімен
аммоний буферлік ерітінді қатысында
нашар еритін тұз түзетін катиондар.
реактивімен
аммоний буферлік ерітінді қатысында
нашар еритін тұз түзетін катиондар.
A) NH4+, Na+.
B) Ca2+, Fe3+.
C) Na+, As3+ .
D) K+, NH4+.
E) As3+, AI3+.
358. К4 реактивімен нашар еритiн тұз түзетін катион.
A) NH4+, As5+.
B) As5+, K+.
C) Fe3+, Cd2+.
D) K+, AI3+.
E) As3+, NH4+.
359. Аg+ ионы иодид ионымен түзілген тұнбаның түсі:
A) Ақ.
B) Көк.
C) Жасыл.
D) Сары.
E) Қызыл.
360. Аg+ ионы хромат ионымен түзілген тұнбаның түсі:
A) Ақ.
B) Көк.
C) Жасыл.
D) Сары.
E) Қызыл.
361. Концентрлі аммиак ерітіндісінде еритін тұнбалар:
A) BaSO4., AgJ.
B) SrSO4. , CaSO4
C) CaSO4. , K2SO4
D) AgCI, Cu(OH)2.
E) AgJ, SrSO4
362. Аммиактың концентрлі ерітіндісінде еритін тұнбалар:
A) BaSO4. PbSO4.
B) SrSO4. AgJ.
C) CaSO4. SrSO4.
D) Ni(OH)2. ,Co(OH)2.
E) AgJ BaSO4.
363. Қышқылдық-негіздік жіктелу бойынша Bi3+ және Fe3+ иондары жататын катиондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
D) IV.
E) V.
364. Hg22+ катионын ашатын реактив:
A)
K2 .
.
B)
Na3 .
.
C) SnCI2.
D) KNO3.
E) CH3COOH.
365. Sn2+ катионын ашатын реактив:
A) KCI.
B) KNO3.
C) Hg(NO3)2.
D) CaSO4.
E) CH3COOH.
366. Bi3+ катионын ашатын реактив:
A) KCI.
B) KCNS.
C) H2SO4 + KBiO3.
D) NH4CI.
E) Na2SnO2 + KOH.
367. Sb3+ катионын ашатын реактив:
A) KCI.
B) Sn0 .
C) H2SO4 .
D) NH4CI .
E) Na2SnO3.
368. Катиондар қоспасын талдауда топ реагенті (NН4)2НРО4 болғандағы жіктеу:
A) Қышқылдық-негіздік.
B) Күкіртсутектік.
C) Аммиакты-фосфатты.
D) Сульфидтік.
E) Карбонатты.
369. Катиондар қоспасын талдауда топ реагенті ретінде сілті немесе күкірт, тұз қышқылдары болғандағы жіктеу:
A) Қышқылдық-негіздік.
B) Күкіртсутектік.
C) Аммиакты-фосфатты.
D) Сульфидтік.
E) Карбонатты.
370. КJ реагентімен ашатын катиондар:
A) Ni2+. Co2+.
B) Ba2+. Fe3+.
C) Pb2+. Bi3+.
D) Fe3+. Ni2+.
E) Co2+. Ba2+.
371. Натрий станнитін алу үшін SnCI2-мен әрекеттестіретін реагент:
A) Натрий тиосульфаты.
B) Хлорсутек қышқылы.
C) Күкірт қышқылы.
D) Сілтінің артық мөлшері.
E) Сутек пероксиді қатысында сілтінің артық мөлшері.
372. Натрий арсенатын алу үшін Na3AsO3-пен әрекеттестіретін реагент:
A) Натрий тиосульфаты.
B) Хлорсутек қышқылы.
C) Күкірт қышқылы.
D) Сілтінің артық мөлшері.
E) Сутек пероксиді қатысында сілтінің артық мөлшері.
373. Ортосурьма қышқылын алу үшін SbCI3 қышқылмен әрекеттестіретін реагент:
A) Натрий тиосульфаты.
B) Хлорсутек қышқылы.
C) Күкірт қышқылы.
D) Сілтінің артық мөлшері.
E) Сутек пероксиді қатысында сілтінің артық мөлшері.
374. CNS-, Br-, J-, [Fe(CN6)]-4 иондарына топ реагент:
A) CaCI2.
B) CaCI2 +BaCI2.
C) AgNO3 + HNO3 (сұйық).
D) AgNO3 + HNO3 (конц).
E) AgNO3.
375. SO32-, S2O32-, C2O42-, B4O72-, PO43- иондарына топ реагент:
A) ВaCI2.
B) CaCI2 + BaCI2.
C) AgNO3 + HNO3 (сұйық).
D) AgNO3 + HNO3 (конц).
E) AgNO3.
376. Магнезиальды қоспамен ашатын ион:
A) SO42-.
B) SO32-.
C) S2O32-.
D) CO32-.
E) PO43-.
377. Топ реагенті жоқ анион:
A) SO42-.
B)( SO32-.
C) S2O32-.
D) CO32-.
E) MnO4-.
378. Мышьяктың (V) ионын оның (ІІІ) ионынан бөлу үшін қолданады:
A) AgNO3.
B) NH4OH.
C) HCI + H2S.
D) MgCI2 + NH4OH + NH4CI.
E) KJ.
379. Молибден сұйықтығымен (NH4)2MoO4 + HNO3 ашатын иондар:
A) C2O42-. SO43-.
B) SO32-. CrO42-.
C) PO43-. AsO43-.
D) CrO42-. PO43-.
E) SO43-. AsO43-.
380. Нитрит ионының калий перманганатымен тотыққанда түзілген қосылыстағы азоттың тотығу дәрежесі:
A) -3.
B) 0.
C) + 2.
D) + 4.
E) + 5.
381. CrO42- анионымен сары түс беретін катиондар:
A) K+ , Sn2+
B) Na+ , Zn2+
C) Pb2+ , Ba2+.
D) Zn2+ K+
E) Sn2+ Na+.
382. Иодид –йодат қоспасы:
A) KCI + KJO3.
B) KJ + KJO3.
C) J2 + KJ.
D) J2 +KJO3.
E) J2 +KJO.
383. Нитрат ионын сілтілік ортада тотығу дәрежесі (-3) тең азот қосылысына тотықсыздандыратын металлдар:
A) Ag, Au.
B) Cu, Hg.
C) Hg, Ag.
D) Au, Cu.
E) AI, Mg.
384. Нитрат ионына органикалық реактив:
A) Алюминон.
B) Ализарин.
C) Антипирин.
D) Дифениламин.
E) Ильинский реактиві.
385. Ацетат ионының Fе3+ тұзымен түзетін қосылысының түсі:
A) Жасыл.
B) Көгілдір.
C) Алқызыл.
D) Қара.
E) Сары.
386. Fе(СН3СОО)3 қосылыс қыздырғанда гидролиздену нәтижесінде түзілген қосылыстың түсі:
A) Жасыл.
B) Көгілдір.
C) Қоңыр-қызыл.
D) Қара.
E) Сары.
387. Ізбес суын лайландыратын түссіз, иіссіз газ:
A) SO2 + S.
B) SO2.
C) CO2.
D) NO2.
E) H2S.
388. J2 және КМnO4 түссіздендіретін иісті, түссіз газ:
A) SO2 + S.
B) SO2.
C) CO2.
D) СI2.
E) H2S.
389. Pb2+ тұзының ерітіндісімен дымқылданған, сүзгі қағазын қарайтатын түссіз, жағымсыз иісті газ:
A) SO2 + S.
B) SO2.
C) CO2.
D) СI2.
E) H2S.
390. Қышқылдық-негіздік жіктеу бойынша Zn2+ және Sn2+ иондары жататын катиондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
C) IV.
D) V.
391. Қышқылдық-негіздік жіктеу бойынша Cr3+ және As3+ иондары жататын катиондардың аналитикалық тобы::
A) І.
B) ІІ.
C) ІІІ.
D) IV.
E) V.
392. Қышқылдық-негіздік жіктеу бойынша Pb2+ және Ag+ иондары жататын катиондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
D) IV.
E) V.
393. Қышқылдық-негіздік жіктеу бойынша Mg2+ және Fe2+ иондары жататын катиондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
D) VI.
E) V.
394. Қышқылдық-негіздік жіктеу бойынша Mn2+ және Sb3+ иондары жататын катиондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
D) IV.
E) V.
395. Химиялық талдауды жүргізетін зат:
A) Үлгі.
B) Сынама.
C) Химиялық реагент.
D) Катализатор.
E) Ингибитор.
396. Барийдің және күмістің еритін тұздарын түзетін аниондардың аналитикалық тобы:
A) І.
B) ІІ.
C) ІІІ.
D) IV.
E) V.
397. Ацетат ионы қыздырғанда және сумен сұйылтқанда тұнба түзетін реактив:
A) AgNO3.
B) BaCI2.
C) Pb(NO3)2.
D) FeCI3.
E) FeCI2.
398. НСl-ды қосқанда тұнба беретін ион:
A) CO32-.
B) SO32-.
C) S2O32-.
D) PO43-.
E) Br-.
399. Йод ерітіндісі түссіздендіретін ион:
A) SO42-.
B) NO3-.
C) CH3COO-.
D) AsO33-.
E) PO43-.
400. Тиоцианат ионымен көк түсті қосылыс беретін катион:
A) Zn2+.
B) Fe3+.
C) Ag+.
D) Co2+.
E) Pb2+.
401. Тиоцианат ионымен қызыл түсті қосылыс беретін катион:
A) Zn2+.
B) Fe3+.
C) Ag+.
D) Co2+.
E) Pb2+.
402. Күміс иодиді ериді:
A) NH4OH.
B) NH4)2CO3.
C) HNO3.
D) Na2S2O3.
E) Na2SO3.
403. Ерітіндіге сары түс беретін анион:
A) MnO4-.
B) CH3COO-.
C) JO3-.
D) BrO3-.
E) CrO42- .
404. Күрделі эфир түзетін анион:
A) CO32-.
B) C2O42-.
C) NO2-.
D) AsO43-.
E) CH3COO-.
Гравиметрия
405. Массаны дәл өлшеуге негізделген талдау:
A) Титриметрия.
B) Потенциометрия.
C) Гравиметрия.
D) Амперометрия.
E) Кулонометрия.
406. 2, 5324 г өлшенген массаның дәлдігі :
A) 1.
B) 0,1.
C) 0,01.
D) 0,001.
C) 0,0001.
407. Аморфты тұнба түзілетін жағдайдағы гравиметриялық түрдің массасы (г) болу керек:
A) 0,01.
B) 0,1.
C) 0,5.
D) 1,0.
E) 10,0.
408. Кристалды тұнба түзілетін жағдайдағы гравиметриялық түрдің массасы (г) болу керек:
A) 0,01.
B) 0,1.
C) 0,5.
D) 1,0.
E) 10,0.
409.
Темірді гравиметриялық анықтаудағы
пайдаланылатын аналитикалық көбейткіштің
F(Fe/Fe2O3)=
 = 0,6994 бөліміндегі шама - ол :
= 0,6994 бөліміндегі шама - ол :
A) Анықталатын заттың формуласы.
B) Тұндырушы.
C) Өлшенетін түрі.
D)Тұндырылатын түрі.
E) Сынама формуласы.
410.
Темірді гравиметриялық анықтаудағы
пайдаланылатын аналитикалық көбейткіштің
F(Fe/Fe2O3)=
 = 0,6994 алымындағы шама:
= 0,6994 алымындағы шама:
A) Анықтайтын заттың түр.
B) Тұндырушының түр.
C) Сынама формуласы.
D) Өлшенетін түрі.
E) Тұндырылған түрі.
411. Гравиметриялық талдауда кальцийді оксалат түрінде тұнбаға түсіру үшін қолданылатын қосылыс :
A) K2C2O4.
B) Na2C2O4.
C) H2C2O4.
D) H2C2O4 · 2H2O.
E) (NH4)2 C2O4
412. Гравиметриялық анализде сынама массасын анықтайды:
A) Анализденетін бастапқы заттың сипатымен.
B) Тұнбаға түсіруші реагенттің сипатымен.
C) Тұндырылған түрдің сипатымен.
D) Тұнбаға түсіру кезіндегі ортаның рН-ның мәнімен.
E) Тұнбаны күйдіру температурасымен.
413. Өлшеу барысындағы ауытқу :
A) Өлшенетін шаманың нақты мәнінің өлшенген мәнінен ауытқуы.
B) Абсолютті ауытқудың өлшенетін шаманың нақты мәніне қатынасы.
C) Өлшеу барысындағы ауытқулардың өзгермеуін немесе бір зандылықпен өзгеруі.
D) Өлшеу барысындағы ауытқулардың қайта өлшеуде кездейсоқ өзгеруі.
E) Өрескел қателердің берілген жағдайда болатын қателерден артуы.
414. Өлшеудегі ауытқу немесе қателік:
A) Өлшенетін шаманың нақты мәнінен өлшеу нәтижесінің ауытқуы.
B) Абсолютті ауытқудың орташа мәнге қатынасы.
C) Өлшеу қателігі қайта өлшеу кезінде тұрақты болады немесе белгілі бір зандылықпен өзгереді.
D) Өлшеу қателігінің қайта өлшеу кезінде кездейсоқ өзгеруі.
E) Белгілі жағдайда байқалатын қателіктен артық болатын өрескел қате.
415. Гравиметрияда темірді анықтау нәтижесі дұрыс болады, егер:
A) Аммиакпен тұндыруды бөлме температурасында сұйылтылған ерітіндіде жүргізсе.
B) Аммиакпен тұндыруды сұйылтылған ерітіндіден қыздыру арқылы жүргізсе.
C) Fe(OH)3тұнбасын өз ерітіндісінде тұндыруға қалдырса.
D) Тұндыруды фторид ионының қатысында жүргізсе.
E) Тұнбаны суық сумен жуғанда.
416. Гравиметриялық талдаудың негізіне жатпайтын жағдай :
A) Массаны дәл өлшеу.
B) Концентрациясы жуықтап дайындалған ерітінділерді пайдалану.
C) Реактив ерітіндісінің артық мөлшерде зерттейтін ерітіндіге қосу.
D) Эквивалеттік нүкте анықталмайды.
E) Эквиваленттiк нүкте анықталады.
417. Аналитикалық таразыда өлшеу дәлдігі :
A) 1,0 • 10-1г.
B) 1,0 • 10-5г.
C) 1,0 • 10-2г.
D) 1,0 • 10-4г.
E) 1,0 • 10-3г.
418. Тұнбаға түсіруші реагенттің қосылатын мөлшері артық болу керек :
A) 5 есе.
B) 2 есе.
C) 6 есе.
D)1,5 есе.
E) 0,5 есе.
419. Гравиметрияда тұнбаны жуатын ең ыңғайлы сұйықтық :
A) Айдалған су.
B) Спирт.
C) Аттас иондар бар сұйықтық.
D)Аттас иондар жоқ сұйықтық.
E)Кез келген сұйықтық.
420. Гравиметрияда сүзгі қағазды таңдауда еске алатын жағдай :
A) Өлшенетін сынаманың массасын.
B) Қосылған тұнбаға түсірушінің мөлшерін.
C) Тұнбаның құрылысын.
D) Тұнбаның гравиметриялық түрінін массасын.
E) Жуатын сұйықтық көлемінде.
421. Изоморфизм құбылысының физикалық мәні :
A) Ластайтын зат тұнбаның крисстал торын құруға қатысады.
B) Ластайтын зат тұнбаны ерітеді.
C) Ластайтын зат тұнба бетінде адсорбцияланады.
D) Ластайтын зат тұнбаның құрамына кіреді.
E) Қаныққан затты тұнбаға түсірмейді.
422. Тұнбаға түсіруші реагенттерге қойылатын талаптарды қанағаттандырмайтын шарт:
A) Іс жүзінде ерімейтін тұнба беруі керек.
B) Қыздырылғанда оңай ұшып кетуі тиіс.
C) Гравиметрлік түрінің оңай ауысатын тұндырылған түрін түзуі керек.
D) Ауада құрамы тұрақты болуы тиісті.
E) Қыздырғанда ұшпауы тиісті.
423. Мор тұзының құрамындағы темірді анықтауда тұнбаны қай ионнан жуады.
A) SO42-.
B) NO3-.
C) OH-.
D) Cl-.
E) NH4+.
424. Барий хлоридінен барийді гравиметриялық анықтауда тұнбаны қай ионнан жуады :
A) SO42-.
B) NO3-.
C) OH-.
D) Cl-.
E) NH4+.
425. Магнийді анықтаудағы оның гравиметриялық түрі :
A) MgNH4PO4.
B) Mg2P2O7.
C) Mg(PO3)2.
D) MgH PO4.
E) Жоқ.
426. Кристалл тұнба түзілетін жағдайда сынама өлшендісінің массасын есептейтін қатынас:
A) M(A) · 0,5/ nM(A1).
B) mMA· 0,1/ nM(A)1.
C) nMA1· 0,5/ mM(A1).
D) nMA1· 0,1/ mM(A).
E) M(A1) / M(A)
427. Магнийдың гравиметриялық анықтаудағы оның өлшенетін түрі:
A) MgCl2• 6H2O.
B) MgNH4PO4.
C) Mg2P2O7.
D) Mg(OH)2.
E) MgO.
428. Гравиметриялық талдауды орындағанда коллоид ерітіндісі түзілмеуі үшін талдауды жүргізбейді:
A) Тұндырушы реагенттің артық мөлшерін қосады.
B) Тұндыруды ыстық ерітіндіден жүргізеді.
C) Тұндыру кезінде электролит - коагулятор қосады.
D) Тұнба бетіндегі ерітіндіні сұйылтпайды.
E) Тұндыруды салқын ерiтiндiден жүргiзеді.
429. Бірнеше рет орташа сынаманы алғанда еске алатын принцип :
A) Ұнтақталып, араластырылып дайындалған сынаманың орташа бөлігін алады.
B) Дайындалған үлгінің әр нүктесінен сынама алады.
C) Дайындалған үлгінің шет жағынан орташа сынама аланады.
D) Дайындалған үлгінің тек бір нүктесінен орташа сынама алады.
E) Дайындалған үлгінің шетінің төрт нүктесінен алады.
430. Бірдей жағдайларда адсорбцияланады :
A) Концентрациясы аз ион.
B) Концентрациясы көп ион.
C) Кристалл торына нашар тартылатын ион.
D) Заряды кіші ион.
E) Тордағы иондардан мөлшері кіші ион.
431. Кез келген талдау барысындағы негізгі іс – әрекеттерге жатпайды:
A) Үлгіні алу, орташа үлгіні дайындау.
B) Үлгіні ыдырату.
C) Анықтайтын компонентті бөліп алу.
D) Сынамадан өлшендінің дәл массасын өлшеп алу.
E) ЭҚК-нің шамасын өлшеу.
432. Кез келген талдауда орындайтын негізгі кезеңдерге жатпайды:
A)Өлшендінің нақты массасын өлшеу.
B) Еріту.
C) Сүзу.
D) Өлшенді массасын есептеу.
E) Талдау нәтижесін есептеу.
433. Гравиметриялық талдау әдісіндегі аналитикалық белгі:
A) Зерттейтін ерітінді түсінің қарқындылығы.
B) Реакцияға жұмсалатын ерітінді көлемі.
C) Кептірілген және күйдірілген тұнбаның массасы.
D)Зерттейтін ерітіндінің электрөткізгіштігінің өзгеруі.
E) Тұнба түсiруге жұмсалынған тұндырғыштың мөлшерi.
434. Кальцийді гравиметриялық анықтаудағы оның өлшенетін түрі:
A) CaC2O4.
B) CaO.
C) CaCO3.
D) СаSO4.
E) Са(OH)2.
435. Гравиметриялық анықтауда тұндырылған және өлшенетін түрлері бірдей қосылыстар:
A) CaCO3 , Fe2O3.
B) CaC2O4 , Al(OH)3.
C) Fe2O3 , CaC2O4.
D) Al(OH)3 , CaCO3.
E) BaSO4 , AgCl.
436. Гравиметрия әдісінде тұндырылған түріне қойылатын талаптарға жатпайтын шарт:
A) Тұндырылған формасының ЕК мәнi үлкен болу керек.
B) Тұнбаның ерiгiштiгi төмен болу керек.
C) Ірi кристалды тұнбалар алынуы керек.
D) Тұнбаның құрамы белгілі болуы керек.
E) Тұндырылған түрі оңай және толығымен гравиметриялық түріне өтуi керек.
437. Гравиметрия әдісіне тұндырғышқа қойылатын талап:
A) Молекулалық массасы үлкен болуы керек.
B) Химиялық инерттi болуы керек.
C) Ерiгiштiгi жоғары болуы керек.
D) Ұшқыш болуы керек.
E) Ауада құрамы тұрақсыз болуы керек.
438. Кристалды тұнбалар алу үшін қажет емес жағдай:
A) Тұндыруды сұйытылған ерітінділерден жүргізеді.
B) Тұндырғышты өте баяу, тамшылатып қосады.
C) Ерітіндіні жетілдіру үшін біраз уақытқа қалдырады.
D) Тұндыруды ыстық ерітінділерден жүргізеді.
E)Түзілген тұнбаны бірден сүзеді.
439. Аморфты тұнбалар алу үшін қажет емес жағдай:
A) Тұнбаға түсетін және тұнбаға түсірген иондардың концентрлі ерітінділерін қолданады.
B) Тұндыруды ыстық ерітінділерден жүргізеді.
C) Тұндыруды электролит -коагулятор қатысында жүргізеді.
D) Тұнбаға түсіруші реагентті 1,5 есе артық мөлшерде қосады.
E) Ерітіндіні жетілдіру үшін біраз уақытқа қалдырады.
440. Гравиметриялық талдауда заттың гравиметриялық түріне қойылатын талаптарды қанағаттандырмайтын шарт:
A)Сыртқы әсерлерге тұрақты болуы тиісті.
B)Іс жүзінде ерімеуі керек.
C)Гравиметриялық түрге оңай айналуы керек.
D)Құрамы белгілі және тұрақты болуы керек.
E)Су буын сiңiргенде құрамын жеңiл өзгертуі керек.
441. Графиметриялық анықтауда жүргізілмейтін кезең:
A)Индикатор қосу және титрлеу.
B)Тұнбаның бетiндегi сұйықтықтан тұнбаны бөлiп алу үшiн сүзу.
C)Тұнбаны шаю.
D)Тұнбаны кептiру және өлшеу.
E)Тұнбалық түрді алу.
442. Тұнбаны кептіру температурасы:
A)1000С.
B)2500С.
C)3000С.
D)1500С.
E)2000С.
443. Егер (Q-S)/S қатынасы аз шама болса, түзілетін тұнба:
A) Аморфты.
B) Коллоидты.
C) Коллоидты, кристалдардың қоспасы бар.
D) Кристалдық.
E) Аморфты, кристалдардың қоспасы бар.
444. Күшті электролиттер ерітінділеріндегі иондану дәрежесі:
A)0.
B) 1.
C) >1.
D) 1.
E) 0.
445. Тұнбаның массасы тұрақтадырылған болып саналады,егер оның аналитикалық таразыда өлшенген массаларының бір-бірінен айырмашылығы болса:
A) 0.0002г.
B) 0,002г.
C) 0,02г.
D) 0,2г.
E) 2г.
Қышқылдық-негіздік титрлеу
446. H3PO4 + 3KOH = K3PO4 + 3H2O реакциясындағы фосфор қышқылының эквиваленттік
факторы:
A) 1.
B) 1/2.
C)

D) 3.
E) 5.
447. Алмасу реакцияларында ортофосфор қышқылының эквивеленттік факторы болуы мүмкін:
A) 1.
B)
 .
.
C)
 .
.
D) Жүретін реакция теңдеуіне байланысты 1, , болуы мүмін.
E)Алынатын қышқылдың массасы байланысты 1, , болуы мүмін.
448. Na2CO3 + HCl = NaHCO3 + NaCl реакциясындағы натрий карбонатының эквивалентінің молярлық массасы (г/моль):
A) 106.
B)
C)10,6.
D)
E)5,3.
449. Na2CO3 + 2HCl = Na2CO3 + 2NaCl реакциясындағы натрий карбонатының эквивалентінің молярлық массасы (г/моль):
A) 106.
B)
C) 10,6.
D)
E) 5,3.
450. H3PO4 + 2KOH = K2HPO4 + 2H2O реакциясындағы фосфор қышқылының эквиваленттік
факторы:
A)

B) 1.
C) .
.
D) 3.
E) 5.
451. Көлемі 1 литр ерітіндідегі еріген заттың массасымен анықталатын концентрация (г/л):
A) Массалық концентрация.
B) Мольдік үлес.
C) Молярлық концентарция.
D) Эквиваленттің молярлық концентрациясы.
E) Массалық үлес.
452. Көлемі 1,00 мл ерітіндідегі еріген заттың массасымен анықталатын концентрация (г/л):
A) Массалық концентрация.
B) Титр.
C) Молярлық концентарция
D) Эквиваленттің молярлық концентрациясы.
E) Молялды концентрациясы.
453. Көлемі 1,00 мл титрантпен әрекеттесетін анықтайтын заттың массасы (г):
A) Массалық концентрация.
B) Титр.
C) Анықтайтын зат бойынша титр.
D) Массалық үлес.
E) Молялды концентрациясы.
454. Массалық концентрация мен молярлық концентрация арасындағы байланысты көрсететін қатынас:
A)
B)
сm(x)/М(x).
C) z * с(Х).
D) с(1/zХ) * М(1/zХ).
E) c (1/2x)
455. Mассалық концентрацияны есептейтін қатынас:
A) .
.
B) .
.
C)

D)
E)

456. Анықтайтын зат бойынша титрді есептейтін қатынас:
A)
B) .
.
C)
D)
Т * V.
E) c(x) * M(x)
457. Эквиваленттер заңының математикалық өрнегі:
A)

B)
C)
D)
E)
458. Эквиваленттер заңы салдарының математикалық өрнегін көрсетіңіз:
A)
B)

D)
E)
459. Титриметриялық талдауда эквиваленттер заңы салдарының математикалық өрнегі:
A)
B)
C)
D)
E)
460. Эквивалентінің молярлық концентрациясы 0,1 моль/л, көлемі 200 мл ерітіндідегі
калий гидроскидінің массасы (Мr(КОН) = 56) (г):
A) 56.
B) 5,6.
C) 0,56.
D) 1,12.
E) 11,2.
461. 0,02 М ерітіндідегі Al2(SO4)3 эквивалентінің молярлық концентрациясы:
A) 0,01.
B) 0,1.
C) 0,2.
D) 1,2.
E) 0,12.
462. 0,05 М ерітіндідегі Al2(SO4)3 эквивалентінің молярлық концентрациясы: +
A) 0,05.
B) 0,1.
C) 0,2.
D) 0,3.
E)0,06.
463. Эквивалентінің молярлық концентрациясы 0,06 моль/л ерітіндідегі Bi(NO3)3 молярлық концентрациясы:
A) 0,6.
B) 0,5.
C) 0,4.
D) 0,3.
E) 0,2.
464. Көлемі 500 мл 2 н. HCl ерітіндісінен 0,1 н ерітінді дайындау үшін ерітіндіні сұйылту +
керек:
A) 200 мл дейін.
B) 500 мл дейін.
C) 1000 мл дейін.
D) 2000 мл дейін.
E) 5000 мл дейін.
465. Көлемі 1 л 0,05 н. Н2 SO4 ерітіндісін дайындау үшін, оның 0,1 н. ерітіндісінен алынатын көлемі (мл):
A) 500.
B) 100.
C) 50.
D) 10.
E) 5.
466. Көлемі 22,2 мл хлорсутек ерітіндісін титрлеуге 25 мл 0,5378 М натрий гидроксиді ерітіндісі жұмсалынды. Ерітіндідегі НСl эквивалентінің молярлық концентрациясы (моль/л):
A) 0,6056 .
B) 0,1010.
C) 0,5430.
D) 0,4030.
E) 0,2020.
467. Көлемі 25 мл калий гидроксиді ерітіндісін титрлеуге 15 мл 0,1 н. HСl ерітіндісі жұмсалынды. Ерітіндідегі КОН эквивалентінің молярлық концентрациясы (моль/л):
A) 0,01.
B) 0,06.
C) 0,6.
D) 0,02.
E) 0,2.
468. Көлемі 3 литр 0,1 н. HNO3 ерітіндісін дайындау үшін, оның 2 н. ерітіндісінің
қажетті көлемі (мл):
A) 100.
B) 150.
C) 200.
D) 500.
E) 1000.
469. Көлемі 1 л 3М ерітіндідегі натрий гидроксидінің массасы (г):
A) 100.
B) 200.
C) 40.
D) 80.
E) 120.
470. Эквивалетінің молярлық концентрациясы 0,1 моль/л, көлемі 100 мл натрий корбанаты ерітіндісін дайындау үшін қажетті тұздың массасы (Мr(Na2CO3) = 106) (г):
A) 53
B) 5,3.
C) 0,53.
D) 0,053.
E) 0,0053.
471. Эквивалетінің молярлық концентрациясы 0,1 моль/л, көлемі 100 мл қымыздық қышқылы ерітіндісін дайындауға қажетті қышқылдың (Мr(Н2C2O4*2Н2О) = 126,04) массасы (г):
A) 126,02
B) 63,02.
C) 6,302.
D) 0,6302.
E) 0,0630.
473. 3,65 г хлорсутегі еріген 100 мл ерітіндінің эквивалентінің молярлық концентрациясы (моль/л):
A) 0,001.
B) 0,01.
C) 0,1.
D) 1.
E) 2.
474. с(1/2Н2С2О4*2H2O) = 0 моль/л қымыздық қышқылы (Мr =126,08) ерітіндісінің титрі (г/мл):
A) 0,06568.
B) 0,001582.
C) 0,006304.
D) 0,06330.
E) 0,01260.
475. Көлемі 1 л 3М ерітіндідегі натрий гидроксидінің массасы (г):
A) 100.
B) 200.
C) 40.
D) 80.
E) 120.
476. Көлемі 250 мл ерітіндіде 10,00 г NaOH еріген ерітіндінің титрі:
A) 4,00.
B) 0,25.
C) 25,0.
D) 0,04.
E)0,40.
477. Құрамыда 10 г NaOH бар 250 мл ерітіндінің титрі (г/мл):
A) 4.0000
B) 0,2500.
C) 25.0000
D) 0,04000.
E) 0,4000.
478. 1 н. NH4OH ерітіндісінің титрі (г/мл):
A) 1.
B) 0,5.
C) 0,01.
D) 0,035.
E) 35.
479. Эквивалентінің молярлық концентрациясы 0,1 моль/л, көлемі 1 л ерітінді дайындау үшін қажетті натрий гидроксидінің массасы (г):
A) 40,0.
B) 4,0.
C) 0,4.
D) 2,0.
E) 8,0.
480. Титрі 0,003651 г /мл HCl ерітіндісінің эквивалентінің молярлық концентрациясы (моль/л):
A) 1,0.
B) 0,5.
C) 0,1.
D) 0,05.
E) 0,01.
481. Көлемі 2 литр 0,1 н. HNO3 ерітіндісін дайындау үшін, оның 2 н. ерітіндісінің қажетті көлемі (мл):
A) 100.
B) 150.
C) 200.
D) 500.
E) 1000.
482. Әрекеттесетін заттар ерітінділерінің көлемін дәл өлшеуге негізделген талдау әдісі:
A) Фотометрия.
B) Потенциометрия.
C) Гравиметрия.
D) Титриметрия.
E) Кулонометрия.
483. Титрияметриялық талдаудың негізін құрайтын заң:
A) Әрекеттесуші массалар заңы.
B) Эквиваленттер заңы.
C) Гетерогендік тепе теңдік заңы.
D) Авагадро заңы.
E) Вант-Гофф заңы.
484. Талдауға алынатын өлшенді массасы «2,5324» г болғанда, өлшеу дәлдігі (г):?
A) 1.
B) 0,1.
C) 0,01.
D) 0,001.
E) 0,0001.
485. Пипетка дәлдігі (мл):
A) 1.
B) 0,5.
C) 0,0001.
D) 0,05.
E) 0,02.
486. Бюретка дәлдігі(мл):
A) 1.
B) 0,5.
C) 0,0001.
D) 0,05.
E) 0,02.
487. Бюретка көмегімен өлшенген 21 мл ерітінді көлемінің дұрыс жазылуы:
A) 21,0 мл.
B) 2,100 мл.
C) 21,00 мл.
D) 21,000 мл.
E) 21,0000 мл.
488. Көлемдік талдауда титрлеуге өлшеп алынатын ерітіндінің ең аз көлемі (мл):
A) 20,00.
B) 10,00.
C) 5,00.
D) 25,00.
E) 1,00.
489. Бір тамшының көлемі 0,04 тең болғанда, төменде берілген көлемдерінің қайсысының титрлеуде қатесі ең аз болады (мл):
A) 25,00.
B) 15,00.
C) 10,00.
D) 5,00.
E) 2,00.
490. Концентрациясы дәл белгілі ерітіндіні атайды:
A) Титрленетін ерітінді.
B) Концентрациясын анықтайтын ерітінді.
C) Титрлеу кезінде қолданылатын барлық ерітінділер.
D) Титрленген ерітінді.
E) Екінші стандартты ерітінді.
491. Титрі анықталған ерітінді:
A) Судың кез келген көлемінде дайындалған ерітінді.
B) I-ші стандартты ерітінді.
C) Өлшендіден өлшеуіш колбасында дайындалған ерітінді.
D) II-ші стандартты ерітінді.
E) Концентрациясы шамамен белгілі ерітінді.
492. Титрленген ерітінді:
A) Титрі белгісіз ерітінді.
B) Титрін анықтайтын ерітінді.
C) Концентрациясын анықтайтын ерітінді.
D) Концентрациясы дәл белгілі ерітінді.
E) Концентрациясы шамамен белгілі ерітінді.
493. Титранттардың концентрациясын тез анықтау үшін пайдаланатын арнайы стандартты ерітінді:
A) Фиксанал.
B) Куәгер ерітінді.
C) Концентрациясы жуық анықталған ерітінді.
D) Көлемі шамамен белгілі ерітінді.
E) II-ші стандартты ерітінді.
494. Стандартты ерітінділерді дайындайтын тәсіл:
A) Кері титрлеу.
B) Тура титрлеу.
C) Орынбасу титрлеу.
D) Жеке сынамалар алу.
E) Реверсивті титрлеу.
495. Өлшенділерді судың кез келген мөлшерінде ерітуден дайындалған ерітінділердің әрқайсысын титрлеуге негізделген әдіс:
A) Кері титрлеу.
B) Орынбасу титрлеуі.
C) Қалдық бойынша титрлеу.
D) Пипетрлеу әдісі.
E) Жеке сынамалар әдісі.
496. Өлшеуіш колбасында дайындалған ерітіндіден пипетка көмегімен алынған ерітіндінінің белгілі көлемін титрлеуге негізделген әдіс:
A) Кері титрлеу.
B) Орынбасу титрлеуі.
C) Қалдық бойынша титрлеу.
D) Пипетрлеу әдісі.
E) Жеке сынамалар әдісі.
497. Стандартты ерітінділерді дайындауға қажетті бастапқы заттың массасын есептейді:
A) .
.
B)

 .
.
C)

 .
.
D)
E)
T(
 )
*
V.
)
*
V.
498. Стандартты ерітінділерді дайындауда салыстырмалы қателігі төмен болатын қосылыс:
A) M(Na2B4O7 * 10H2O) = 381,4 г/моль.
B) M(NaOH) = 40 г/моль.
C) M(KOH) = 56 г/моль.
D) M(H2C204 * 2H2O) = 126,8 г/моль.
E) M(Na2CO3) = 106 г/моль.
499. Қышқылдық-негіздік титрлеуде негіздерді сандық анықтау тәсілі:
A) Алкалиметрия.
B) Ацидиметрия.
C) Оксидиметрия.
D) Компексонометрия.
E) Аргентометрия.
500. Қышқылдық-негіздік титрлеуде қышқылдарды сандық анықтау тәсілі:
A) Алкалиметрия.
B) Ацидиметрия.
C) Оксидиметрия.
D) Компексонометрия.
E) Аргентометрия.
501. Титранты қышқыл болатын титрлеу әдісі:
A) Редоксиметрия.
B) Алкалиметрия.
C) Ацидиметрия.
D) Аргентометрия.
E) Комплексонометрия.
502. Титранты сілті болатын титрлеу әдісі:
A) Редоксиметрия.
B) Алкалиметрия.
C) Ацидметрия.
D) Аргентометрия..
E) Комплексонометрия.
503. Ацидиметрия әдісінің жұмысшы ерітінділері немесе титранттары:
A) H2C4H4O6, H2C2О4 * 2H2O.
B) КOH, NaОН.
C) HCl, H2SO4.
D) Na2СО3, Na2В4O7*10H2O.
E) H2C2О4 * 2H2O, NaОН.
504. Алкалиметрия әдісінің жұмысшы ерітінділері немесе титранттары:
A) H2C4H4O6, H2C2О4*2H2O.
B) NaОН, КOH.
C) HCl, H2SO4.
D) Na2СО3, Na2В4O7*10H2O.
E) H2C2О4 * 2H2O, NaОН.
505. Ацидиметрия әдісінде стандартты ерітінді дайындайтын бастапқы заттар:
A) H2C4H4O6, H2C2О4 * 2H2O.
B) КOH, NaОН.
C) HCl, H2SO4.
D) Na2СО3, Na2В4O7*10H2O.
E) NaОН, Вa(OH)2.
506. Алкалиметрия әдісінде стандартты ерітінді дайындайтын бастапқы заттар:
A) H2C4H4O6, H2C2О4*2H2O.
B) КOH, NaОН.
C) HCl, H2SO4.
D) Na2СО3, Na2В4O7*10H2O.
E) NaОН, HCl.
507. Қышқылдық-негіздік титрлеуде бірінші стандарт ерітіндісін дайындауға қолданылмайтын қосылыс:
A) Бензой қышқылы.
B) Сірке қышқылы.
C) Натрий тетрабораты.
D) Янтарь қышқылы.
E) Қымыздық қышқылы
508. Қышқылдық-негіздік титрлеуде бірінші стандарт ерітіндісін дайындауға болмайтын қосылыс:
A) Бензой қышқылы.
B) Калий гидротартраты.
C) Натрий карбонаты.
D) Янтарь қышқылы.
E) Хлорсутек қышқылы.
509. Бастапқы зат ретінде натрий тетраборатын қолданатын қышқылдық-негіздік титрлеу әдісінің түрі:
A) Аргентометрия.
B) Алкалиметрия.
C) Тиоцианометрия.
D) Ацидиметрия.
E) Бариметрия.
510. Бастапқы зат ретінде қымыздық қышқылын қолданатын қышқылдық-негіздік титрлеу әдісінің
түрі:
A) Аргентометрия.
B) Алкалиметрия.
C) Тиоцианометрия.
D) Ацидиметрия.
E) Бариметрия.
511. Бастапқы зат ретінде натрий карбонатын қолданатын қышқылдық-негіздік титрлеу әдісінің
түрі:
A) Аргентометрия.
B) Алкалиметрия.
C) Тиоцианометрия.
D) Ацидиметрия.
E) Бариметрия.
512. Бейтараптану әдісі негізделген реакция:
A) NH3 + H2O ↔ NH4+ + OH-.
B) H2O + H2O ↔ H3O+ + OH-.
C)
HCl
+
OH
↔  Cl-
+ H2O.
Cl-
+ H2O.
D) H+ + OH- = H2O.
C) HCl + OH- ↔ Cl- + H2O.
513. «Индикатордың молекула түріндегі және ион түріндегі түстері әр түрлі болатын әлсіз органикалық қышқылдар немесе негіздер» - бұл анықтама сәйкес келетін индикаторлар теориясы:
A) Хромофорлы.
B) Иондық.
C) Координациялық – иондық .
D) Хинофенолятты.
E) Барлық индикаторлар теориясы.
514. «Ерітінді рН-ына байланысты ішкітоптасу нәтижесінде молекула құрылысының өзгеруінен индикаторлардың түсі өзгереді» - бұл анықтама сәйкес келетін индикаторлар теориясы:
A) Хромофорлы.
B) Иондық .
C) Координациялық – иондық .
D) Хинофенолятты.
E) Барлық индикаторлар теориясы.
515. «Ерітінді рН-ына байланысты иондық тепе-теңдіктің ығысуынан және ішкі топтасу нәтижесінде молекула құрылысының өзгеруінен индикаторлардың түсі өзгереді» - бұл анықтама сәйкес келетін индикаторлар теориясы:
A) Хромофорлы.
B) Иондық .
C) Координациялық – иондық .
D) Иондық-хромофорлы.
E) Барлық индикаторлар теориясы.
516. Индикатрдың сандық сипаттамаларына жатады:
A) Тус ауысу аралығы және титрлеу көрсеткіші.
B) Қышқылдық константа және титрлеу көрсеткіші.
C) Негіздік константа және түс ауысу аралығы.
D) Қолданатын индикатор концентрациясы және мөлшері.
E) Индикатор мөлшері және негіздік константа.
517. Индикаторларға қойылатын талаптарды қанағаттандырмайтын шарт:
A) рН = рТ.
B) Индикатордың концентрациясы төмен болуы тиіс.
C) Түсінің ауысуы айқын байқалуы керек.
D) Индикатордың 1-2 тамшысын қосу керек.
E) Индикатордың концентрациясы жоғары болуы тиіс.
518. Индикатордың түсі өзгеретін рН мәнінің белгілі бір ауданы:
A) Индикатордың иондану константасы.
B) Титрлеу көрсеткіші.
C) Индикатордың түс ауысу аралығы.
D) Титрлеу қисығы.
E) Титрлеу секірмесі.
519. Қышқылдық-негіздік индикаторлардың түс ауысу аралығының мәнін есептейтін теңдік:
A)

B)
 =
14 – 7.
=
14 – 7.
C)
 = 7 ± 1.
= 7 ± 1.
D) = 7 ± 1.
E)

520. Күшті қышқылды күшті негізбен титрлеуде қолданатын индикаторларды таңдайды:
A) Титрлеу көрсеткішінің мәні титрлеудің бастапқы нүктесіндегі рН-тың мәніне сәйкес келетін индикаторлар.
B) Барлық индикаторлар.
C) Титрлеу көрсеткішінің мәні титрлеу секірме ауданы рН-ның мәніне сәйкес келетін
индикаторлар.
D) Титрлеу көрсеткішінің мәні титрлеудің аяқталу нүктесіндегі рН-тың мәніне сәйкес келетін
индикаторлар.
E) Тек лакмус индикаторы.
521. Индикаторлардың түсі шұғыл өзгеретін ерітінді рН-ның мәні:
A) Индикатордың иондану константасы.
B) Титрлеу көрсеткіші.
C) Индикатордың түс ауысу аралығы.
D) Титрлеу қисығы.
E) Титрлеу секірмесі.
522. Эквивалентті ңүкте маңындағы рН мәнінің шұғыл өзгерісі байқалатын аралық:
A) Титрлеудің аяқталу кезеңі.
B) Титрлеу көрсеткіші.
C) Индикатор түсінің өзгеру аймағы.
D) Титрлеу қисығы.
E) Титрлеу секірмесі.
523. Кез келген титрлеуді аяқтайды:
A) рТ = рН.
B) рТ > рН.
C) рТ < рН.
D) рТ = рН + 1.
E) рТ = рН - 1.
524. Түсінің өзгеруі байқалатын индикатордың молекула және ионданған түрлерінің қатынасы:
A)
 ,
,  .
.
B)
 ,
,  .
.
C) , .
D)
 ,
,  .
.
E)
 ,
,  .
.
525. Қышқылдық-негіздік титрлеудің ацидиметрия тәсілінде қолданатын негізгі индикатор:
A) Эозин.
B) Фуксин.
C) Фенолфталеин.
D) Флуоресцеин.
E) Метил қызғылтсары.
526. Қышқылдық-негіздік титрлеудің алкалиметриялық тәсілінде қолданатын негізгі индикатор:
A) Эозин.
B) Фуксин.
C) Фенолфталеин.
D) Флуоресцеин.
E) Метил қызғылт сары.
527. Фенофталеин индикаторының рТ-нің мәні:
A) 9.
B) 4.
C) 7.
D) 5,5.
E) 8.
528. Метил қызылғылт сары индикаторының рТ-нің мәні:
A) 9.
B) 4.
C) 7.
D) 5,5.
E) 8.
529. Фенолфталеин индикаторының түс ауысу аралығы байқалатын рН мәнінің ауданы:
A) 4,2 – 6,2.
B) 8,2 – 10,2.
C) 5,0 – 8,0.
D) 3,2 – 4,4.
E) 1,2 – 2,8.
530. Қышқыл ерітіндісін сілтімен титрлеуде индикатор фенолфталеин түсі түссізден күлгін түске өзгергендегі ерітіндіде [H+] –ның мәні (моль/л):
A) 10-8.
B) 10-9.
C) 10-11.
D) 10-12.
E) 10-13.
531. Сілтіні күшті қышқыл ерітіндісімен титрлеуде метил қызғылт сары индикаторының түсі сарыдан қызыл түске өзгерген кезде ерітіндідегі [H+] тең болады:
A)10-1.
B) 10-2.
C) 10-4.
D) 10-12.
E) 10-13.
532. Бір түсті индикатор:
A) Фенофталеин.
B) Метил қызылы.
C) Метил қызғылт сары
D) Эозин.
E) Лакмус
533. Қышқылдық ортадан сілітілік ортаға ауысқанда фенолфталеин индикаторының түсі өзгереді:
A) Қызылдан – сарыға.
B) Қызылдан – түссізге.
C) Күлгінен – түссізге.
D) Түссізден – күлгінге.
E) Сарыдан – қызылға.
534. Титриметриялық талдауда пайдаланылатын реакцияларды қанағаттандырмайтын талап:
A) Эвиваленттік нүктенің дәл және оңай анықталуы .
B) Реакцияның сандық түрде жүруі тиісті.
C) Қосымша реакциялардың жүруі.
D) Реакция жылдамдығы жоғары болуы.
E) Эвиваленттік нүктенің айқын анықталуы тиіс.
535. Титриметриялық талдауда пайдаланылатын реакцияларды қанағаттандырмайтын талап:
A) Эвивалеттік нүктеде дәл және оңай анықталуы керек.
B) Реакция сандық түрде жүруі тиісті.
C) Қосымша реакциялар жүрмеуі керек.
D) Реакция тез жүруі керек.
E) Реакция баяу жүруі керек.
536. Бейтараптану әдісінің эквиваленттік нүктесінде әрекеттесуші заттардың:
A) Массаларының қатынасы 1 : 10.
B) Көлемдерінің қатынасы 1 : 10.
C) Көлемдерінің қатынасы 1 : 1.
D) Массаларының қатынасы 1 : 1.
E) Эквивалентінің моль сандарының қатынасы 1 : 1.
537. Күшті қышқылды күшті негізбен титрлеудің эквиваленттік нүктесінде:
A) рН < рОН.
B) рН = рОН.
C) рН > рОН.
D) рН = 14 + рОН.
E) рОН = 14 + рОН.
538. Сірке қышқылы ерітіндісін натрий гидроксиді ерітіндісімен титрлеуде эквиваленттік нүктеге дейін түзіледі:
A) Әлсіз қышқыл.
B) Буфер жүйесі.
C) Гидролизденетін тұз.
D) Күшті негіз.
E) Күшті қышқыл.
539. Сірке қышқылы ерітіндісін натрий гидроксиді ерітіндісіменмен титрлеу кезінде
эквиваленттік нүктеде түзіледі:
A) Әлсіз қышқыл.
B) Буфер жүйесі.
C) Гидролизденетін тұз.
D) Күшті негіз.
E) Күшті қышқыл.
540. Сірке қышқылы ерітіндісін натрий гидроксиді ерітіндісімен титрлеудің бастапқы нүктесіндегі ерітінді рН-ын есептейді:
A)
 .
.
 .
.
C)

D)


E)
14 - 
541. Фосфор қышқылын титрлеуде аралық нүктелердегі ерітінді рН-ның мәнін есептейді:
A) Әлсіз қышқылдың.
B) Буфер жүйесінің түзілуімен.
C) Гидролизге ұшырайтын тұздың.
D) Күшті негіздің.
E) Күшті қышқылмен.
542. Қышқылдық-негіздік титрлеу әдісінен анықтау мүмкін болмайтын қосылыстар:
А) Қышқылдар
В) Қышқыл тұздар
С) Негіздер
D) Тотықсыздандырғыштар
E) Негіздік тұздар
543. Полипротонды қышқылдарды сатылап титрлеуге болады, егер:
A) K1/K2 ≥ 10-7.
B) K1/K2 = 7.
C) K1/K2 ≥ 104.
D) K1/K2 = 4.
E) K1/K2 = 10-8.
544. Эквиваленттік нүктесі нейтралдау сызығына сәйкес келеді:
A) Әлсіз қышқылды күшті негізбен титрлеуде.
B) Әлсіз негізді тотықсыздандырғышпен титрлеуде.
C) Күшті қышқылды күшті негізбен титрлеуде.
D) Күшті негізді тотықтырғышпен титрлеуде.
E) Әлсіз қышқылды әлсіз негізбен титрлеуде.
545. Эквиваленттік нүктесі рН > 7 ауданда болады:
A) Күшті қышқылды күшті негізбен титрлеуде.
B) Әлсіз негізді күшті қышқылмен титрлеуде.
C) Әлсіз қышқылды күшті негізбен титрлеуде.
D) Күшті негізді күшті қышқылмен титрлеуде.
E) Әлсіз қышқылды әлсіз негізбен титрлеуде.
546. Концентрациясы 0,1 моль/л 100 мл HCl ерітіндісін 100 мл 0,1 моль/л NaOHерітіндісімен титрлеудің бастапқы нүктесіндегі ерітіндінің [Н+]-ның мәні (моль/л):
A) 10-1.
B) 1014-7.
C) 10-5.
D) 10-7.
E) 10-13.
547. Концентрациясы 0,1 моль/л 100 мл HCl ерітіндісіне 100 мл 0,1 моль/л NaOH ерітіндісімен титрлеудің бастапқы нүктесіндегі ерітінді рН-ның мәні:
A) 1.
B) 3.
C) 5.
D) 7.
E) 13.
548. Концентрациясы 0,1 моль/л 100 мл HCl ерітіндісін 100 мл 0,1 моль/л NaOH ерітіндісімен титрлеудің эквиваленттік нүктесіндегі [H+] мәні:
A) 10-9.
B) 10-10.
C) 10-7.
D) 10-5.
E) 10-1.
549. Концентрациясы 0,1 моль/л 100 мл HCl ерітіндісін 100 мл 0,1 моль/л NaOH ерітіндісімен титрлеудің эквиваленттік нүктесіндегі рН-тың мәні:
A) 9.
B) 5.
C) 7.
D) 10.
E) 2.
550. Титрлеу аяқталғанда ерітіндіде артық сутек иондарының мөлшерімен анықталатын қате (рТ < рН):
A) Қышқылдық.
B) Сутектік.
C) Негіздік.
D) Гидроксилді.
E) Сілтілік.
551. Титрлеу аяқталғанда ерітіндіде артық гидроксид иондарының мөлшерімен анықталатын қате (рТ > рН) :
A) Қышқылдық.
B) Сутектік.
C) Негіздік.
D) Гидроксилді.
E) Сілтілік.
552. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз қышқылдың мөлшерімен анықталатын қате:
A) Қышқылдық.
B) Сутектік.
C) Негіздік.
D) Гидроксилді.
E) Сілтілік.
553. Титрлеу аяқталғанда ерітіндіде толық титрленбеген әлсіз негіз молекулуларының мөлшерімен анықталатын қате:
A) Қышқылдық.
B) Сутектік.
C) Негіздік.
D) Гидроксилді.
E) Сілтілік.
554. Жанама титрлеуде:
A) Титрантты тікелей талданатын ерітіндіге қосады.
B) Талданатын ерітіндіге көмекші ерітіндінің артық мөлшерін қосып, бөлінген өнімді титрлейді.
C) Талданатын ерітіндіге көмекші ерітіндінің белгілі артық мөлшерін қосып, әрекеттеспей қалған көмекші ерітіндіні титрлейді.
D) Титрантты тирлеу колбасына, талданатын ерітіндіні бюреткаға құйады.
E) Талданатын ерітінді титрлеу колбасына, титрантты бюреткаға құйады.
555. Кері титрлеуде:
A) Титрантты тікелей талданатын ерітіндіге қосады.
B) Талданатын ерітіндіге көмекші ерітіндінің артық мөлшерін қосып, бөлінген өнімді титрлейді.
C) Талданатын ерітіндіге титрант ерітіндінің белгілі артық мөлшерін қосып, әрекеттеспей қалған титрант ерітіндісін титрлейді.
D) Титрант ерітіндісін тирлеу колбасына, талданатын ерітіндіні бюреткаға құйады.
E) Талданатын ерітіндіі титрлеу колбасына, титрант ерітіндісін бюреткаға құйады.
556. Күшті қышқылды күшті негізбен титрлеудің эквиваленттік нүктесінде:
А) pH<7
B) pH=7
C) pH>7
D) pH=107
E) pH=1014
557. Бірінші стандартты ерітіндіні дайындайтын бастапқы заттарға қойылатын талаптарды қанағаттандырмайтын қосылыс:
A) Калий гидрофталаты.
B) Натрий тетрабораты.
C) Қымыздық қышқылы.
D) Янтарь қышқылы.
E) Калий сульфаты.
558. Бірінші стандартқа қойылатын талаптарды қанағаттандырмайтын шарт:
A) Құрамының химиялық формуласына сәйкес болуы.
B) Суда жақсы еруі.
C) Сақтағанда құрамының өзгермеуі.
D) Молекулалық массасының үлкен болуы.
E) Қосылыстың ұшқыш болуы.
559. Эквивалентті нүктеде ерітінді ортасы pH = 7 болатын титрлеу:
A) Күшті негізді күшті қышқылмен титрлеу.
B) Әлсіз негізді күшті қышқылмен титрлеу.
С) Әлсіз негізді әлсіз қышқылмен титрлеу .
D) Күшті негізді тотықсыздандырғышпен.
Е) Күшті негізді тотықтырғышпен .
560. Өлшенді массасы бойынша титрді есептейтін қатынас (г/мл):
A)
 .
.
B)

C)

D)
E)
 .
.
561. Титрлеуде индикатор рН-ын таңдау негізделген:
A) Анализденетін заттың табиғатына.
B) Титранттың табиғатына.
C) Реакция өнімінің қасиетіне.
D) Эквиваленттік нүктеде орта рН-ның өзгеруіне.
E) Титрлеуде [H+] өзгеруіне.
562. Титрленген ерітіндіні дайындайды:
A) Ұшқыш кристалды заттардан.
B) Құрамы химиялық формулусына сай келмейтін заттардан.
C) Сақтағанда құрамы өзгеретін заттардан.
D) Бастапқы стандартты заттардан.
E) Қоспасы бар заттрдан.
563. Анықтайтын зат титрантпен тікелей әрекеттеспеген жағдайда қолданатын титрлеу әдісі:
A) Реверсивті.
B) Тура титрлеу.
C) Тұндыру титрлеу.
D) Орынбасушыны титрлеу.
E) Кері титрлеу.
564. HCl ерітіндісін Na2CO3 ерітіндісімен титрлеуде қолданылатын индикатор:
A) Фенолфталеин.
B) Әмбабап.
C) Метил қызғылт сары.
D) Метил қызыл.
E) Лакмус.
565. HCl және H3BO3 қоспасын NaOH ерітіндісімен титрлеуде қолданылатын индикаторлар:
A) Әмбабап, метил қызылы.
B) Метил қызғылт сары, фенолфталеин.
C) Метил қызылы, лакмус.
D) Лакмус, метил қызғылт сары.
E) Метил қызылы, хромаген қара.
566. Қышқылдық-негіздік титрлеу әдісімен анықтау мүмкін емес:
A) Күшті қышқылдарды.
B) Әлсіз қышқылдарды.
C) Күшті негіздерді.
D) Әлсіз негіздерді.
E) Тотықсыздандырғыштарды.
567. Қышқылдық-негіздік титрлеу әдісінде қолданылмайтын индикатор:
A) Фенолфталеин.
B) Лакмус.
C) Метил қызғылт сары.
D) Метил қызыл.
E) Калий хроматы.
568. Судың кермектілігін анықтайтын талдау әдісі:
A) Гравиметрия.
B) Бейтараптау.
C) Тотығу-тотықсыздану.
D) Аргентометриялық.
E) Меркуометриялық.
569. Хромофор тобына жатпайды:
A) > C = O.
B) – N = N–.
C) – ОCH3.
D)– N = O.
E) > C = S.
570. Ауксохромдар тобына жатпайды:
A) – N(CH3)2.
B) – NH2.
C) – ОCH3.
D) – N = O.
E) – OH.
571. Қышқылдық-негіздік әдісінде титрлеу қисығының секірмесі тәуелді:
A) Кb (негіз).
B) Kh.
C) h.
D) α.
E) I.
572. Қышқылдық – негіздік титрлеу әдісінде титрлеу қисығы көрсетеді:
A) Қышқыл көлемінің сілті көлеміне тәуелділігін.
B) Жалпы ерітінді көлемінің титрант көлеміне тәуелділігін.
C) Ерітінді рН-ның титранттың жалпы көлеміне тәуелділігін.
D) Ерітінді электрөткізгіштігінің титрлеудегі ерітіндінің жалпы көлеміне тәуелділігін.
E) Ерітінді потенциалының титрлеудегі ерітіндінің жалпы көлеміне тәуелділігін.
573. Күшті қышқылды күшті негізбен титрлеуде қолданатын индикаторлардың:
A) Титрлеу көрсеткішінің мәні титрлеудің бастапқы нүктесіндегі рН-тың мәніне сәйкес келеді.
B) Барлық индикаторларды.
C) Титрлеу көрсеткішінің мәні рН-тың секіру аралығында орналасқан.
D) Титрлеу көрсеткішінің мәні титрлеудін аяқталу нүктесінің рН-ның мәніне сәйкес келетін индикаторларды.
E) Тек лакмус индикаторын.
574. Әлсіз қышқылды күшті негізбен титрлеуде қолданады:
A) Титрлеу көрсеткішінің мәні титрлеудің бастапқы нүктесіндегі рН-тың мәніне сәйкес
келетін индикаторларды.
B) Барлық индикаторларды.
C) Титрлеу көрсеткішінің мәні титрлеу қисығындағы титрлеу секірмесі аймағында
жататын рН-тың мәніне сәйкес келетін индикаторларды. +
D) Титрлеу көрсеткішінің мәні титрлеудін аяқталу нүктесінің рН-ның мәніне сәйкес келетін индикаторларды.
E) Тек лакмус индикаторын.
575. Титриметриялық талдаудың барлық тәсілдерінде қажет емес:
A) Әрекеттесетін екі заттың ерітінділерінің көлемдерін дәл өлшеу.
B) Индикатор ерітінділерін қолдану.
C) Титрленген ерітінділерді пайдалану.
D) Титлеуде әрекеттесетін заттардың рН-ын өлшеу.
E) Қажетті есептеулерді жүргізу.
576. Титрлеу қисығында титрлеу секірмесі байқалмайтын жүйе:
A) NН4OН - СН3CООН.
B) НСl – NаOН.
C) NаOН - Н3РO4.
D) НСl - NН4OН.
E) Н2C2O4 – NаOН.
577. Сынама өлшендісі таразыда өлшеніп, өлшеуіш колбасында дайындалған ерітінді:
A) Эмпирикалық ерітінді.
B) Титрі анықталған ерітінді немесе титрант ерітіндісі.
C) II – ші стандартты ерітінді немесе жұмыс ерітіндісі
D) Жұмысщы ерітіндісі немесе титрі анықталған ерітінді.
E) Титрленген ерітінді немесе I – ші стандартты ерітінді.
578. Концентрациясы титрленген ерітінді бойынша титрлеу арқылы анықталған ерітінді:
A) Эмпирикалық ерітінді.
B0 Концентрациясы дәл белгілі ерітінді.
C) Титрленген ерітінді немесе I – ші стандартты ерітінді.
D) Титрі даярланған немесе I – ші стандартты ерітінді.
E) Титрі анықталған ерітінді немесе II – ші стандартты ерітінді.
579. Бастапқы заттарға (стандарттарға) қойылатын талаптарды қанағаттандырмайтын шарт:
A) Химиялық таза болуы.
B) Молекулалық массасының үлкен болуы.
C) Құрамының химиялвық формуласына сәйкес келуі.
D) Молекулалық массасының өте кіші болуы.
E) Қатты күйінде де, сұйық күйінде де сақтағанда құрамының өзгермеуі.
580. Қышқылдық- негіздік титрлеудің тәсілдерін индикатор қатысында орындағанда қажет емес жағдай:
A) 25 мл ерітіндіге 1-2 тамшы индикатор қосады.
B) 25 мл ерітіндіге 1-2 мл индикатор қосады.
C) Титрлеу арқылы жұмысшы ерітіндісінің титрін анықтайды.
D) Міндетті түрде ерітінділерді шайқап араластыра отырып титрлейді.
E) Куәгер ерітіндісін пайдалану титрлеудің аяқталуын дәл анықтауға мүмкіндік береді.
581. Ортофосфор қышқылын титрлеуде аралық нүктелердің pH-ын есептейді:
A) Түзілген буферлік жүйемен.
B) Әлсіз қышқылмен.
C) Түзілген гидролизге ұшырайтын тұзбен.
D) Күшті негізбен.
E) Түзілген тұзбен.
Тотығу-тотықсыздану титрлеуі
582. Тотығу-тотықсыздану титрлеу әдісі негізделген реакция:
A) Бейтараптану.
B) Тотығу.
C) Тотығу-тотықсыздану.
D) Тотықсыздану.
E) Гидролиз.
583. Тотығу-тотықсыздану титрлеу әдістерінің топтастырылуы негізделген:
A) Реакция ортасының рН-ына.
B) Тотықтырғыш ерітіндісінің табиғатына.
C) Титрант ерітіндісінің табиғатына.
D) Стандартты зат ерітіндісінің табиғатына.
E) Тотықсыздандырғыш ерітіндісінің табиғатына
584. Тотығу – тотықсыздану титрлеу әдістерінің реакцияларына қойылатын талаптарды қанағаттандырмайтын щарт:
A) Жоғары жылдамдықпен және соңына дейін жүруі, яғни К ≥ 108.
B) Реакцияның қайтымсыз болуы.
C) Эквивалентті нүкте айқын және дәл анықталуы.
D) Өнімдердің құрамының тұрақты болуы.
E) Реакцияның қайтымды болуы және К ≤ 108.
585. Тотығу–тотықсыздану титрлеуде эквивалентті нүктені анықтауға қажетті шамалар:
A) Анықтайтын зат пен титранттың стандарттты ТТ потенциалы және ТТ реакциясына қатысатын электрон саны.
B) Анықтайтын зат пен титранттың жалпы ТТ потенциалы.
C) ТТ реакциясына қатысатын электрон саны.
D) Титранттың концентрациясы .
E) Тотыққан және тотықсызданған түрлерінің концентрациясы.
584. Редокс жұптың тотығу-тотықсыздану потенциалын есептейтін Нернст теңдеуі:
A)
 .
.
B)
 .
.
C)
 .
.
D)
 .
.
E) φ0[ох] – φ0 [red].
585. Тотығу-тотықсыздану титрлеу қисығын тұрғызуда тотығу-тотықсыздану потенциалы есептелмейді:
A) Эквивалентті нүктеге дейін.
B) Эквивалентті нүктеден кейін.
C) Эквивалентті нүктеде.
D) Аралық нүктелерде.
E) Бастапқы нүктеде.
586.
100 мл 0,1 н.  ерітіндісі 100 мл 0,1 н.
ерітіндісі 100 мл 0,1 н. 
 ерітіндісімен титрленгенде
тотығу-тотықсыздану потенциалын
есептейді:
ерітіндісімен титрленгенде
тотығу-тотықсыздану потенциалын
есептейді:
A)

B)
 .
.
C) .
.
D)
 .
.
E)

587. 100 мл 0,1 н. ерітіндісі 0,1 н. ерітіндісімен эквивалентті нүктеге дейін титрленгенде тотығу-тотықсыздану потенциалын есептейді:
A)

B) .
C) .
D) .
E)
588. Қоспадағы бірнеше затты жекелеп титрлеу үшін редокс жұбының стандартты потенциалының айырымы болу керек (B):
A) 0,2.
B) 0,4.
C) 0,6.
D) < 0,2.
E) < 0.
589.
 раекциясының бағытын оңнан солға
өзгертуге қажетті жағдай:
раекциясының бағытын оңнан солға
өзгертуге қажетті жағдай:
A) Әлсіз қышқылдық орта.
B) Сілтілік орта
C) Әлсіз сілтілік орта.
D) Күшті қышқылдық орта.
E) Бейтарап орта.
590. Редоксиметриялық титрлеу әдістерінде эквиваленттік нүктені анықтайды:
A) Амперметрлік титрлеумен.
B) Потенциометрлік титрлеумен.
C) Жүйенің тотығу – тотықсыздану потенциалының өзгеруіне сәйкес түсін өзгертетін редокс– индикаторларымен.
D) Титранттың ең аз артық мөлшерінен анықтайтын зат пен титрант әрекеттесіп біткенде өзінің түсін өзгертетін спецификалық индикаторларымен.
E) Қышқылдық – негіздік титрлеумен.
591. Тотығу–тотықсыздану процестеріндегі реакцияның бағытын есептейтін формула:
A) .
B)

 .
.
C) .
D) .
E) φ0[ох] – φ0 [red].
592.Тотығу – тотықсыздану индикаторының түс ауысу аралығының pH-ның мәнін есептейтін формула:
A) .
B)
 .
.
C)
 .
.
D)
 .
.
E)
φ0[ох]
– φ0
[red].
593. Тотығу-тотықсыздану титрлеу қисығын тұрғызатын тәуелділік:
A) Ерітінді потенциалының қосылған титрант көлемінен өзгеруі.
B) Ерітінді электрөткізгіштігінің қосылған титрант көлемінен өзгеруі.
C) Ерітінді ток күшінің қосылған титрант көлемінен өзгеруі.
D) Ерітінді потенциалының титрленген ерітінді дәрежесінен өзгеруі.
E) Ерітінді рН-ның қосылған титрант көлемінен өзгеруі.
594. Тотығу-тотықсыздану титрлеуде потенциалдың өзгерісінің ең үлкен мәні байқалады:
A) Титрлеудің бастапқы нүктесінде.
B) Титрлеудің аралық нүктелерінде.
C) Эквивалентті нүктеде.
D) Эквивалентті нүктеден кейін.
E) Эквивалентті нүктеге дейін.
595. Тотығу-тотықсыздану титрлеу қисығындағы потенциалдың секіру шамасы тәуелді емес:
A) Қосылыстың тотыққан және тотықсызданған түрлерінің концентрациясына.
B) Температураға.
C) Ерітінді рН-на.
D) Комплекстүзуші иондардың болуына.
E) Қосылыстың тек тотыққан түріне.
596. Тотығу-тотықсыздану титрлеу қисығын тұрғызуда өлшенетін шама:
A) Жұптың тотығу- тотықсыздану потенциалы.
B) Тотықтырғыштың концентрациясы.
C) Ерітінді рН-ы.
D)Тотықсыздандырғыштың концентрациясы.
E) Ерітінді көлемі.
597. Тотығу-тотықсыздану титрлеудегі индикаторларға қойылатын талаптарды қанағаттандырмайтын шарт:
A) Міндетті түрде қайтымды болуы.
B) Эквиваленттік нүктеде тотықтырғышпен немесе тотықсыздандырғыштың аз
мөлшерімен әркеттесуі.
C) Тотыққан және тотықсызданған түрлердің түстерінде айырмашылықтың болуы.
D) Индикатор түсінің ауысу аймағының жоғары болмауы.
E) Индикатор құрамының тотықтырғыштар мен тотықсыздандырғыштардың әсерінен
өзгермеуі.
598. Редоксиметрияда тотығу-тотықсыздану реакциясының Е ≥ 0,47 B болғанда қолданатын титрлеу тәсілі:
A) Тура.
B) Кері.
C) Орынбасу.
D) Диференциалды.
E) Физика-химиялық.
599. Редоксиметрияда тотығу-тотықсыздану реакциясының Е = 0,20 B болғанда қолданатын титрлеу тәсілі:
A) Тура.
B) Кері.
C) Орынбасу.
D) Диференциалды.
E) Физика-химиялық.
600. Калий перманганаты ерітіндісін сақтаудың жағдайларына жатпайтын шарт:
A) Қараңғы жерде.
B) Концентрациясы жуық дайындалған ерітіндісін сақтаған жөн.
C)Қоңыр шыныдан жасалған ыдыста.
D) 8 – 10 күн сақтап, сүзіп, содан соң стандарттайды.
E) Жарықта.
601. Қышқылдық ортада калий перманганаты тотықсызданғанда түзіледі:
A) MnO42-.
B) MnO.
C) MnO2.
D) Mn2+.
E) MnO4-.
602. Натрий тиосульфаты ерітіндісін тура титрлеу әдісімен калий дихроматы бойынша стандарттауға болмайды, себебі:
A) Титрлеу барысында жанама реакция жүретіндіктен реакцияны бір теңдеумен көрсетуге болмайды.
B) Эквиваленттiк нүктенi анықтау мүмкiн емес.
C) Реакция қайтымды бір теңдеумен көрсетуге болады.
D) K2Cr2O7 бастапқы затқа жатпайды.
E) K2Cr2O7 дәл мөлшерiн өлшеу мүмкiн емес.
603. Темір (ІІ) ионын калий дихроматымен титрлегенде титрлеу секірмесі потенциалдың
0,94 – 1,32 B интервалында жатады. Эквиваленттік нүктені анықтау үшін пайдаланылатын индикатор:
A) Фенилантронил қышқылы E0 = + 1,08 B.
B) Дифениламин E0 = + 0,76 В.
C) Фениламиназосульфон қышқылы E0 = +0,84 В.
D) Нейтрал қызыл E0 = + 0,24 В.
E) Метил көгi E0 = 0,53 В.
604. Қышқылдық ортада перманганотометриялық титрлеу әдісі негізделген жартылай реакция:
A)
MnO4-
+ 8H+
+ = Mn2+
+
4H2O.
= Mn2+
+
4H2O.
B)
MnO4-
+  =
MnO42-
.
=
MnO42-
.
C) .
.
D)
 .
.
E)
 +
+
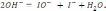
605. Перманганометриялық титрлеуде эквиваленттік нүктені анықтайды:
A) Адсорбциялық индикаторлары қатысында.
B) Металлохромды индикаторлары қатысында.
C) Қышқылдық – негіздік индикаторлары қатысында.
D) Индикаторсыз.
E) Тоығу-тотықсыздану индикаторлары қатысында.
606. Mn(NO3)2 + PbO2 + HNO3 = HMnO4 + Pb(NO3)2 + H2O тотығу – тотықсыздану реакциясындағы марганец ионының эквиваленттік факторы:
A) 1/3.
B) 1/4.
C) 1/5.
D) 1/6.
E) 1/2.
607. Әртүрлі ортадаға сәйкес KMnO4 эквиваленттік факторлары болуы мүмкін:
A)
 .
.
B)
 .
.
C)
 .
.
D) , , .
E) 1.
608. Темірді (II) перманганатометриялық анықтауда (II) ЭДС = 0,74в, Кр = 1064 қолданылатын титрлеу:
A) Кері.
B) Тура.
C) Орынбасу.
D) Сусыз ортада.
E) Реверсивті.
609. Сутек пероксидін перманганатометриялық анықтауда пайдаланылатын титрлеу әдісі:
A) Орынбасу.
B) Кері.
C) Тура.
D) Дифференциалды.
E) Физикалық.
610. Жартылай Cr2O72- + 14H+ + 6e → 2Cr3+ + 7H2O тотықсыздану реакциясындағы калий дихроматы (Mr(K2Cr2O7) = 294,22) эквивалентінің молярлық массасы (г/моль):
A) 38,09.
B) 294,22.
C) 49,03.
D) 29,42.
E) 98,06.
611. Cr2(SO4)3 + Cl2 + KOH = K2CrO4 + KCl + K2SO4 + H2O тотығу – тотықсыздану реакциясындағы хромның эквиваленттік факторы:
A) 1/2.
B) 1/3.
C) 1/4.
D) 1/5.
E) 1/6.
612. Дихроматометриялық титрлеу әдісінде қолданылатын реакция:
A) Тотығу – тотықсыздану.
B) Алмасу.
C) Орынбасу.
D) Тотығу.
E) Тотықсыздану.
613. с(1/6 K2Cr2O7 = 0,02 моль /л, көлемі 100 мл ерітінді дайындауға қажетті калий дихроматының (Mr(K2Cr2O7) = 294,22) массасы (г):
A) 98,06.
B) 9,806.
C) 0,9806.
D) 0,09806.
E) 0,009806.
614. Иодометрия әдісінің жартылай тотығу-тотықсыздану реакциясы:
A) 2S2O32- + О2 = 2SO42- + 2S↓.
B) S2O32- + 2е = J S4O62-
C) S2O32- + 10 OH- - 8e = 2SO42- + 5H2O.
D) J2 + 2S2O32- = J2 + S4O62-
E) S2O32- + 6OH- - 4e = 2SO32- + 3H2O.
615. Аскорбин қышқылын анықтайтын титриметриялық талдау әдісі:
A) Иодометрия.
B) Перманганатометрия.
C) Бромометрия.
D) Броматометрия.
E) Дихроматометрия.
616. Иодометриялық титрлеу әдісіндегі жұмыс ерітіндісі:
A) Натрий тиосульфаты.
B) Калий дихроматы.
C) Күкірт қышқылы.
D) Калий иодиді.
E) Натрий тетратионаты.
617. Титрлеуге қажет иодты дайындағанда:
A) Иодты калий иодидінде ерітеді.
B) Иодты суда ерітеді.
C) Иодты спиртте ерітеді.
D) Бос иодты пайдаланады.
E) Иодты калий иодатында ерітеді.
618. Жартылай тотығу 2S2O32- - 2e = S4O62- реакциясындағы тиосульфаттың
(Mr(Na2S2O3 * 5H2O = 248,19) эквиваленттінің молярлық массасы(г/моль):
A) 49,04.
B) 31,61.
C) 248,19.
D) 127.
E) 63,04.
619. Иодты тиосульфат ерітіндісімен титрлеуді (φ0 = 0,42 В, K = 1012) қолданатын титрлеу түрі:
A) Тура.
B) Кері.
C) Орынбасушыны титрлеу.
D) Реверсивті титрлеу.
E) Сусыз ортада титрлеу.
620. Броматометриядағы бромат-бромид қоспасы:
A) BrO3- + Br-.
B) BrO2- + Br-.
C) Br20 + Br-.
D) BrO- + Br20.
E) BrO- + Br-.
621. Броматометриялық титрлеудегі титрант ерітіндісі:
A) Н2О2.
B) KBr.
C) Br2.
D) K2CrO7.
E) KBrO3.
622. Салицил қышқылын браматометриялық титрлеу әдісіндегі титрант:
A) Na2S2O3.
B) J2.
C) KBrO3.
D) HCl.
E) KBr.
623. ClО3- /Cl- жұбының тотығу-тотықсыздану потенциал жұбы мына формуламен есептеледі:
A)

B)

C)
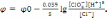

E)
624. Эквивалентінің молярлық конценрациясы 0,5000 моль / л, көлемі 100 мл ерітінді дайындауға қажетті қымыздық қышқылының (Mr(H2C2O4 * 2H2O) = 126,08) массасы (г):
A) 3,152.
B) 31,52.
C) 63,04.
D) 6,304.
E) 126,08.
625. Перманганометриялық әдіспен темір (ІІ) мөлшерін анықтауда пайдаланылатын Циммерман – Рейнгард қоспасы:
A) MnSO4; NaCl; H2SO4.
B) MnSO4; H2SO4; CaCl2.
C) MnSO4; H3PO4; H2SO4.
D) MnSO4; H2SO4; ZnCl2.
E) MnSO4; H3PO4; HCl.
626. K2Cr2O7 + KI +HCI → реакциясы нәтижесінде бөлінген иодты тиосульфат ерітіндісімен титрлеуді орындайды:
A) Кері.
B) Тура.
C) Орынбасу.
D) Сусыз ортада титрлеу.
E) Реверсивті.
627. 5H2C2O4 + 2KMnO4 + 2H2SO4 => 2MnSO4 + 10CO2 + 8H2O реакциясы бойынша калий перманганатының титрін анықтауды орындайды.
A) Кері.
B) Тура.
C) Орынбасу.
D) Сусыз ортада титрлеу.
E) Реверсивті.
628. Талдауға алынатын өлшенді массасы «2,5324» г болғанда, өлшеу дәлдігі (г):?
A) 1.
B) 0,1.
C) 0,01.
D) 0,001.
E) 0,0001.
629. Салицил қышқылының мөлшерін броматометриялық анықтаудағы титрант:
A) Na2S2O3.
B) J2.
C) KBrO3.
D) HCl.
E) KBr.
630. Темірді перманганатометриялық анықтауда (II) ЭДС = 0,74в, Кр = 1064 қолданылатын титрлеу:
A) Кері.
B) Тура.
C) Орынбасу.
D) Сусыз ортада.
E) Реверсивті.
631. Салицил қышқылының мөлшерін анықтайтын әдіс:
A) Иодометрия.
B) Броматометрия.
C) Перманганатометрия.
D) Цериметрия.
E) Ванадатометрия
632. BrO3- + I- = 3I2 + Br- +3H2O реакциясындағы тотықтырғыштың қосып алған электрон саны:
A) 2.
B) 4.
C) 5.
D) 6.
E) 7.
633. Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O жартылай реакция үшін Нернст теңдеуінің өрнегі:
A)


B)

C)


D)


E)


634. Нитритиметриялық титрлеудегі титрант:
A) Стрептоцид.
B) Сульфосалицил.
C) Норсульфазол.
D) Екіншілік хининдер.
E) Натрий нитриті.
635. Пермангонаметриялық әдіспен темір (II) мөлшерін анықтауда пайдаланылатын Циммерман –Рейнгард қоспасы:
A) MnSO4 , NaCl, H2SO4.
B) MnSO4 , H2SO4, CaCl2
C) MnSO4 , H3PO4, H2SO4.
D) MnSO4 , H2SO4, ZnCl2
E) MnSO4 , H3PO4, HCl.
636. Қоспадағы бірнеше иондарды жекелеп титрлеу үшін редокс жұптың стандартты айырымы болу керек (В):
A) 0,2.
B) 1,0.
C) 0,1.
D) 0,01.
E) 0,02.
Тұндыру титрлеуі
637.Тұндыру титрлеу әдісі негізделген:
A) Талданатын жүйенің физика-химиялық қасиеттерін өлшеуге.
B) Титранттың анықтайтын затпен нашар еритін қосылыс түзуіне.
C) Электронның ауысуына жұмсалатын электр мөлшерін өлшеуге.
D) Электрон ауыса жүретін реакцияларға.
E) Талдауда массаны дәл өлшеуге.
Тұндыру титрлеу әдісіне қойылатын талаптарды қанағаттандырмайтын шарт:
A) Түзілетін тұнбаның суда нашар еруі.
B) Реакцияның жүру жылдамдығының жоғары болуы.
C) Титрлеу нәтижесіне адсорбция құбылысының әсер етпеуі.
D) Титрлеудің соңғы нүктесінің дәл және айқын анықталуы.
E) Реакцияның жүру жылдамдығының төмен болуы.
638. Тұндыру титрлеуде пайдаланатын реакциялардың ерігіштік көбейтіндіс Ks болу керек:
A)
Ks
 1,0*10-10.
1,0*10-10.
B) Ks > 1,0*10-10.
C) Ks = 1,0*10-1.
D) Ks мәніне тәуелді емес.
E) Ks = 0.
Тұндыру әдісінде эквиваленттік нүктені анықтайды:
A) Негіздің түзілуімен.
B) Тұнбаның түзілумен.
C) Индикаторсыз да, индикатормен де.
D) Буфер жүйесі қатысында.
E) Қышқылдың түзілуімен.
Тұндыру титрлеудегі индикаторсыз титрлеу тәсілі:
A) Гей-Люссак.
B) Мор.
C) Фаянс.
D) Фольгард.
E) Тура және кері титрлеу.
639. Тұндыру титрлеуінің Ag+ + Наl- = AgHal, (Наl = Сl-, Вг-, CN-) реакциясына негізделген титрлеу әдісі:
A) Гей-Люссак.
B) Мор.
C) Фаянс.
D) Фольгард.
E) Кинетикалық.
640. Аргентометриялық титрлеудің Мор әдісі негізделген реакция:
A) Ag+ + SCN- = AgSCN.
B) Ag+ + CN- = AgCN.
C) Ag+ + I- = AgI.
D) 2Ag+ + CrO42- = Ag2CrO4.
E) 3Ag+ + PO43- = Ag3PO4.
641. Аргентометриялық титрлеудің Мор әдісінің титрант ерітіндісі:
A) NaCl.
B) KSCN.
C) NH4CNS.
D) AgNO3.
E) K2CrO4.
642. Аргентометриялық титрлеудегі Мор әдісінің индикаторы:
A) Флуоресцеин.
B) Калий хроматы.
C) Fe(III) тұзы.
D) Эозин.
E) Индикаторсыз титрленеді.
643. Натрий хлоридінің титрленген ерітіндісімен концентрациясын анықтайтын қосылыс:
A) Сынап (II) нитраты.
B) Аммоний тиоцианаты.
C) Сынап (I) нитраты.
D) Күміс нитраты.
E) Калий бромиді.
644. Аргентометриялық титрлеудің Мор әдісінің индикаторының формуласы:
A) (NH4)2Fe(SO4)2 * 6H2O.
B) NH4Fe(SO4)2 * 12H2O.
C) FeSO4 * 7H2O.
D) К4[Fe(CN)6 ].
E) K2CrO4. +
645. Аргентометриялық титрлеудің Мор әдісімен тұндыру титрлеуді жүргізетін орта рН-ның мәні:
A) 1-2.
B) 3-5.
C) 4-6.
D) 7-10.
E) 11-13.
646. Аргентометриялық титрлеудің Мор әдісімен анықталатын иондар тобы:
A) Br-, Cl-, CN-.
B) I- , Cl-, CN-.
C) SCN-, Br-, CN-.
D) CN-, I-, SCN-.
E) I-, SCN-, S2-.
647. Аргентометриялық титрлеудің Мор әдісімен хлоридті анықтауда Ag + ионымен тұнба беретін иондар тобы:
A) PO43-, AsO43-, C2О42-.
B) Ва2+, PO43-, AsO43-.
C) Pb2+, C2О42-, AsO43-.
D) Bi2+, C2О42-, PO43-.
E) AsO43-, C2О42-, Са2+.
648. Аргентометриялық титрлеудің Мор әдісімен хлоридтерді анықтауда индикатордың CrO42- ионымен тұнба беретін катиондар тобы:
A) Ва2+, Pb2+, Bi2+.
B) Ва2+, PO43-, AsO43-.
C) Pb2+, C2О42-, AsO43-.
D) Bi2+, C2О42-, PO43-.
E) AsO43-, Bi2+, Ва2+.
649. Аргентометриялық титрлеудің Мор әдісімен Cl- ионын анықтауға кедергі келтіретін аниондар:
A) Na+ , K+ , CH3COO-
B) K+ , Na+ ,NO3-
C) NO3- ,Na+ ,CH3COO-
D) CH3COO- ,AsO43-, K+
E) PO43- , C2О42-, AsO43-
650. Аргенометриялық титрлеудің Фаянс тәсілінің индикаторлары – флуоресцеин және эозин:
A) Қышқылдық-негіздік.
B) Редокс.
C) Металлохромды.
D) Тұндыру.
E) Адсорбциялық.
651. Аргенометриялық тұндыру титрлеудің Фаянс әдісімен хлорид, иодид, тиоцианат иондарын эозин-индикаторын пайдаланып титрлеуді орындайды:
A) Қышқылдық ортада.
B) Күшті сілтілік ортада.
C) Бейтарап ортада.
D) Әлсіз сілтілік ортада.
E) Кез-келген ортада.
652. Аргенометрияның Фаянс әдісімен иодид-ионын анықтайтын тұндыру титрлеуін орындайды:
A) Тура.
B) Кері.
C) Орынбасу.
D) Реверсивті.
E) Сусыз.
653. Аргенометриялық тұндыру титрлеуде адсорбциялық индикаторларды пайдаланып титрлеу әдісі:
A) Физика-химиялық.
B) Мор.
C) Фольгард.
D) Фаянс.
E) Тотығу-тотықсыздану.
654. Тұндыру титрлеу қисығы:
A) Анықтайтын металдың концентрация көрсеткішінің қосылған титрант көлеміне байланысты өзгеруін көрсететін тәуелділік.
B) С – V(T).
C) М – V(T).
D) pM – f (титрлену дәрежесі).
E) E – V(T).
655. Титрлеу қисығында титрлеу секірмесінің ауданы ең үлкен болады:
A) Ks (AgI) = 8,3 * 10-17.
B) Ks (AgBr) = 5,3 * 10-13.
C) Ks (AgCl) = 1,8 * 10-10.
D) Ks (AgIO3) = 3,0 * 10-8.
E) Ks (Ag2 CrO4) = 3,0 * 10-12.
656. Тұндыру титрлеу әдісінің соңғы нүктесін анықтау дәлдігі жоғары болу үшін, түзілген тұнбалардың :
A) Ks < 1,0*10-10.
B) Ks > 1,0*10-10.
C) Ks ≤ 0.
D) Ks –ке тәуелді емес реакцияларды пайдаланады.
E) Ks > 0.
657. Тиоцианометриялық тұндыру титрлеудің AgNO3 + KSCN = КNO3 + AgSCN реакциясына негізделген тәсіл:
A) Гей-Люссак.
B) Фольгард.
C) Мор.
D) Кинетикалық.
E) Фаянс.
658. Тұндыру титрлеудің тиоцианометрия әдісінің титранты:
A) NH4SCN.
B) NaCl.
C) AgNO3.
D) K2CrO4.
E) KCl.
659. Тиоцианометриялық титрлеуде NH4SCN немес KSCN жұмысшы ерітіндісін стандарттайтын қосылыс:
A) NaCl.
B) HNO3
C) NH4Fe(SO4)2 * 12 H2O
D) AgNO3.
E) AgCl.
660. Күміс нитратының концентрациясын және титрін анықтауға қолданатын тұндыру титрлеу әдісі:
A) Оксидиметрия.
B) Алкалиметрия.
C) Ацидиметрия.
D) Потенцометрия.
E) Тиоцианометрия.
661. Тиоцианометриялық титрлеуде галогенидтерді сандық анықтау әдісі:
A) Фольгард әдісі.
B) Фаянс.
C) Мор.
D) Гей-Люссак.
E) Физика-химиялық.
662. Тұндыру титрлеудің Фольгард тәсілінің тура титрлеу арқылы күшті қышқылдық ортада анықтайтын ион:
A) Cl-.
B) Ag+.
C) CN-.
D) SCN-.
E) Br-.
663. Тұндыру титрлеудің Фольгард тәсілімен кері титрлеу арқылы анықтайтын иондар тобы:
A) Br-, Cl-.
B) Br-, Ag+.
C) Cl-, Ag+.
D)Ag+, I-.
E) SCN-, Ag+.
664. Тұндыру титрлеудің Фольгард тәсілімен бромид-ионын анықтайды:
A) Тура титрлеуімен.
B) Орынбасу титрлеуімен.
C) Кері титрлеуімен.
D) Жанама титрлеуімен.
E) Реверсивті титрлеуімен
665. Фольгард әдісімен күміс ионын анықтайтын реакцияның иондық теңдеуі:
A) Ag+ + SCN- = AgSCN.
B) Ag+ + CN- = AgCN.
C) Ag+ + Cl- = AgCl.
D) 2Ag+ + CrO42- = Ag2CrO4.
E) Hg22+ + 2Cl- = Hg2Cl2.
666. Тұндыру титрлеудің Фольгард әдісінің индикаторының формуласы:
A) (NH4)2Fe(SO4)2 * 6H2O.
B) NH4Fe(SO4)2 * 12H2O.
C) FeSO4 * 7H2O.
D) К4[Fe(CN)6].
E) K2CrO4 .
667. Тиоцианометриялық титрлеумен галагенидтерді анықтауды орындауға болмайды:
A) Қышқылдық ортада.
B) Ва2+, Pb2+, Bi2+ иондары қатысында.
C) Тотықтырғыштар қатысында.
D) NH4Fe(SO4)2 * 12H2O индикаторы қатысында.
E) Кері титрлеу тәсілімен.
668. Қышқылдық ортада Cl- ионын сандық анықтайтын аргентометриялық титрлеу әдісінің түрі:
A) Фольгард әдісі.
B) Фаянс.
C) Мор.
D) Гей-Люссак.
E) Физика-химиялық.
669. Қышқылдық немесе сілтілік ортада адсорбциялық индикаторларды пайдаланып SCN- , Br-, I- иондарын сандық анықтайтын аргентометриялық титрлеу әдісінің түрі:
A) Фольгард әдісі.
B) Фаянс.
C) Мор.
D) Гей-Люссак.
E) Физика-химиялық.
670. Тұндыру титрлеуде NH4SCN немесе КSCN ерітінділерінің титрін анықтайтын қосылыс:
A) Hg(NO3)2.
B) Hg2(NO3)2.
C) AgNO3.
D) NaCl.
E) КNO3.
671. Аргенометриялық титрлеудің Фаянс әдісімен хлоридтерді анықтауда қолданатын индикатор:
A) Калий хроматы.
B) Эозин.
C) Мурексид.
D) Хромоген қара.
E) Флуоресцеин.
672. Фаянс әдісімен бромидтерді, иодидтерді, тиоцианиттерді қышқылдық ортада анықтауға қолданатын индикатор:
A) Калий хроматы.
B) Эозин.
C) Темір-аммоний ашутасы.
D) Хромоген қара.
E) Фенолфталеин.
673. Тиацианометриялық тұндыру титрлеудің Фольгард тәсіліндегі индикатор - Fe (III) тұзы:
A) Металлохромды.
B) Редокс.
C) Адсорбциялық.
D) Қышқылдық-негіздік.
E) Тотығу-тотықсыздану.
674. Тұндыру титрлеудің меркурометрия әдісінің титранты:
A) Hg2Cl2.
B) HgCl2.
C) HgSO4.
D) Hg(NO3)2.
E)Hg2(NO3)2.
675. Тұндыру титрлеудің меркуриметрия әдісінің титранты:
A) Hg2Cl2.
B) HgCl2.
C) HgSO4.
D) Hg(NO3)2.
E) Hg2(NO3)2.
676. с(NаCl) = 0,1 моль/л натрий хлориді ерітіндісі с(AgNO3) = 0,1 моль/л күміс нитраты ерітіндісімен титрлеудің (Ks(AgCl) ≈ 10-10) бастапқы нүктесіндегі [Cl-]-ионының концентрациясы:
A) 10-1.
B) 10-3.
C) 10-5.
D) 10-7.
E) 10-9.
677. с(NаCl) = 0,1 моль/л натрий хлориді ерітіндісі с(AgNO3) = 0,1 моль/л күміс нитраты ерітіндісімен титрлеудің (Ks(AgCl) ≈ 10-10) бастапқы нүктесіндегі хлорид ионының концентрациялық көрсеткіші (pCl):
A) 1 .
B) 3.
C) 5.
D) 7.
E) 9.
678. Натрий хлоридінің с(NаCl) = 0,1 моль/л ерітіндісі күміс нитратының с(AgNO3) э= 0,1 моль/л ерітіндісімен титрлеудің (Ks(AgCl) ≈ 10-10) бастапқы нүктесіндегі [Ag+]- ионының концентрациясы:
A)10-1.
B) 10-3.
C) 10-5.
D) 10-7.
E) 10-9. +
679. Натрий хлоридінің с(NаCl) = 0,1 моль/л ерітіндісі күміс нитратының с(AgNO3) э= 0,1 моль/л ерітіндісімен титрлеудің (Ks(AgCl) ≈ 10-10) бастапқы нүктесіндегі күміс ионының концентрациялық көрсеткіші (pAg):
A) 1.
B) 3.
C) 5.
D) 7.
E) 9.
680. Көлемі 100 мл с(NаCl) = 0,1 моль/л ерітіндісі күміс нитратының көлемі 100 мл
с(AgNO3) = 0,1 моль/л ерітіндісімен (Ks(AgCl) ≈ 10-10) титрленгенде эквивалентті нүктедегі
[Cl-] - ионының концентрациясы (моль/л):
A)10-1.
B) 10-3.
C) 10-5.
D) 10-7.
E) 10-9.
681. Көлемі 100 мл с(NаCl) = 0,1 моль/л ерітіндісі күміс нитратының көлемі 100 мл
с(AgNO3) = 0,1 моль/л ерітіндісімен (Ks(AgCl) ≈ 10-10) титрленгенде эквивалентті нүктедегі
хлорид ионының концентрациялық көрсеткіші (pCl) :
A) 1.
B) 3.
C) 5.
D) 7.
E) 9.
682. Көлемі 100 мл C(NаCl) = 0,1 моль/л ерітіндісіне көлемі 100 мл С(AgNO3) = 0,1 моль/л ерітіндісі (Ks(AgCl) ≈ 10-10) қосылды. Эквиваленттік нүктедегі [Ag+]-ионының концентрацияcы:
A) 10-1.
B) 10-3.
C) 10-5.
D) 10-7.
E) 10-9.
683. Көлемі 100 мл C(NаCl) = 0,1 моль/л ерітіндісіне көлемі 100 мл С(AgNO3) = 0,1 моль/л ерітіндісі (Ks(AgCl) ≈ 10-10) қосылды. Эквиваленттік нүктедегі күміс ионының концентрациялық көрсеткіші (pAg):
A) 1.
B) 3.
C) 5.
D) 7.
E) 9.
684. Тұндыру титрлеу әдісінің дәлдігі тәуелді емес:
A) Анықтайтын қосылыстың аморфты тұнба түзуіне.
B) Титрлеудің соңғы нүктесін анықтау дәлдігіне.
C) Тұнбаның ерігіштік көбейтіндісіне.
D) Тұнбаның ластану дәрежесі – адсорбция құбылысына.
E) Түзілетін тұнбаның Ks 1,0*10-10.
685. Жұмысшы ерітінді ретінде сынап (II) тұзы қолданатын тұндыру титрлеу әдісі:
A) Меркуриметрия. +
B) Тиоцианометрия.
C) Меркурометрия.
D) Тиоцианометрия.
E)Аргентометрия.
686. Жұмысшы ерітінді ретінде сынап (I) тұзы қолданатын тұндыру титрлеу әдісі:
A) Меркуриметрия.
B) Тиоцианометрия.
C) Меркурометрия. +
D) Тиоцианометрия.
E) Аргентометрия.
687. Тұндыру титрлеуі қисығының маңызы:
A) Титрлеу әдісін сандық талдауда пайдалану мүмкіндігін анықтау.
B) Аықтайтын заттың концентрациясын есептеу.
C) Эквивалентті нүктені индикаторсыз табу мүмкіндігін анықтау.
D) Эквивалентті нүктені физика-химиялық әдістермен табу мүмкіндігін анықтау .
E) Титрлеуді сапалық талдауда пайдалану мүкіндігін анықтау.
688. Қышқылдық ортада хлорид ионын анықтау үшін аргентометриялық титрлеуде қолданатын тәсіл:
A) Фольгард.
B) Мор.
C) Фаянс.
D) Гей-Люссак.
E) Тең лайлану.
689. Меркурометриялық тұндыру титрлеуі негізделген реакция:
A)
2Cl-
+
 → Hg2Cl2.
→ Hg2Cl2.
B) 2Cl- + Hg2+ → НgCl2.
C) 2Br- + Hg2+ → НgBr2.
D) 2I- + Hg2+ → НgI2.
E) Cl- + Аg+ → АgCl.
690. Меркуриметриялық тұндыру титрлеуі негізделген реакция:
A) 2Cl- + Hg2+ → Hg2Cl2.
B) 2Cl- + Hg2+ → НgCl2.
C) 2Br- + Hg2+ → НgBr2.
D) 2I- + Hg2+ → НgI2.
E) Cl- + Аg+ → АgCl.
Комплексонометриялық титрлеу
691. M2+ + H2Υ2- = MΥ2- + 2H+ реакциясына негізделген титрлеу әдісі:
A) Қышқылдық-негіздік.
B) Тұндыру.
C) Бейтараптану.
D) Тотығу-тотықсыздану.
E) Комплексонометриялық.
692. Комплексон –I :
A) H3Y.
B) H4Y.
C) Na2H2Y * H2O
D) HY3-.
E) HY.
693. Комплексон –II :
A) H3Y.
B) H4Y.
C) Na2H2Y * 2H2O.
D) HY3-.
E) HY.
694. Комплекснометриялық титрлеу негізделген:
А) Кейбір металл катиондарының комплексондармен нашар ионданатын, тұрақты, суда жақсы
еритін комплексті тұздар түзуіне.
В) Кейбір металл катиондарының комплексондармен толық ионданатын, тұрақсыз
комплексті тұздар түзуіне.
С) Кейбір металл катиондарының комплексондармен толық ионданатын, суда нашар еритін
комплексті тұздар түзуіне.
D) Кейбір металл катиондарының комплексондармен тұрақты, суда нашар еритін комплексті
тұздар түзуіне.
Е) Кейбір металл катиондарының комплексондармен тұрақсыз, суда нашар еритін комплексті
тұздар түзуіне.
695. Комплексон-III ерітіндісін стандарттауға қолданатын бастапқы зат:
A) Na2CO3.
B) K2Cr2O7.
C) I2.
D) MgSO4 * 7H2O.
E) CaSO4.
696. ЭДТА көптеген металл иондарымен түзеді:
A) Суда ерімейтін ішкікомплексті тұздар.
B) Суда еритін, берік ішкікомплексті тұздар.
C) Суда ерімейтін, тұрақсыз ішкікомплексті қосылыстар.
D) Суда ерімейтін, түсті ішкікомплексті қосылыстар.
E) Түссіз, тұрақсыз, суда ерімейтін ішкікомплексті қосылыстар.
697. Комплекснометриялық титрлеуде индикатор ретінде қолданады:
А) +Металдармен түзетін комплекстерінің беріктігі сәйкес металл комплексонаттарына
қарағанда төмен болатын металлиндикаторлар.
В) Металдармен түзетін комплекстерінің беріктігі сәйкес металл комплексонаттарына
қарағанда жоғары болатын металлиндикаторлар.
С) Металдармен түзетін комплекстерінің беріктігі сәйкес металл комплексонаттарына
беріктігімен бірдей болатын металлиндикаторлар.
D) Металдармен түзетін комплекстерінің беріктігі ешқандай роль атқармайтын
металлиндикаторлар.
Е)
697. ЭДТА төрт протонды қышқыл болғандықтан төрт сатымен ионданады, рН >11 ортадағы
оның анионы:
A) H2Y2-.
B) Ү4-.
C) H3Y-.
D) HY3-.
E) HY.
698. Комплексонометриялық талдауда металл иондарын анықтаудағы комплексон
ІІІ-тің (Na2H2Y*2H2O) эквиваленттік факторы:
A)

B)

C)

D)

E)

699. Комплексонометриялық талдауда титрленетін көп зарядты металл иондарының эквиваленттік факторы:
A)
B)
C)
D)
E)
700. Магнийді комплексонометриялық анықтаудағы комплексон (ІІІ)-тің эквиваленттік
факторы:
A) 1/2.
B) 1/6.
C) 1/1.
D) 1/4.
E) 1/5.
701. Са2+ + Υ4-→ СаΥ2- реакциясынан түзілетін комплекстің тұрақтылық
константасының өрнегі:
A)
B)
C)
D)

E)

702. lgβ мәні бойынша Трилон-Б мен тұрақтырақ комплексті қосылыс түзетін ион:
A) Са, lgβ = 9,3.
B) Ba, lgβ = 6,2.
C) Mg, lgβ = 8,5.
D) Sr, lgβ = 7,1.
E) Zn, lgβ = 13,5.
703. Металлохромды индикаторлар – бұл органикалық қосылыстар, анықтайтын металл
иондарымен түзеді:
A) Түсті комплекстер.
B) Металдық тұнбалар.
C) Ақ тұнбалар.
D) Газ тәрiздi өнiмдер.
E) Балқымалар.
704. Металлохромды индикаторға қойылатын талаптарды қанағаттандырмайтын шарт:
A) рН-тың белгілі бір мәнінде индикатордың металл ионымен М:Ind = 1:1 қатынаста түзілген комплексті қосылысының шартты тұрақтылық константасы β(МInd) металл ионының ЭДТА-ымен түзілген комплексті қосылысының шартты тұрақтылық константасынан β(MΥ2-) кіш болуы тиісті β(МInd) > β(MΥ2-.
B) Индикатордың металл ионымен беретін комплексті қосылысы ЭДТА-ымен әсер еткенде тез бұзылу тиісті.
C) рН-тың белгілі бір мәнінде индикатордың металл ионымен М:Ind = 1:1 қатынаста түзілген комплексті қосылысы тұрақсыз болуы тиісті.
D) Титрлеудің соңғы нүктесінде ірітінді түсінің өзгеруі айқын байқалуы тиісті.
E) рН-тың белгілі бір мәнінде индикатордың металл ионымен М:Ind = 1:1 қатынаста түзілген комплексті қосылысының шартты тұрақтылық константасы β(МInd) металл ионының ЭДТА-ымен түзілген комплексті қосылысының шартты тұрақтылық константасы β(MΥ2-) үлкен болуы тиісті β(МInd) < β(MΥ2-.
705. Металлохромды индикаторлар қойылатын талаптарды қанағаттандырмайтын шарт:
A) Эквивалентті нүктеде түстің ауысуы өте айқын болуы тиісті.
B) Анықталатын зат металлохромды индикатормен түсті қосылыс беруі керек.
C) Индикатордың ерiтiндiдегi концентрациясының қатынасы CHInd/CMen+ >10-2 аспауы керек.
D) Анықталатын металл ионына индикатордың әсерi инерттi болуы керек.
E) Титрлеудiң соңғы нүктесiнде түстiң ауысуы байқалмауы қажет.
706. Комплексонометриялық титрлеу қисығындағы кез келген титрлеу нүктесінің тепе-теңдік концентрациясын есептеуде пайдаланатын шама:
A) Kтұрақсыз.
B) Kb.
C) KS.
D) β.
E) S.
707. Эриохром-қара индикаторы жататын индикатор түрі:
A) Қышқылдық-негіздік.
B) Адсорбциялық.
C) Металлохромды.
D) Редокс.
E) Тұндыру.
708. Мурексид индикаторы:
A) Қышқылдық-негіздік.
B) Адсорбциялық.
C) Металлохромды.
D) Редокс.
E) Тұндыру.
708. Комплексонометриялық анықтаулардағы металлохромды индикатор:
A) Ксиленолды сарғыш қызыл.
B) Крахмал.
C) Фенолфталеин.
D) Метилді қызылы.
E) Дифениламин.
709. Металлохромды индикаторға жатпайды:
A) Мурексид.
B) Темір (III) тұзы..
C) Ксиленолды сарғыш қызыл.
D) Фенолфталеин.
E) Эриохром қара.
710. Кальций мен магний иондары қоспасынан кальцийді комплексонометриялық титрлеу тәсілімен анықтауда қолданатын индикатор:
A) Мурексид.
B) Хромоген қара.
C) Фенолфталеин.
D) Темір (III) тұзы.
E) Ксиленолды сарғыш қызыл.
711. Кальций мен магний иондары қоспасын хромоген қара индикаторы қатысында Трилон-Б мен титрлегенде:
A) Тек Са2+ иондары титрленеді.
B) Са2+ және Mg2+ иондары бірге титрленеді.
C) Тек Mg2+ иондары титрленеді.
D) Са2+ және Mg2+ иондары бірге титрленбейді.
E) Магний ионы тұнбада болады.
712. Кальций мен магний иондары қоспасына сілті қосылғаннан кейінгі ерітіндіні мурексид индикаторы қатысында Трилон-Б-мен титрлегенде:
A) Са2+ иондары титрленеді.
B) Са2+ және Mg2+ иондары бірге титрленеді.
C) Тек Mg2+ иондары титрленеді.
D) Mg2+ иондары тұнбада болады.
E) Кальций ионы тұнбада болады.
713. Трилон-Б-мен Са2+ және Mg2+ иондары қоспасынан екі ион бірге титрленетін жағдайда қолданатын индикатор:
A) Мурексид.
B) Хромоген қара.
C) Фенолфталеин.
D) Метил қызылы.
E) Дифениламин.
714. Са2+ және Mg2+ иондары қоспасынан сілті қатысында кальций ионы Трилон-Б-мен титрленетін жағдайда қолданатын индикатор:
A) Мурексид.
B) Хромоген қара.
C) Фенолфталеин.
D) Метил қызылы.
E) Дифениламин.
715. Судың кермектілігін комплексонометриялық анықтауда қолданатын титрлеу тәсілі:
А) Орынбасу.
В) Кері.
С) Тура.
D) Жанама.
Е) Реверсивті
716.
 ионы
комплексонатының формуласын көрсетіңіз:
ионы
комплексонатының формуласын көрсетіңіз:
А)
[ ]
]
В)+
[
С)
[
D)
[
Е)
 .
.
717.
 ионы
комплексонатының формуласын көрсетіңіз:
ионы
комплексонатының формуласын көрсетіңіз:
А) [ ]
В)
+[
С) [
D) [
Е) .
718. Кальцийді комплексонометриялық анықтаудағы ерітінді рН-ның мәні:
A) 1-2.
B) 3-4.
C) 5-6.
D) 6-7.
E) 8-10.
719. Са2+ және Mg2+ иондарын комплексонометриялық тәсілмен анықтауда қолданатын буферлік жүйе:
A) HCOOH + HCOONa.
B) CH3COOH + CH3COONa.
C) NaH2PO4 + Na2HPO4.
D) NH4OH + NH4Cl.
E) H2CO3 + NaHCO3.
720. Қоспадан бірнеше металл иондарын комплексонометриялық тәсілмен анықтауға болады, егер металл иондарының шартты тұрақтылық константа көрсеткіштері арасындағы айырмашылық:
A) Төрт бірліктен артық болса.
B) Төрт бірліктен кем болса.
C) Төрт бірлікке тең болса.
D) Бір бірліктен кем болса.
E) Бір бірлікке тең болса.

