
- •1. Механическое движение. Относительность движения. Равномерное и равноускоренное движение.
- •2. Задача на применение закона сохранения массового числа и электрического заряда.
- •1. Взаимодействие тел. Сила. Законы динамики Ньютона.
- •2. Лабораторная работа «Измерение показателя преломления стекла».
- •2. Задача на определение периода и частоты свободных колебаний в колебательном контуре.
- •Закон всемирного тяготения. Сила тяжести. Вес тела. Невесомость.
- •2. Задача на применение первого закона термодинамики.
- •1. Превращение энергии при механических колебаниях. Свободные и вынужденные колебания. Резонанс.
- •2. Лабораторная работа «Расчёт и измерение сопротивления двух параллельно соединенных резисторов».
- •1. Опытное обоснование основных положений молекулярно-кинетической теории строения вещества. Масса и размер молекул.
- •2. Задача на движение или равновесие заряженной частицы в электрическом поле.
- •1. Идеальный газ. Основное уравнение мкт идеального газа. Температура и ее измерение. Абсолютная температура.
- •2. Задача на определение индукции магнитного поля (по закону Ампера или по формуле для расчета силы Лоренца).
- •1. Уравнение состояния идеального газа (Уравнение Менделеева- Клапейрона). Изопроцессы.
- •2. Задача на применение уравнения Эйнштейна для фотоэффекта.
- •1. Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха. Измерение влажности воздуха.
- •2. Лабораторная работа «Измерение длины волны с использованием дифракционной решетки».
- •1. Кристаллические и аморфные тела. Упругие и пластические деформации твердых тел.
- •2. Задача на определение показателя преломления прозрачной среды.
- •1. Внутренняя энергия. Первый закон термодинамики. Применение первого закона к изопроцессам. Адиабатный процесс.
- •2. Задача на применение закона электромагнитной индукции.
- •1. Взаимодействие заряженных тел. Закон Кулона. Закон сохранения электрического заряда.
- •2. Задача на применение закона сохранения энергии.
- •2. Задача на применение уравнения состояния идеального газа.
- •1. Работа и мощность в цепи постоянного тока. Электродвижущая сила. Закон Ома для полной цепи.
- •2. Лабораторная работа «Измерение массы тела».
- •2. Лабораторная работа «Измерение влажности воздуха».
- •2. Задача на применение графиков изопроцессов.
- •1. Электромагнитная индукция. Закон электромагнитной индукции. Правило Ленца.
- •2. Задача на определение работы газа с помощью графика зависимости давления газа от его объема.
- •1. Явление самоиндукции. Индуктивность. Электромагнитное поле.
- •2. Задача на определение силы упругости.
- •1. Свободные и вынужденные электромагнитные колебания. Колебательный контур и превращение энергии при электромагнитных колебаниях.
- •2. Задача на применение закона Джоуля- Ленца.
- •1. Электромагнитные волны и их свойства. Принципы радиосвязи и примеры их практического использования.
- •2. Лабораторная работа «Измерение мощности лампочки накаливания».
- •2. Задача на применение закона Кулона.
- •1. Опыты Резерфорда по рассеянию α-частиц. Ядерная модель атома. Квантовые постулаты Бора.
- •2. Лабораторная работа «Измерение удельного сопротивления материала, из которого сделан проводник».
- •1. Испускание и поглощение света атомами. Спектральный анализ.
- •2. Лабораторная работа «Измерение эдс и внутреннего сопротивления источника тока с использованием амперметра и вольтметра».
- •1. Фотоэффект и его законы. Уравнение Эйнштейна для фотоэффекта и постоянная Планка. Применение фотоэффекта в технике.
- •1. Состав ядра атома. Изотопы. Энергия связи ядра атома. Цепная ядерная реакция, условия ее осуществления. Термоядерные реакции.
- •2. Лабораторная работа «Расчет общего сопротивления двух последовательно соединенных резисторов».
- •1. Радиоактивность. Виды радиоактивных излучений и методы их регистрации. Биологическое действие ионизирующих излучений.
- •2. Лабораторная работа «Оценка массы воздуха в классной комнате при помощи необходимых измерений и расчетов».
2. Задача на определение индукции магнитного поля (по закону Ампера или по формуле для расчета силы Лоренца).
Билет №8.
1. Уравнение состояния идеального газа (Уравнение Менделеева- Клапейрона). Изопроцессы.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для
произвольной массы газа состояние газа
описывается уравнением Менделеева-
Клапейрона:
![]() ,
,
где р- давление, V- объем, m- масса, М- молярная масса, R- универсальная газовая постоянная R = 8,31 Дж/(моль∙К).
Уравнение Менделеева- Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре: Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным
называют процесс, протекающий при
постоянном объеме: V
= const.
Для него справедлив закон
Шарля:
![]() .
.
Изобарным
называют процесс, протекающий при
постоянном давлении: р
= const.
Уравнение этого процесса имеет вид
![]() и
называется законом
Гей-Люссака.
и
называется законом
Гей-Люссака.
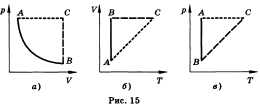
Рисунок
1
Все процессы можно изобразить графически (рис. 1).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях и при не слишком низких температурах, т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
2. Задача на применение уравнения Эйнштейна для фотоэффекта.
Билет №9.
1. Испарение и конденсация. Насыщенные и ненасыщенные пары. Влажность воздуха. Измерение влажности воздуха.
Существует два способа перехода жидкости в газообразное состояние: испарение и кипение.
Испарение — явление превращения жидкости в пар, происходящее при любой температуре со свободной поверхности жидкости.
При испарении обладающие достаточной скоростью частицы (т.е. имеющие большую кинетическую энергию) и достигшие поверхности отрываются от нее и превращаются в пар. При испарении внутренняя энергия пара больше, чем жидкости, из которой происходит испарение, т.к. для перехода в пар частицам жидкости нужна энергия для преодоления сил межмолекулярного притяжения.
При испарении частицы уносят часть энергии, у оставшихся частиц энергия уменьшается, и температура жидкости понижается. Скорость испарения зависит от нескольких причин: от рода жидкости, от температуры жидкости, от площади свободной поверхности жидкости, от наличия ветра.
Кипение - интенсивное испарение, происходящее не только с поверхности, но и по всему объему жидкости при определенной постоянной температуре, которая называется температурой кипения.
Температура кипения остается постоянной до тех пор, пока вся жидкость не перейдет в пар.
Процесс, обратный испарению, - конденсация. Конденсация — процесс перехода вещества из газообразного состояния в жидкое. Конденсация происходит при той же температуре, при которой жидкость кипит. Конденсация сопровождается выделением энергии. Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.) Пар, находящийся при давлении ниже насыщенного, называют ненасыщенным.
Вследствие постоянного испарения воды с поверхностей водоемов, почвы и растительного покрова, а также дыхания человека и животных в атмосфере всегда содержится водяной пар. Поэтому атмосферное давление представляет собой сумму давления сухого воздуха и находящегося в нем водяного пара.
Под влажностью воздуха понимают содержание водяных паров в воздухе. Изучают абсолютную и относительную влажность воздуха.
Абсолютной влажностью воздуха называют количество водяных паров, содержащихся в 1 м3 объема.
![]() .
.
Относительной влажностью воздуха называют отношение абсолютной влажности воздуха к тому количеству водяного пара, которое необходимо для насыщения 1 м3 воздуха при данной температуре.
![]() .
.
Большинство явлений, наблюдаемых в природе, например быстрота испарения, высыхание различных веществ, увядание растений, зависит не от количества водяного пара в воздухе, а от того, насколько это количество близко к насыщению, т. е. от относительной влажности, которая характеризует степень насыщения воздуха водяным паром. При низкой температуре и высокой влажности повышается теплопередача и человек подвергается переохлаждению. При высоких температурах и влажности теплопередача, наоборот, резко сокращается, что ведет к перегреванию организма. Наиболее благоприятной для человека в средних климатических широтах является относительная влажность 40—60%. Точкой росы называют температуру, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара.
Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами.
