
- •Набор по трансформации бактерий плазмидой pGlo
- •1. Экспериментальные моменты
- •2. Теоретические моменты
- •Приготовьте питательный агар
- •Приготовьте арабинозу и ампициллин
- •Подпишите чашки
- •Залейте чашки
- •Хранение чашек
- •Растворите лиофилизованный штамм бактерий
- •Рассейте бактерии штрихом по «стартовым» чашкам
- •Приготовьте плазмиду pGlo
- •Приготовьте аликвоты (порции) растворов
- •Подготовьте рабочие места для лабораторной работы по трансформации
- •104 Трансформантов/мкг
- •1.2∙103 Трансформантов/мкг
- •Определите общее число трансформированных клеток
- •Определите количество плазмидной днк, добавленной в клетки, нанесенные на чашку lb/amp/ara
- •5∙103 Трансформантов/мкг (5 умножить на 1000)
- •2.6∙103 Трансформантов/мкг (2.6 умножить 1000)
Приготовьте плазмиду pGlo
Возьмите чистую стерильную пипетку и перенесите 250 мкл трансформационного раствора во флакон с сухой плазмидой. ДНК очень мало, поэтому вам может показаться, что во флаконе ничего нет. Переверните несколько раз флакон, чтобы хорошо перемешать содержимое и убедиться, что ДНК растворилась и не прилипла к крышке. Храните растворенную ДНК в холодильнике. .(раствор для трансформации используется здесь только потому, что это стерильный раствор, имеющийся в составе набора. Вместо него можно использовать стерильную воду, если она есть в наличии).

Шаг 3: непосредственно перед началом работы
Приготовьте аликвоты (порции) растворов
Для каждого рабочего места отлейте по 1 мл растворов CaCl2 и LB в отдельные цветные микроцентрифужные пробирки, входящие в состав этого набора. Если среда LB разливается за день до начала работы, ее нужно поместить в холодильник. Подпишите пробирки
Подготовьте рабочие места для лабораторной работы по трансформации
(см. список для подготовки рабочих мест)
Лабораторный протокол в картинках
В

 озьмите
две закрытые микроцентрифужные пробирки.
Напишите на одной микроцентрифужной
пробирке +pGLO,
на другой –pGLO,
а также ваш класс и фамилию. Поставьте
пробирки в штатив.
озьмите
две закрытые микроцентрифужные пробирки.
Напишите на одной микроцентрифужной
пробирке +pGLO,
на другой –pGLO,
а также ваш класс и фамилию. Поставьте
пробирки в штатив.
Откройте пробирки и чистой одноразовой пипеткой добавьте по 250 мкл раствора для трансформации (CaCl2) в каждую пробирку.
Поставьте пробирки в крошеный лед или снег (не используйте лед кубиками)
С
 помощью стерильной петли, возьмите
одну колонию с вашей «стартовой» чашки.
Возьмите пробирку «+pGLO»
и погрузите петлю в трансформационный
раствор на дне пробирки. Покрутите
петлю между большим и указательным
пальцами, чтобы вся колония равномерно
размешалась в буфере (без плавающих
комков). Поставьте пробирку обратно на
лед. Возьмите новую петлю и повторите
процедуру для пробирки «-pGLO»
помощью стерильной петли, возьмите
одну колонию с вашей «стартовой» чашки.
Возьмите пробирку «+pGLO»
и погрузите петлю в трансформационный
раствор на дне пробирки. Покрутите
петлю между большим и указательным
пальцами, чтобы вся колония равномерно
размешалась в буфере (без плавающих
комков). Поставьте пробирку обратно на
лед. Возьмите новую петлю и повторите
процедуру для пробирки «-pGLO»Р
 ассмотрите
раствор плазмиды pGLO
под ультрафиолетом. Запишите ваши
наблюдения. Окуните новую стерильную
петлю в раствор плазмиды. Выньте петлю.
На кольце должна быть натянута пленка
плазмиды (как пленка мыльного раствора
на кольце, когда вы выдуваете пузыри).
Помешайте петлей суспензию клеток в
пробирке «+pGLO».
(если у вас есть микропипетка, добавьте
10 мкл раствора плазмиды микропипеткой
и перемешайте). Закройте пробирку и
верните ее обратно на лед. Не добавляйте
ДНК в пробирку «-pGLO».
Почему туда не надо добавлять ДНК?
ассмотрите
раствор плазмиды pGLO
под ультрафиолетом. Запишите ваши
наблюдения. Окуните новую стерильную
петлю в раствор плазмиды. Выньте петлю.
На кольце должна быть натянута пленка
плазмиды (как пленка мыльного раствора
на кольце, когда вы выдуваете пузыри).
Помешайте петлей суспензию клеток в
пробирке «+pGLO».
(если у вас есть микропипетка, добавьте
10 мкл раствора плазмиды микропипеткой
и перемешайте). Закройте пробирку и
верните ее обратно на лед. Не добавляйте
ДНК в пробирку «-pGLO».
Почему туда не надо добавлять ДНК?

Держите пробирки на льду в течение 10 минут. Убедитесь в том, что вы засунули пробирки достаточно глубоко в штатив, так что их нижняя часть погружена в лед.

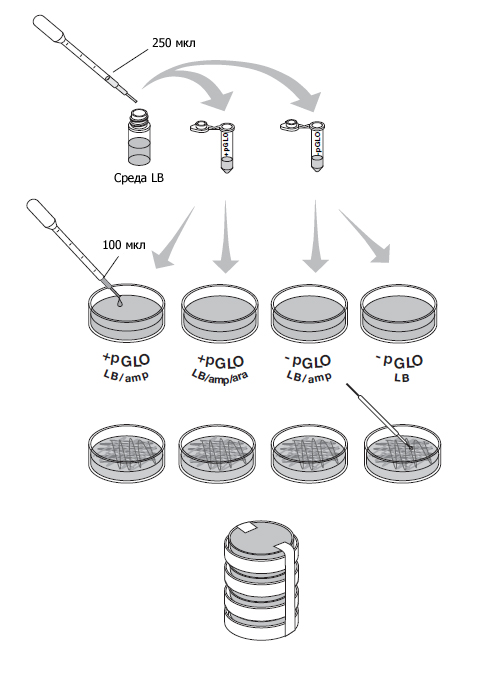
Пока пробирки стоят на льду, подпишите ваши четыре чашки на нижней стороне (не на крышке) как показано на картинке.

Т
 епловой
шок. Возьмите штатив с пробирками и
быстро перенесите его изо льда на
нагретую до 42ºС водяную баню РОВНО
на 50 секунд. Убедитесь, что пробирки
погружены в воду. Как только 50 секунд
пройдут, поставьте штатив обратно на
лед. Для хороших результатов важно
быстро
переместить пробирки изо льда (0ºС) на
водяную баню (42ºС) и потом обратно на
лед (0ºС). Подержите пробирки на льду
две минуты.
епловой
шок. Возьмите штатив с пробирками и
быстро перенесите его изо льда на
нагретую до 42ºС водяную баню РОВНО
на 50 секунд. Убедитесь, что пробирки
погружены в воду. Как только 50 секунд
пройдут, поставьте штатив обратно на
лед. Для хороших результатов важно
быстро
переместить пробирки изо льда (0ºС) на
водяную баню (42ºС) и потом обратно на
лед (0ºС). Подержите пробирки на льду
две минуты.
Снимите штатив со льда и поставьте на стол. Откройте первую пробирку, возьмите чистую стерильную пипетку и добавьте 250 мкл питательной среды LB в пробирку. Снова закройте ее. Повторите процедуру для второй пробирки, обязательно взяв новую стерильную пипетку. Перемешайте суспензию и оставьте на 10 мин на столе.
Легко встряхните пробирки пальцем, чтобы перемешать. Нанесите по 100 мкл суспензии из каждой на чашки, в соответствии с рисунком. Используйте новую стерильную пипетку для каждой пробирки.
Быстро размажьте суспензию по поверхности чашки с помощью стерильной петли. Используйте новую стерильную петлю для каждой чашки.
Сложите ваши чашки в стопку и склейте вместе скотчем. Напишите на дне нижней чашки ваши фамилии и класс, переверните стопку, и поставьте в термостат/оставьте на столе.
Ответы на вопросы
Вопросы к уроку 1
Чтобы генетически трансформировать целый организм, вы должны вставить новый ген (гены) в каждую клетку этого организма. Какой организм лучше подойдет для полной трансформации – многоклеточный или одноклеточный?
Одноклеточный организм лучше подходит для трансформации, потому что он состоит всего из одной клетки, куда надо поместить новые гены.
Ученые обычно хотят знать, может ли трансформированный организм передать свои признаки потомству, закрепятся ли они в ряду поколений. Чтобы узнать это, какой бы вы выбрали организм, который размножается и дает потомство быстро, или развивается более медленно?
Организм, который размножается быстро. Быстрое появление потомства позволит вам быстро узнать, передается ли по наследству приобретенный признак.
Безопасность также важна при выборе экспериментального организма. Какими характеристиками, по вашему мнению, должен обладать организм, чтобы быть уверенным в том, что он не навредит вам или окружающей среде?
Организм не должен производить никаких токсинов, или веществ, вызывающих болезни. Организм должен хорошо расти в лабораторных условиях, но не должен выживать вне лаборатории. Организм не должен быть способным заражать растений или животных.
Опираясь на эти соображения, какой из перечисленных организмов лучше всего подойдет для трансформации: бактерия, дождевой червь, рыба или мышь? Аргументируйте ваш ответ
Лучше всего подойдет бактерия. Бактерии это маленькие одноклеточные организмы, которые быстро и легко размножаются.
Примечание: бактерия Escherichia coli (E. coli) HB101 K-12 идеально отвечает всем вышеизложенным требованиям. Она состоит из одной клетки, в благоприятных условиях делится каждые 20 минут, не вызывает болезней и не может жить вне лабораторных условий.
5. Вспомните, что цель генетической трансформации – изменить какие-то признаки (фенотип) организма. Чтобы заметить произошедшие изменения, надо сперва тщательно изучить признаки организма до трансформации. Посмотрите на колонии E. coli на чашке. Напишите, какие черты или признаки можно описать.
Цвет колоний, форма, число колоний, распределение колоний на чашке.
6. Как вы могли бы с помощью двух чашек c LB-агаром, E. coli и ампициллина определить оказывает ли ампициллин эффект на рост на E. coli?
Нужно рассеять равные количества клеток на две чашки, одна из которых содержит просто среду LB, а другая – среду LB с ампициллином. Далее нужно сравнить число колоний, выросших на чашках. Если ампициллин замедляет рост E. coli, число колоний на чашке с ампициллином должно быть меньше. Если он не оказывает эффекта, число колоний должно быть примерно одинаковым.
7. Как вы думаете, что ваши экспериментальные данные скажут о действии ампициллина на E. coli?
Антибиотики обычно убивают бактерий (бактерицидное действие) или останавливают их рост (бактериостатическое действие). Поэтому на чашке с ампициллином не должно быть колоний. Присутствие колоний на чашке с ампициллином означает, что конкретно эти бактерии приобрели устойчивость к антибиотику.
Вопросы к уроку 2
На какой из засеянных чашек вы ожидаете увидеть бактерий, наиболее похожих на исходные колонии, которые вы брали для трансформации? Объясните ваш ответ
Бактерии, похожие на исходные, должны расти на чашке LB/(-)pGLO. Эти бактерии были взяты со «стартовой» чашки, к ним не была добавлена плазмида, и затем высеяны обратно на чашку LB. Соответственно, они должны быть практически идентичны исходным бактериям.
На какой чашке (чашках) вы ожидаете найти трансформированные клетки, если такие будут?
Трансформированные клетки должны находиться на чашках LB/amp и LB/amp/ara. Эти чашки были засеяны клетками, инкубированными с плазмидой pGLO. Генетически трансформированные клетки получили плазмиду и стали устойчивыми к ампициллину, таким образом, эти те клетки, которые выживают на чашках с антибиотиком.
Какие чашки нужно сравнивать между собой, для того, чтобы определить насколько удалась трансформация? Почему?
Нужно сравнивать чашки LB/amp/(-)pGLO и LB/amp/(+)pGLO. Чашки, не получившие ДНК pGLO не получили ген устойчивости к ампициллину и не должны расти на чашке с антибиотиком. Клетки, получившие плазмиду (+pGLO) экспрессируют ген устойчивости и растут на чашке с антибиотиком. Если какие-то из исходных клеток уже были устойчивы к ампициллину, они вырастут на обеих чашках.
Что означает понятие «контрольная чашка»? Для чего нужен контроль?
Контрольная чашка помогает вам интерпретировать результаты эксперимента. В этом эксперименте обе чашки (-) pGLO являются контрольными. Контрольную чашку LB/amp можно сравнить с чашкой LB/amp/(+)pGLO. Это сравнение показывает, что в результате трансформации (добавления плазмиды) образуются бактериальные колонии, способные расти на ампициллине. Контрольную чашку без ампициллина (-)pGLO/LB можно сравнить с любой из чашек, содержащих ампициллин, чтобы убедиться в том, что для роста в присутствии ампициллина необходима плазмида устойчивости. Чашка LB/amp/(-)pGLO также показывает, что стартовая культура не растет в присутствии ампициллина. Без этого контроля никто бы не мог быть уверен в том, что колонии, выросшие на чашке LB/amp/(+)pGLO действительно являются трансформантами.
Урок 3 Сбор и анализ данных
Осмотрите и зарисуйте, что вы видите на каждой чашке. Поместите ваши рисунки в таблицу с данными в колонку. Вы можете также сфотографировать чашки и поместить фотографии в ваш протокол. Запишите данные ваших наблюдений, чтобы сравнить клетки «+pGLO» с нетрансформированными клетками. (см. ниже)
Сравните рост бактерий на чашках
На обеих чашках с плазмидой pGLO (LB/amp/ara и LB/amp) должны быть множественные колонии (~75). На чашке LB/amp/(-)pGLO не должно быть колоний. На чашке LB/(-)pGLO должен быть сплошной слой бактерий (газон).
Какого цвета колонии бактерий?
Бактерии на чашках (+)pGLO LB/amp и и (-)pGLO/LB должны быть белыми. Бактерии на чашке (+)pGLO LB/amp/ara могут казаться белыми или зеленоватыми при обычном освещении, но должны светиться ярко-зеленым под ультрафиолетом.
Сосчитайте число колоний на каждой чашке (число отдельных точек)
На каждой из чашек (+)pGLO должно быть около 75 колоний. На чашке LB растет газон и сосчитать колонии невозможно.
Чашка |
Наблюдения |
+pGLO, LB/amp |
Много колоний трансформированных бактерий. (~75). Колонии белые |
+pGLO, LB/amp/ara |
Много колоний трансформированных бактерий. (~75). Колонии кажутся белыми при обычном освещении, но светятся ярко-зеленым под УФ |
-pGLO, LB/amp |
Нет роста бактерий |
-pGLO, LB |
Сплошной желтовато-белый слой бактерий |
Какие из первоначальных признаков, которые вы выделили у E. coli не изменились в результате трансформации? В пространстве внизу перечислите эти признаки и как вы пришли к этим выводам (результаты наблюдений)
Признак |
Анализ наблюдений |
Цвет |
Колонии белого цвета до и после трансформации |
Размер колоний |
Размер колоний одинаковый до и после трансформации |
Какие из признаков E. coli изменились в результате трансформации? Перечислите эти признаки и результаты наблюдений, из которых вы сделали ваши выводы.
Признак |
Анализ наблюдений |
Цвет |
Колонии на чашке LB/amp/ara светятся зеленым под ультрафиолетом |
Устойчивость к ампициллину |
Трансформированные клетки могут расти в присутствии ампициллина |
Если генетически трансформированные клетки приобрели устойчивость к антибиотику ампициллину, что можно предположить о генах, находящихся на плазмиде?
Плазмида должна содержать ген устойчивости к ампициллину, это ген bla, кодирующий белок бета-лактамазу, разрушающий ампициллин.
Как, исходя из ваших результатов, вы можете заключить, что наблюдаемые вами изменения являются следствием проведенной вами процедуры?
Лучший способ сделать это – сравнить контроль и опыт. Клетки, которые не получили плазмиду (-pGLO) не могут расти на ампициллине, тогда как, клетки содержащие плазмиду (+pGLO) могут расти на чашках LB/amp. Таким образом, плазмида придает клеткам устойчивость к ампициллину.
Вопросы к уроку 3
Что светится?
Вспомните, что вы наблюдали,когда смотрели на ДНК pGLO под ультрафиолетом. Опишите ваши наблюдения.
Образец плазмиды не флуоресцирует
Какие два возможных источника флуоресценции можно теперь исключить?
Можно исключить плазмидную ДНК и исходные бактерии в качестве возможных источников флуоресценции
Что говорит это наблюдение о возможном источнике флуоресценции?
Вероятно, источником флуоресценции является какой-то белок, кодируемый плазмидной ДНК.
Была ли ваша попытка генетической трансформации удачной или неудачной? Аргументируйте ваш ответ.
В случае удачного эксперимента на чашках LB/amp (+)pGLO и LB/amp/ara (+)pGLO должны вырасти колонии бактерий; на чашке LB/amp (-)pGLO не должно быть бактерий. Колонии на чашке LB/amp/ara должны флуоресцировать зеленым под Уф.
Отсутствие колоний на чашках (+)pGLO говорит о неудачной трансформации. Например, вы могли забыть добавить бактерии или плазмиду в пробирку «+pGLO» .
5. Посмотрите на ваши четыре чашки. Вы видите рост бактерий на чашках LB, не содержащих ампициллин и арабинозу?
Да. Бактерии не получившие плазмиду, растут на среде LB без антибиотика.
6. Можете ли вы сказать, глядя на чашку LB, являются ли растущими на ней бактерии устойчивыми к ампициллину?
Нет. Нельзя сказать, являются ли эти бактерии устойчивыми к ампициллину, так как и устойчивые, и неустойчивые бактерии внешне выглядят одинаково – сравните колонии на «стартовой» чашке LB и колонии на чашке (+)pGLO LB/amp
7.Как вы измените условия выращивания бактерий, чтобы выяснить, устойчивы ли они к ампициллину?
Лучше всего взять часть бактерий с чашки LB и посеять на чашку LB/amp. Если бактерии растут на среде с ампициллином, значит, они устойчивы к нему. Если колонии не вырастут, значит, эти бактерии чувствительны к ампициллину.
8.Часто внешние признаки организма являются проявлением взаимодействия генов с конкретными условиями окружающей среды. Подумайте про зеленый цвет колоний некоторых трансформированных бактерий:
А. Какие два фактора необходимы, чтобы увидеть зеленый цвет? (подсказка: один фактор присутствует на чашке ,второй – как вы смотрите на чашки)
Сахар арабиноза, присутствующий на чашке, необходим для того ,чтобы включить экспрессию гена зеленого флуоресцентного белка. Ультрафиолет необходим, чтобы зеленый флуоресцентный белок в клетках бактерий начал светиться.
Б. Как вы думаете, как работает каждый из этих двух факторов?
Арабиноза связывается с белком araC, находящимся на промоторе PBAD. При этом araC изменяет свою конформацию (трехмерную структуру) и становится способна помочь РНК-полимеразе связаться с промотором и начать транскрипцию (см. детальное описание в приложении D). При поглощении ультрафиолета (невидимого коротковолнового света), электроны в хромофорной (дающей цвет) группе GFP возбуждаются (переходят в высокоэнергетическое состояние). Затем они отдают поглощенную энергию, испуская свет флуоресценции более длинной длины волны (то есть несущий меньшую энергию). Это видимый зеленый свет с длиной волны 509 нм.
В. Какое преимущество дает организму способность включать или выключать свои гены в зависимости от определенных внешних условий?
Регуляция работы генов позволяет организму адаптироваться в разным внешним условиям и при этом не тратить ресурсы на производство не нужных в данных конкретных условиях белков. Хорошим примером строго регулируемых генов являются гены отвечающие за «переработку пищи» - катаболизм углеводов. Если сахар арабиноза присутствует в среде, бактерии выгодно экспрессировать ферменты, необходимые для того, чтобы использовать этот потенциальный источник энергии. С другой стороны, если арабинозы в среде нет, производить ферменты для переработки арабинозы значит наоборот тратить энергию зря.
Дополнительно: подсчет эффективности трансформации
Определите общее число трансформированных клеток
Предполагается, что каждая колония на чашке произошла из отдельной клетки. По мере того, как клетки делятся, их становится все больше и больше, и она образуют колонию. Самый прямой способ подсчитать общее количество клеток, которые получили плазмиду и выжили - это подсчитать число колоний на чашке.
Общее число клеток= 190
В ведите
число здесь
ведите
число здесь
Определите количество плазмидной ДНК, добавленной в клетки, нанесенные на чашку LB/amp/ara
Чтобы определить количество ДНК в расчете на одну чашку, нам надо знать две вещи: какое количество ДНК исходно было взято в эксперимент, и какая доля всей ДНК попала на одну чашку.
Когда вы определите эти числа, вы умножите общее количество ДНК на долю ДНК, приходящуюся на одну чашку и получите количество ДНК в расчете на одну чашку LB/amp/ara
А. Определение количества ДНК
Общее количество ДНК, которое мы использовали, равняется произведению концентрации ДНК и взятого объема, т.е:
ДНК (мкг) = (концентрация ДНК, мкг/мкл) x (объем в мкл)
В этой работе вы использовали 10 мкл раствора плазмиды с концентрацией 0.08 мкг/мкл. Это означает, что в каждом микролитре раствора содержалось 0.08 мкг ДНК. Рассчитайте общее количество ДНК, которое было использовано в эксперименте
Общее количество ДНК (мкг) = 0.8
В ведите число здесь
Как вы используете это число? Вы должны умножить его на долю ДНК, приходящуюся на одну чашку, для того, чтобы узнать количество ДНК (в мкг), приходящееся на одну чашку.
Б. Определение доли плазмидной ДНК, которая была нанесена на чашку
Теперь вам надо понять, какую часть от всей ДНК вы нанесли на одну чашку. Чтобы это узнать, разделите объем, нанесенный вами на чашку, на весь объем, содержавшийся в пробирке:
Объем, растертый по чашке LB/amp/ara |
Весь объем пробирки |
Доля ДНК=
На одну чашку вы взяли 100 мкл суспензии из пробирки, содержавшей 510 мкл жидкости. Почему 510? Если вы не помните, посмотрите внимательно экспериментальный протокол и отметьте все шаги, на которых вы добавляли жидкость в пробирку. Рассчитайте долю ДНК, приходящуюся на одну чашку.
Доля ДНК на чашку = 0.2
В ведите число здесь
Как вы используете эту информацию?
Это число будет умножено на общее количество ДНК, чтобы получить количество ДНК в расчете на одну чашку.
Итак, сколько микрограмм ДНК вы нанесли на одну чашку LB/amp/ara?
Чтобы ответить на этот вопрос, нужно умножить общее количество ДНК, использованное в эксперименте, на долю ДНК, приходящуюся на одну чашку.
Количество ДНК pGLO в расчете на одну чашку=Общее количество ДНК (мкг) x доля ДНК на одну чашку
Количество ДНК pGLO
нанесенное на одну чашку= 0.16 мкг
В ведите число здесь
О чем это число говорит вам?
Это число говорит о том, сколько ДНК было нанесено на одну чашку.
Посмотрите на ваши расчеты. Определите, какие числа вам необходимы, чтобы заполнить следующую таблицу:
Число колоний на чашке LB/amp/ara |
190 |
Количество микрограмм ДНК нанесенное на чашку |
0.16 |
Теперь используйте эти данные ,чтобы рассчитать эффективность трансформации. Она оценивается так:
Общее число клеток на чашке |
Количество ДНК нанесенное на чашку |
1187 трансформанта/
мкг
Эффективность трансформации
В ведите число здесь
Результаты расчетов эффективности трансформации выражаются очень большими числами. Ученые обычно используют укороченный способ записи таких чисел, называемый стандартным или научным способом. Например, если рассчитанная эффективность трансформации составляет 1000 трансформантов на микрограмм, они записывают это как:
103 трансформантов/мкг (103 это тоже самое, что 10x10х10 или 1000)
Как записать в научном виде 10 000 трансформантов на микрограмм?
