
- •V. Энергетический обмен клетки
- •§5.1. Метаболические реакции
- •Энергетически сопряженные реакции
- •§5.2. Модель молекулярного источника энергии
- •§5.3. Высокоэнергетические соединения – макроэрги. Атф
- •§5.4. Экзоэргические реакции. Гидролиз
- •§5.5. Окислительно-восстановительные реакции
- •5.5.1. Окислительные процессы в биологии
- •5.5.2. Ферментативное окисление
- •§5.6. Энергетическое сопряжение в реакциях фосфорилирования
- •§5.7. Законы биоэнергетики
- •§5.8. Клеточное дыхание
- •5.8.1. Общая схема
- •5.8.2. Две стадии клеточного дыхания
- •I. Первая стадия клеточного дыхания
- •II. Второй этап клеточного дыхания
- •§5.9. F1f0-атФсинтаза
- •5.9.1. Структура
- •5.9.2. Основные функции
- •5.9.3. Принцип действия
- •5.9.4. Синтез атф
- •5.9.5. Гидролиз атф
- •5.9.6. F1f0-atФсинтаза как биорегулятор клетки
- •§5.10. Межмолекулярный перенос энергии в биоструктурах
- •5.10.1. Химический и физический способы переноса энергии
- •5.10.2. Фотовозбуждение сложных молекул
- •5.10.3. Индуктивно-резонансный механизм миграции энергии
- •5.10.4. Модели индуктивно-резонансной миграции энергии
- •Механическая модель
- •Квантово-механическая модель
- •5.10.5. Обменно-резонансный механизм
- •5.10.6. Экситонный механизм
- •5.10.7. Некоторые замечания о механизмах переноса энергии фотовозбуждения
- •§5.11. Перенос электрона. Электронно-конформационное взаимодействие
- •5.11.1. Электронно-колебательное взаимодействие
- •5.11.2. Перенос электрона в окислительно-восстановительных реакциях
- •5.11.3. Проводимость белков
- •5.11.4. Полупроводниковая концепция транспорта
- •5.11.5. Химический механизм переноса заряда
- •5.11.6. Биологическое значение переноса заряда
- •§5.12. Фотосинтез
- •§5.13. Эволюция биоэнергетики
- •5.13.1. Ультрафиолетовый фотосинтез атф
- •5.13.2. О производстве энергии в экстремальных условиях
- •§5.14. Искусственные молекулярные устройства, моделирующие процессы переноса
§5.3. Высокоэнергетические соединения – макроэрги. Атф
К высокоэнергетическим соединениям относятся макроэрги (от греч. macrós – большой и ergon – работа), которые могут находиться в одном или двух (редко трех) метастабильных состояниях.
Наиболее важным макроэргом, обеспечивающим энергией большое число эндоэргических реакций является молекула аденозинтрифосфорной кислоты АТФ (или АТР, где Р – фосфор, от греч. phōsphóros – светоносный) (реже молекула гуанозинтрифосфата – ГТФ).
Структура АТФ представлена на рис. 5–4. АТФ относится к нуклеотидам (см. с.442–447). Молекула АТФ состоит из аденина (двухкольцевого азотистого пуринового основания), пятиуглеродного сахара рибозы (рис.3–5, с. 374) и трех фосфатных групп. В фосфатной группе атом фосфора находится в состоянии sp3-гибридизации, окружен четырьмя атомами кислорода, находящимися в вершинах тетраэдра. Тетраэдрические структуры отдельных фосфатных групп соединены через атомы кислорода. Все фосфатные группы имеют отрицательный заряд. Поэтому при образовании межгрупповых фосфатных связей молекула переходит в метастабильное состояние.

Рис. 5–4. Структура молекулы АТФ и Mg2+-комплекса АТФ (вверху слева в квадратных скобках). Аденозин – это аденин, связанный с пятиуглеродным сахаром (см. ниже)
Наиболее низкое значение энергии имеет аденозинмонофосфат (АМФ) (рис. 5–5). Присоединение фосфатного остатка к монофосфату (фосфорилирование АМФ) приводит к образованию метастабильного состояния АДФ (аденозиндифосфата ADP) с большей запасенной энергией. Аналогично, присоединение еще одного фосфатного остатка (образование аденозинтрифосфата (АТФ)) переводит молекулу в метастабильное состояние с еще большей энергией. Заметим, что дальнейшее присоединение отрицательно заряженных фосфатных остатков приводит к уменьшению величины потенциального барьера, образованию химически неустойчивых структур и не реализуется. То, что термодинамически молекула АТФ нестабильна (метастабильна), не мешает ей быть химически высокостабильной и устойчивой: в нормальных условиях скорость неферментативного гидролиза АТФ очень мала.
Малые размеры молекулы АТФ, позволяющие ей диффундировать в различные участки клетки, химическая стабильность, препятствующая тепловому рассеянию энергии, позволили АТФ стать энергетической «валютной» единицей клетки. АТФ – это универсальный клеточный аккумулятор (то есть сохраняющий энергию в форме энергии фосфатных связей) и мобильный носитель химической энергии, доставляемой при необходимости в любую точку клетки.
В реакциях, протекающих внутри клетки, АТФ участвует в виде Mg2+-комплекса, изображенного в квадратных скобках на рис. 5–4.
К экзоэргическим (с выделением энергии) реакциям в клетках относятся, главным образом, гидролиз фосфатных групп у АТФ, АДФ и других макроэргов и реакции окисления.
К эндоэргическим реакциям относятся реакции фосфорилирования (присоединения фосфатных остатков) и синтеза сложных соединений.
§5.4. Экзоэргические реакции. Гидролиз
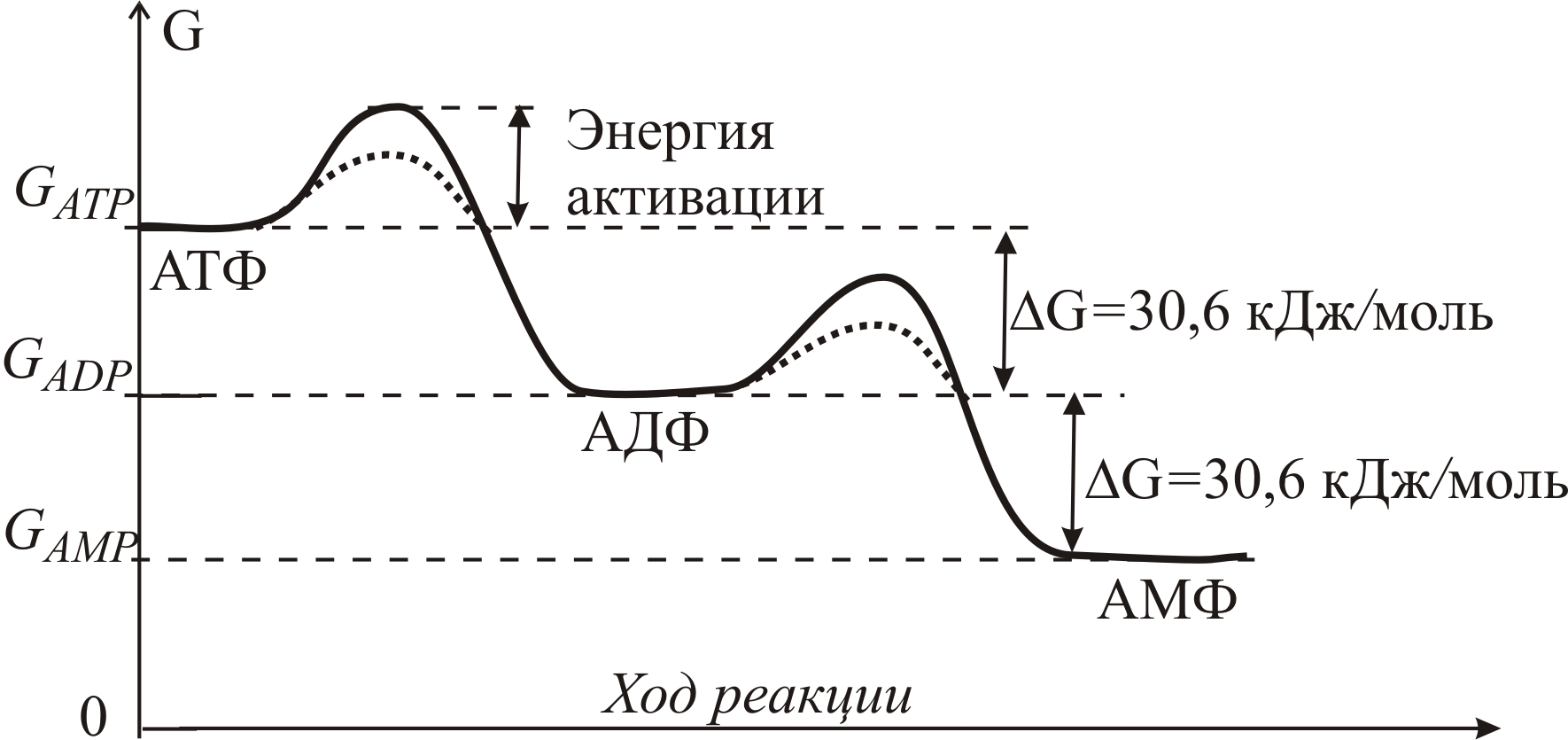
В фосфатах, в том числе и в АТФ, энергия заключена в фосфатных связях. Высвобождение энергии химической связи (ΔG < 0) связано с расщеплением связи – реакцией гидролиза АТФ (обменной реакцией между веществом и в одой, от греч. hýdōr – вода и lýsis – разложение). При гидролитическом отщеплении концевого остатка фосфорной кислоты (рис. 5–5а) высвобождается ~30,6 кДж на один моль АТФ и образуется молекула аденозиндифосфата (АДФ) и фосфат (Ф). Дальнейший гидролиз АДФ также дает ~30,6 кДж/моль энергии с образованием аденозинмонофосфата (АМФ) и фосфата (Ф). Схема изменения энергии молекулы АТФ при гидролизе изображена на рис. 5–5б.
Переходы АТФ в АДФ и АДФ в АМФ сопряжены с преодолением потенциальных барьеров, обеспечивающих метастабильное существование этих соединений в обычных условиях. Величина потенциальных барьеров равна энергии активации, необходимой для запуска реакции. Реакция начинается, например, при такой температуре, при которой кинетическая энергия движения молекул становится равной энергии активации (см. с. 502-503). Катализаторы, в частности, вода снижают величину потенциальных барьеров (пунктирные линии на рис. 5–5б) и обеспечивают протекание реакции АТФ→АДФ→АМФ при обычных температурах, существующих в клетке.
В водных растворах АДФ и АТФ неустойчивы и полностью расщепляются до АМФ и Н3РО4. В организмах фосфаты АТФ, АДФ и АМФ находятся в метастабильном состоянии. Обычно они связаны с белками и присутствуют в виде комплексов с ионами Mg2+ и Ca2+ (рис.5–4).
Известны более энергетические фосфаты, такие как фосфоенолпируват (при гидролизе выделяется ≈62 кДж/моль), карбомоилфосфат (при гидролизе выделяется ≈52 кДж/моль), 1,3-дифосфоглицерат (≈49,6 кДж/моль), креатинфосфат (при гидролизе выделяется ≈43 кДж/моль). У низкоэнергетических фосфатов при разрыве связи выделяется энергии меньше, чем у АТФ: пирофосфат – ≈27,5 кДж/моль, глюкозо-1-фосфат – ≈21 кДж/моль, фруктозо-6-фосфат – ≈16 кДж/моль, АМФ – 14,2 кДж/моль, глицерол-3-фосфат – ≈9 кДж/моль.

(а)
 (б)
(б)
Рис. 5–5. Схема гидролиза АТФ (а) и изменения энергии Гиббса G в ходе реакции. Волнистой линией обозначены высокоэнергетические связи

Рис. 5–6. (а) – положение высокоэнергетических связей (~) в АТФ и АДФ; (б) – реакция, в результате которой высокоэнергетическая фосфатная группа АТФ при образовании соединения с более низкой свободной энергией гидролиза, чем у АТФ, становится низкоэнергетической. Реакция идет с участием фермента – глицеролкиназы
Для обозначения высокоэнергетической фосфатной группы Липман ввел символ ~, означающий, что перенос группы, присоединенной указанной связью, на подходящий акцептор сопровождается выделением свободной энергии (рис. 5–6).
Для хранения высокоэнергетических фосфатов организм использует соединения – фосфагены (креатинфосфаты). Например, в период быстрого расходования энергии в мышцах, концентрация АТФ за счет креатинфосфата увеличивается. Когда накапливается много АТФ идет обратная реакция – образование креатинфосфата. Таким образом, креатинфосфат поддерживает в мышцах необходимую при данных физиологических условиях концентрацию АТФ и служит резервуаром энергии.
Кроме фосфатов имеются и другие биологически важные «богатые энергией» соединения, к которым относятся, например, тиоловые эфиры и эфиры аминокислот.
