
- •V. Энергетический обмен клетки
- •§5.1. Метаболические реакции
- •Энергетически сопряженные реакции
- •§5.2. Модель молекулярного источника энергии
- •§5.3. Высокоэнергетические соединения – макроэрги. Атф
- •§5.4. Экзоэргические реакции. Гидролиз
- •§5.5. Окислительно-восстановительные реакции
- •5.5.1. Окислительные процессы в биологии
- •5.5.2. Ферментативное окисление
- •§5.6. Энергетическое сопряжение в реакциях фосфорилирования
- •§5.7. Законы биоэнергетики
- •§5.8. Клеточное дыхание
- •5.8.1. Общая схема
- •5.8.2. Две стадии клеточного дыхания
- •I. Первая стадия клеточного дыхания
- •II. Второй этап клеточного дыхания
- •§5.9. F1f0-атФсинтаза
- •5.9.1. Структура
- •5.9.2. Основные функции
- •5.9.3. Принцип действия
- •5.9.4. Синтез атф
- •5.9.5. Гидролиз атф
- •5.9.6. F1f0-atФсинтаза как биорегулятор клетки
- •§5.10. Межмолекулярный перенос энергии в биоструктурах
- •5.10.1. Химический и физический способы переноса энергии
- •5.10.2. Фотовозбуждение сложных молекул
- •5.10.3. Индуктивно-резонансный механизм миграции энергии
- •5.10.4. Модели индуктивно-резонансной миграции энергии
- •Механическая модель
- •Квантово-механическая модель
- •5.10.5. Обменно-резонансный механизм
- •5.10.6. Экситонный механизм
- •5.10.7. Некоторые замечания о механизмах переноса энергии фотовозбуждения
- •§5.11. Перенос электрона. Электронно-конформационное взаимодействие
- •5.11.1. Электронно-колебательное взаимодействие
- •5.11.2. Перенос электрона в окислительно-восстановительных реакциях
- •5.11.3. Проводимость белков
- •5.11.4. Полупроводниковая концепция транспорта
- •5.11.5. Химический механизм переноса заряда
- •5.11.6. Биологическое значение переноса заряда
- •§5.12. Фотосинтез
- •§5.13. Эволюция биоэнергетики
- •5.13.1. Ультрафиолетовый фотосинтез атф
- •5.13.2. О производстве энергии в экстремальных условиях
- •§5.14. Искусственные молекулярные устройства, моделирующие процессы переноса
5.11.2. Перенос электрона в окислительно-восстановительных реакциях
Простейшим примером переноса электрона служит окислительно-восстановительная реакция ионов железа в водном растворе:
![]() . (5.48)
. (5.48)
Ионы железа в растворе гидратированы,
то есть представляют собой аквакомплексы
(т.1, с.185) с внутренней координационной
сферой
![]() и
и
![]() .
Перенос электрона происходит путем
квантово-механического туннелирования
при столкновении
и
(рис. 5–28).
.
Перенос электрона происходит путем
квантово-механического туннелирования
при столкновении
и
(рис. 5–28).
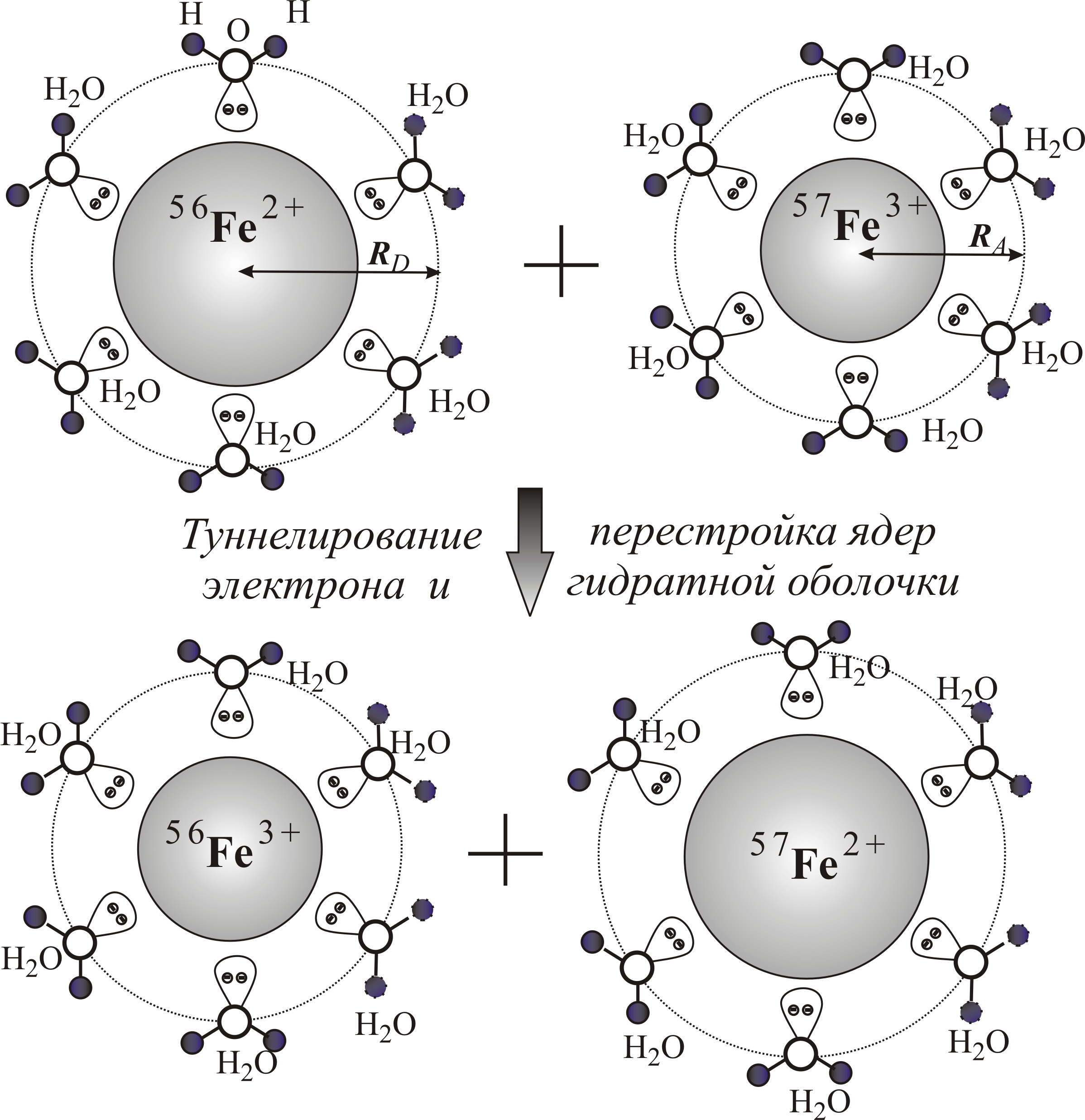
Рис. 5–28. Окислительно-восстановительная реакция (1) ионов железа, находящихся в водном растворе и гидратированных молекулами воды. Шесть молекул воды, окружающих ионы в трехмерном пространстве, схематически изображены в одной плоскости. Реакция заключается в туннелировании электрона и перестройке гидратной оболочки
В реакции (1) донором является
![]() ,
акцептором
,
акцептором
![]() .
Для данной реакции (1) конформационными
координатами RD
и RA
являются равновесные расстояния
.
Для данной реакции (1) конформационными
координатами RD
и RA
являются равновесные расстояния
![]() между атомами кислорода молекул воды
и ионами
между атомами кислорода молекул воды
и ионами
![]() и
и
![]() ,
соответственно. При окислении иона
,
соответственно. При окислении иона
![]()
у Fe2+ изменяется степень заполнения орбитали 3d электронами:(3d64s0) → (3d54s0). При этом, в результате изменения кулоновского и обменного взаимодействий электронов на 3d-орбиталях, энергия связи 3d5 электронов с ядром увеличивается на ~26 эВ (см. с. 291–293), а радиус иона уменьшается на ∆R=0,14Å. Гидратная оболочка прижимается к ядру, так что расстояние от ядра железа до ядер атомов кислорода молекул воды в гидратной оболочке уменьшается на ∆R=0,14Å (см. рис. 5–26).
Потенциальной энергии диполей молекул воды в поле заряда соответствует кривая U1, а в поле заряда – U2. Таким образом, если в начале координат на рис. 5–26 расположен ион Fe2+, то потенциальная энергия связанных с ним диполей молекул воды описывается жирной кривой с минимумом в точке RD. Если же в начале координат находится окисленный ион Fe3+, то потенциальной энергии соответствует пунктирная кривая с минимумом в точке RA. В обоих случаях связанные молекулы воды совершают колебательные движения относительно равновесных положений, так что расстояние между ядром железа и ядрами атомов кислорода периодически изменяется. Энергия любого ограниченного в определенной области пространства (финитного) движения частиц квантуется. Вид квантованного спектра частиц связан с зависимостью потенциальной энергии от U вблизи точек R = RA и R = RD от расстояния до этих точек. Для наглядности будем считать зависимости U(R–RA,D) параболами:
 , (5.49)
, (5.49)
где
![]() и
и
![]() упругие постоянные связи железа с
молекулами воды
упругие постоянные связи железа с
молекулами воды
![]() .
В этом случае энергетические спектры
колебательных движений молекул воды у
Fe2+ и Fe3+
имеют вид соответствующих спектров
гармонических осцилляторов:
.
В этом случае энергетические спектры
колебательных движений молекул воды у
Fe2+ и Fe3+
имеют вид соответствующих спектров
гармонических осцилляторов:
![]() (5.50)
(5.50)
с частотами (![]() – масса молекулы воды):
– масса молекулы воды):
 . (5.51)
. (5.51)
Энергия связи
![]() молекул воды с атомом окисленного железа
больше, чем энергия связи
молекул воды с атомом окисленного железа
больше, чем энергия связи
![]() с
ионом
,
с
ионом
,
![]() и
и
![]() .
Положение нижних энергетических уровней
в потенциальных ямах определяет энергии
.
Положение нижних энергетических уровней
в потенциальных ямах определяет энергии
![]() ,
,
![]() и
амплитуды
и
амплитуды
![]() ,
,
![]() нулевых колебаний молекул воды (при
Т = 0 К) (т.1, с.288):
нулевых колебаний молекул воды (при
Т = 0 К) (т.1, с.288):
![]() и
и
![]() .
.
Полагая
![]() ,
находим
,
находим
![]() ,
,
![]() .
.
Величина работы, которую надо совершить,
чтобы переместить молекулы гидратной
оболочки из начального положения в
конфигурации
![]() в конечное – в конфигурации
в конечное – в конфигурации
![]() (на расстояние
(на расстояние
![]() )
без изменения зарядового состояния
иона
,
называется энергией реорганизации
системы Er
(обозначена вертикальной стрелкой на
рис. 5–26):
)
без изменения зарядового состояния
иона
,
называется энергией реорганизации
системы Er
(обозначена вертикальной стрелкой на
рис. 5–26):
![]() . (5.52)
. (5.52)
Энергия активации Ea значительно меньше Er, так как она определяется расстоянием от энергетического уровня E1n, на котором находится молекула воды, до энергии E = U*:
![]() .
.
Процесс окисления Fe2+ с физической точки зрения означает, что, если сжимать гидратную оболочку вокруг иона-донора Fe2+, то при уменьшении ее радиуса на система переходит в новое состояние: один 3d-электрон отрывается от иона Fe2+ и образуется устойчивый комплекс . Для этой реорганизации требуется энергия Er. Набрать такую энергию за счет термических флуктуаций практически невозможно. Поэтому перестройка ядерной системы требует определенного времени.
Итак, рассматривается следующая модель.
Гидратированные ионы
и
находятся в водном растворе. При их
соударении электрон с определенной
вероятностью туннелирует с донорного
иона
на акцепторный
.
Акт туннелирования происходит практически
мгновенно. При этом радиус иона-донора
уменьшается на
![]() Å.
Так как движения ядер совершаются на
Å.
Так как движения ядер совершаются на
![]() порядка медленнее, чем туннелирование
электрона, то возникает неравновесное
состояние гидратированного иона-донора:
его радиус уменьшился, а радиус гидратной
оболочки сохранился. Между ионом и
оболочкой образовалось свободное
пространство. Однако, чтобы перейти в
новое стационарное состояние, следует
преодолеть потенциальный барьер, который
всегда существует между любыми
стационарными или квазистационарными
состояниями системы. Поэтому, чтобы
произошла перестройка всего комплекса
требуется или туннельное смещение
ядер RD→RA,
или термическая активация
ядерной системы (дополнительная
колебательная энергия) комплекса.
порядка медленнее, чем туннелирование
электрона, то возникает неравновесное
состояние гидратированного иона-донора:
его радиус уменьшился, а радиус гидратной
оболочки сохранился. Между ионом и
оболочкой образовалось свободное
пространство. Однако, чтобы перейти в
новое стационарное состояние, следует
преодолеть потенциальный барьер, который
всегда существует между любыми
стационарными или квазистационарными
состояниями системы. Поэтому, чтобы
произошла перестройка всего комплекса
требуется или туннельное смещение
ядер RD→RA,
или термическая активация
ядерной системы (дополнительная
колебательная энергия) комплекса.
