- •V. Энергетический обмен клетки
- •§5.1. Метаболические реакции
- •Энергетически сопряженные реакции
- •§5.2. Модель молекулярного источника энергии
- •§5.3. Высокоэнергетические соединения – макроэрги. Атф
- •§5.4. Экзоэргические реакции. Гидролиз
- •§5.5. Окислительно-восстановительные реакции
- •5.5.1. Окислительные процессы в биологии
- •5.5.2. Ферментативное окисление
- •§5.6. Энергетическое сопряжение в реакциях фосфорилирования
- •§5.7. Законы биоэнергетики
- •§5.8. Клеточное дыхание
- •5.8.1. Общая схема
- •5.8.2. Две стадии клеточного дыхания
- •I. Первая стадия клеточного дыхания
- •II. Второй этап клеточного дыхания
- •§5.9. F1f0-атФсинтаза
- •5.9.1. Структура
- •5.9.2. Основные функции
- •5.9.3. Принцип действия
- •5.9.4. Синтез атф
- •5.9.5. Гидролиз атф
- •5.9.6. F1f0-atФсинтаза как биорегулятор клетки
- •§5.10. Межмолекулярный перенос энергии в биоструктурах
- •5.10.1. Химический и физический способы переноса энергии
- •5.10.2. Фотовозбуждение сложных молекул
- •5.10.3. Индуктивно-резонансный механизм миграции энергии
- •5.10.4. Модели индуктивно-резонансной миграции энергии
- •Механическая модель
- •Квантово-механическая модель
- •5.10.5. Обменно-резонансный механизм
- •5.10.6. Экситонный механизм
- •5.10.7. Некоторые замечания о механизмах переноса энергии фотовозбуждения
- •§5.11. Перенос электрона. Электронно-конформационное взаимодействие
- •5.11.1. Электронно-колебательное взаимодействие
- •5.11.2. Перенос электрона в окислительно-восстановительных реакциях
- •5.11.3. Проводимость белков
- •5.11.4. Полупроводниковая концепция транспорта
- •5.11.5. Химический механизм переноса заряда
- •5.11.6. Биологическое значение переноса заряда
- •§5.12. Фотосинтез
- •§5.13. Эволюция биоэнергетики
- •5.13.1. Ультрафиолетовый фотосинтез атф
- •5.13.2. О производстве энергии в экстремальных условиях
- •§5.14. Искусственные молекулярные устройства, моделирующие процессы переноса
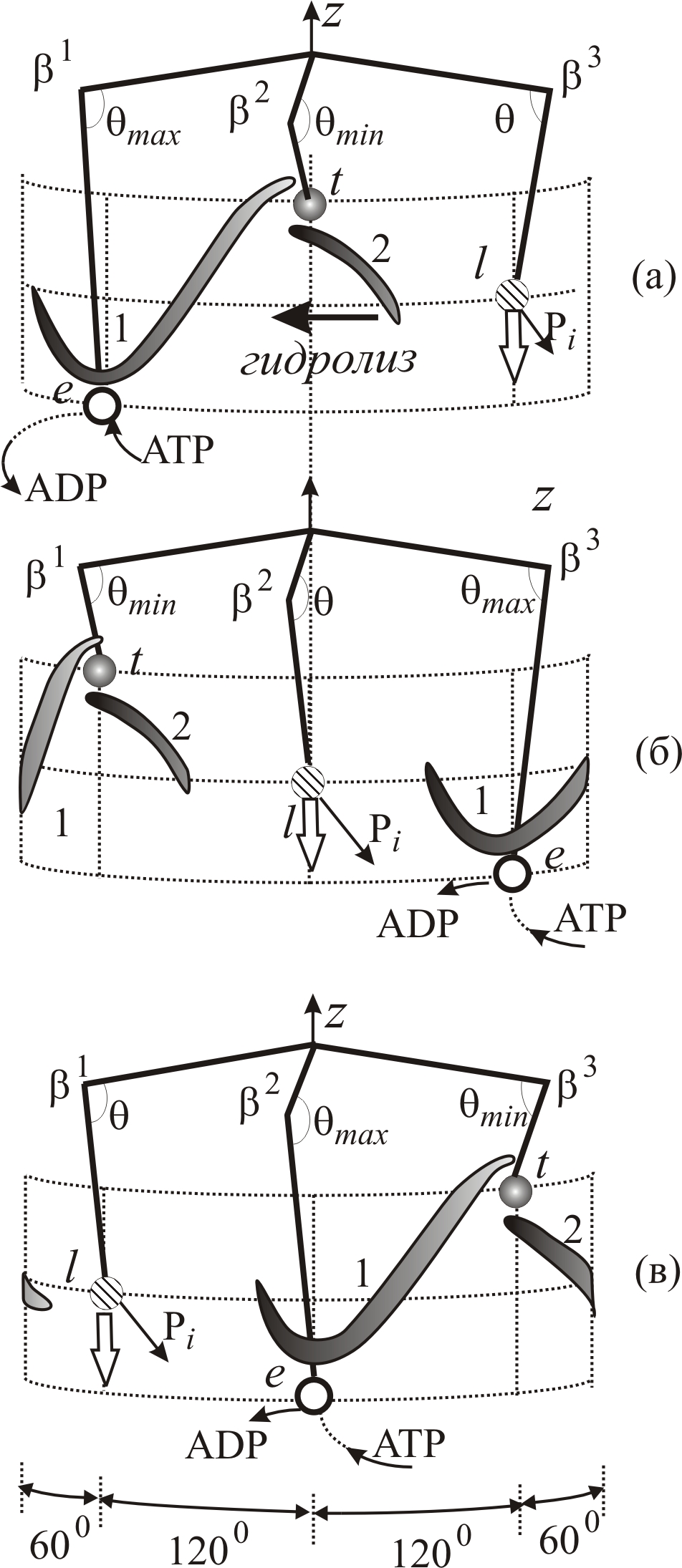
5.9.5. Гидролиз атф
Гидролиз АТФ приводит к вращению ротора F1F0-АТФсинтазы в противоположную сторону, по сравнению с направлением вращения при синтезе АТФ, за счет энергии, выделяющейся при сорбции и гидролизе АТФ.
Если
поток ионов H+
в матрикс (против градиента химиечского
потенциала) приводит к вращению ротора
против часовой стрелки, то при вращении
ротора в обратном направлении должен
возникать поток ионов Н+
также в противоположном направлении.
Из общих соображений следует, что в
процессе гидролиза ионы переносятся
из матрикса митохондрии в межмембранное
пространство (по градиенту химического
потенциала
![]() )
независимо от конкретного механизма
преобразования вращения ротора в поток
ионов Н+.
)
независимо от конкретного механизма
преобразования вращения ротора в поток
ионов Н+.
Пусть при t = 0 конформации субъединиц β имеют тот же вид, как и в случае синтеза (рис. 5–18 а). Связывание АТФ свободным активным центром , сопровождается выделением небольшой энергии. Эта энергия инициирует кооперативные перестройки фермента, приводящие к его переходу в конформацию с закрытым активным центром (рис. 5–18 а→б). Заметим, что для этого перехода требуется значительно меньшая энергия, чем при переходе во время синтеза АТФ, так как в случае гидролиза отсутствуют затраты энергии на сближение одноименно заряженных субстратов АДФ и Фi.
Во время перехода , за счет возрастающей энергии сорбции, угол θ уменьшается на ~30°. При этом нижний конец субъединицы скользит по нижней стороне лопасти 1 и поворачивает ротор влево (по часовой стрелке) на 120° (рис. 5–18 а→б).
Одновременно
с сорбцией АТР субъединицей
в закрытой конформации
происходит гидролиз АТФ (с выделением
энергии) в результате активации молекулы
Н2О
отрицательно заряженной карбоксильной
группой β-Glu188
каталитического центра. Образовавшиеся
продукты гидролиза АДФ и Фi
несут отрицательные заряды. Поэтому
переход
![]() инициируется кулоновским отталкиванием
продуктов гидролиза. Энергия кулоновского
отталкивания АДФ3-
и
инициируется кулоновским отталкиванием
продуктов гидролиза. Энергия кулоновского
отталкивания АДФ3-
и
![]() вызывает переход субъединицы
из состояния с закрытым активным центром,
которое после гидролиза стало энергетически
не выгодным, в полуоткрытое состояние
вызывает переход субъединицы
из состояния с закрытым активным центром,
которое после гидролиза стало энергетически
не выгодным, в полуоткрытое состояние
![]() ,
в котором энергия сорбции ослабляется,
и фосфат
выходит из активного центра. При переходе
,
в котором энергия сорбции ослабляется,
и фосфат
выходит из активного центра. При переходе
![]() субъединица
разгибается на угол ~15°. Нижний конец
давит на лопасть 2 и смещает ее влево,
что усиливает момент сил, поворачивающих
ротор по часовой стрелке.
субъединица
разгибается на угол ~15°. Нижний конец
давит на лопасть 2 и смещает ее влево,
что усиливает момент сил, поворачивающих
ротор по часовой стрелке.
|
АTP
|
|
|
|
|
Рис. 5–18. Изменение конформаций субъединиц во время гидролиза при повороте ротора на 120° (а) и 240° (б). Прямые одинарные стрелки обозначают переходы субъединиц β из одной конформации в другую в результате энергии сорбции и гидролиза, а двойные – в результате поворота ротора на 120° |
|
В
то же время, после поворота ротора на
~60°, левый край лопасти 1 распрямляет
субъединицу
и приводит ее в открытую конформацию
![]() (рис. 5–18 а→б).
(рис. 5–18 а→б).
Следующий поворот ротора на 120° происходит в результате гидролиза АТФ в конформации и одновременной сорбции АТФ в . Субъединица переходит в конформацию . Конфигурация, соответствующая повороту ротора на 240° имеет вид, схематически изображенный на рис. 5–18 в.
Изменения конформаций всех субъединиц при повороте ротора на 120° и 240° изображены на рис. 5–18 б и в, соответственно.
Таким образом, субъединица γ вращается в результате согласованного сгибания и разгибания всех трех субъединиц . За один оборот происходит гидролиз трех молекул АТФ.