
- •V. Энергетический обмен клетки
- •§5.1. Метаболические реакции
- •Энергетически сопряженные реакции
- •§5.2. Модель молекулярного источника энергии
- •§5.3. Высокоэнергетические соединения – макроэрги. Атф
- •§5.4. Экзоэргические реакции. Гидролиз
- •§5.5. Окислительно-восстановительные реакции
- •5.5.1. Окислительные процессы в биологии
- •5.5.2. Ферментативное окисление
- •§5.6. Энергетическое сопряжение в реакциях фосфорилирования
- •§5.7. Законы биоэнергетики
- •§5.8. Клеточное дыхание
- •5.8.1. Общая схема
- •5.8.2. Две стадии клеточного дыхания
- •I. Первая стадия клеточного дыхания
- •II. Второй этап клеточного дыхания
- •§5.9. F1f0-атФсинтаза
- •5.9.1. Структура
- •5.9.2. Основные функции
- •5.9.3. Принцип действия
- •5.9.4. Синтез атф
- •5.9.5. Гидролиз атф
- •5.9.6. F1f0-atФсинтаза как биорегулятор клетки
- •§5.10. Межмолекулярный перенос энергии в биоструктурах
- •5.10.1. Химический и физический способы переноса энергии
- •5.10.2. Фотовозбуждение сложных молекул
- •5.10.3. Индуктивно-резонансный механизм миграции энергии
- •5.10.4. Модели индуктивно-резонансной миграции энергии
- •Механическая модель
- •Квантово-механическая модель
- •5.10.5. Обменно-резонансный механизм
- •5.10.6. Экситонный механизм
- •5.10.7. Некоторые замечания о механизмах переноса энергии фотовозбуждения
- •§5.11. Перенос электрона. Электронно-конформационное взаимодействие
- •5.11.1. Электронно-колебательное взаимодействие
- •5.11.2. Перенос электрона в окислительно-восстановительных реакциях
- •5.11.3. Проводимость белков
- •5.11.4. Полупроводниковая концепция транспорта
- •5.11.5. Химический механизм переноса заряда
- •5.11.6. Биологическое значение переноса заряда
- •§5.12. Фотосинтез
- •§5.13. Эволюция биоэнергетики
- •5.13.1. Ультрафиолетовый фотосинтез атф
- •5.13.2. О производстве энергии в экстремальных условиях
- •§5.14. Искусственные молекулярные устройства, моделирующие процессы переноса
 л.
V. Энергетический
обмен клетки
л.
V. Энергетический
обмен клетки
V. Энергетический обмен клетки
Живая клетка – это сложная самоорганизующаяся открытая система, в которой непрерывно происходит обмен различными веществами с окружающей средой. Поступающие в животную клетку органические вещества служат, с одной стороны, источником отдельных молекулярных блоков, которые используются для биосинтеза различных клеточных компонентов, с другой стороны, источником химической энергии. Если небиологические системы могут совершать работу за счет Тепловой энергии (тепловые двигатели), то биологические системы функционируют в изотермическом режиме и для процессов жизнедеятельности используют химическую энергию. Скорость потребления энергии, непосредственно связанная со скоростью метаболических процессов в организме, регулируется гормонами щитовидной железы.
§5.1. Метаболические реакции
Все реакции в клетке можно разделить на два основных типа.
К
первому типу
относятся реакции синтеза крупных
молекул (АВ) из более мелких (А и В) –
анаболические
реакции (от
греч. anabolḗ
– подъем), на которые, как правило,
требуются затраты энергии (![]() ):
):
![]() . (5.1)
. (5.1)
Реакции распада крупных молекул (АВ) – катаболические реакции (от греч. katabolḗ – разрушение) – относятся к реакциям второго типа. Они происходят, в основном, с выделением энергии:
![]() . (5.2)
. (5.2)
Совокупность анаболических и катаболических реакций называется метаболизмом (от греч. metabolḗ – перемена, превращение, обмен веществ) клетки.
Реакции, которые происходят с выделением энергии (свободная энергия Гиббса системы понижается ΔG < 0), называются экзоэргическими, а с выделением тепла — экзотермическими (от греч. е́хō – вне, снаружи). Они могут происходить самопроизвольно, спонтанно.
Реакции, которые требуют подвода энергии, называются эндоэргическими (с подводом тепла – эндотермическими) (от греч. éndon – внутри). Так как при этих реакциях энергия Гиббса (и химический потенциал) системы повышается ΔG > 0, то такие реакции могут протекать только при наличии энергетически сопряженного экзоэргического процесса, при котором выделяется энергия.
Энергетически сопряженные реакции
Схема энергетического сопряжения реакций заключается в следующем. Рассмотрим две связанные системы A и S (рис. 5–1).
Рис. 5–1.
Схема энергетического сопряжения
экзоэргической реакции с выделением
энергии
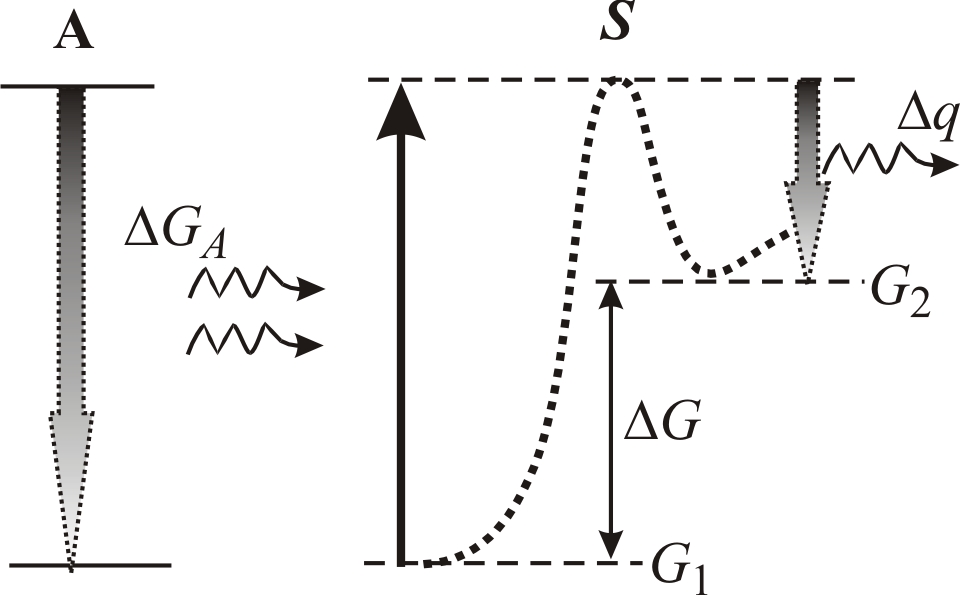
![]() и эндоэргической реакции, в результате
которой система S
переходит из состояния с энергией
и эндоэргической реакции, в результате
которой система S
переходит из состояния с энергией
![]() в высокоэнергетическое состояние с
энергией
в высокоэнергетическое состояние с
энергией
![]()
![]() .
Система S
находится в состоянии с минимальной
энергией
.
Система S
находится в состоянии с минимальной
энергией
![]() .
Перевод системы S
в более высокое энергетическое состояние
.
Перевод системы S
в более высокое энергетическое состояние
![]() является эндоэргическим процессом (
является эндоэргическим процессом (![]() ).
Чтобы систему S
с энергией
перевести в состояние с большей энергией
).
Чтобы систему S
с энергией
перевести в состояние с большей энергией
![]() надо затратить энергию
больше, чем
надо затратить энергию
больше, чем
![]() ,
так как часть энергии расходуется на
преодоление потенциального барьера.
Получив необходимую энергию
,
система S
оказывается на вершине потенциального
барьера. Далее система S
может спонтанно перейти в состояние с
энергией
с выделением тепловой энергии
,
так как часть энергии расходуется на
преодоление потенциального барьера.
Получив необходимую энергию
,
система S
оказывается на вершине потенциального
барьера. Далее система S
может спонтанно перейти в состояние с
энергией
с выделением тепловой энергии
![]() .
(5.3)
.
(5.3)
Таким
образом, эндоэргический процесс должен
сопрягаться с экзоэргическим процессом,
при котором высвобождается энергия
больше, чем
![]() ,
то есть сопряженный процесс в целом
всегда является экзотермическим.
,
то есть сопряженный процесс в целом
всегда является экзотермическим.
В
связи с этим заметим, что понятия
экзоэргический и экзотермический не
идентичны. Если в экзотермическом
процессе вся энергия
переходит в тепло, то в экзоэргическом
процессе при энергетическом сопряжении
только часть энергии
![]() переходит в тепло, а основная доля
энергии
расходуется на осуществление эндоэргической
реакции
переходит в тепло, а основная доля
энергии
расходуется на осуществление эндоэргической
реакции
![]() .
.
Основной проблемой при описании энергетически сопряженных реакций является вопрос о том, какие физико-химические процессы обеспечивают перенос энергии от системы А к системе S (рис. 5–1). Известно, что в экзотермическом процессе выделяющаяся энергия превращается в тепло, то есть изменение электронного состояния при переходе системы с верхнего на нижний энергетический уровень вызывает колебательный процесс – рождение фононов. Время релаксации энергии в процессах электронно-колебательной релаксации по порядку величины сравнимо с периодом колебания атомов и групп атомов в молекулах и составляет (10–11 ÷10–12) с. Поэтому бездиссипативная (не тепловая) передача энергии от системы А к системе S принципиально возможна только в том случае, если процесс передачи энергии осуществляется за время, меньшее (10–11 ÷10–12) с. Только при этом условии энергия, сосредоточенная на химических связях системы А не успеет диссипировать в тепло. Очевидно, что, если системы А и S связаны слабо или разделены в пространстве, то энергетическое сопряжение систем не возможно. Поэтому, чтобы реакции энергетического сопряжения были возможны, должны выполняться определенные условия.
Во-первых, для их осуществления необходим единый комплекс сильно связанных молекул, в котором энергия передается за один акт без тепловых потерь.
Во-вторых, сопряжение двух реакций (экзо- и эндоэргических) может реализоваться только при образовании общего промежуточного продукта, являющегося посредником в передаче энергии от системы А к системе S. На первой стадии образуется промежуточный продукт с понижением энергии (экзоэргический процесс). На второй стадии часть выделившейся энергии, равная ΔGА > 0, используется для стимуляции эндоэргической реакции энергетически сопряженного процесса с повышением энергии.
Существует ряд гипотез, предложенных для описания конкретных механизмов передачи энергии, некоторые из них будут рассмотрены ниже.
