
- •105066, Москва, Старая Басманная ул., 21/4
- •Лабораторная работа № 1 Определение адсорбции уксусной кислоты на угле
- •Элементы теории
- •Обработка результатов эксперимента.
- •Вопросы к защите
- •Лабораторная работа № 2 Получение золя гидроксида железа (III) и определение его порога коагуляции
- •Элементы теории
- •Проведение эксперимента
- •Обработка результатов эксперимента
- •Вопросы к защите
- •Лабораторная работа №3 Определение критической концентрации мицеллообразования (ккм) в растворе пав методом электропроводности
- •Основы теории
- •Выполнение работы.
- •Обработка результатов эксперимента
- •Вопросы к защите
- •Лабораторная работа №4 Дисперсионный анализ эмульсий методом микроскопирования. Исследование распределения капель в эмульсии керосина в воде
- •Основы теории
- •Выполнение работы
- •1. Приготовление эмульсии.
- •3. Обработка результатов.
- •Вопросы к защите
- •Литература
![]()
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО КОЛЛОИДНОЙ ХИМИИ
Федеральное агентство по образованию
Московский государственный машиностроительный университет
ЛАБОРАТОРНЫЕ РАБОТЫ
ПО КОЛЛОИДНОЙ ХИМИИ
Методические указания
Москва
2013
Учебное издание
Составители:
Мишустин Александр Иванович,
Чубукова Ирина Андреевна
Лабораторные работы
по коллоидной химии
Подписано в печать
Формат бум. 60 x 84 1/16.
Объем усл. п. л. . Уч.-изд. л.. Тираж 100 экз. Зак.
МГМУ, издательский центр,
105066, Москва, Старая Басманная ул., 21/4
УДК 541.1
ББК 24.5
М
Рецензенты:
Допущено редакционно-издательским советом МГУИЭ
Мишустин А.И., Чубукова И.А.
М Лабораторные работы по коллоидной химии: Методические указания /Сост.: А.И. Мишустин, И.А. Чубукова; - М.: МГМУ, 16. —16 с.
Методические указания предназначены студентам МГМУ, обучающимся по специальностям, программа обучения которых включает дисциплину «Коллоидная химия».
УДК 544
ББК 24.5
© А.И. Мишустин, И. А. Чубукова
© МГМУ, 2013
3
.

Лабораторная работа № 1 Определение адсорбции уксусной кислоты на угле
Цель работы: рассчитать удельную величину адсорбции уксусной кислоты на угле, построить изотермы адсорбции, графически определить параметры уравнения Фрейндлиха и проверить его применимость к адсорбции органических кислот из водных растворов на угле.
Элементы теории
Активированный уголь является пористым адсорбентом с неоднородной поверхностью. Отдельные участки этой поверхности имеют различную адсорбционную активность, поэтому на каждом участке поверхности активированного угля могут образоваться адсорбционные молекулярные слои разной толщины - в одну молекулу (мономолекулярная адсорбция) или в несколько молекул (полимолекулярная адсорбция).
Количество вещества (адсорбата) в молях, адсорбированного 1 граммом адсорбента, называется удельной адсорбцией А. График зависимости А от равновесной концентрации раствора называется изотермой адсорбции. Известно 5 типов изотерм адсорбции, один из которых соответствует мономолекулярной адсорбции (изотерма адсорбции Лэнгмюра). В общем случае удельная адсорбция на твердой поверхности не может быть теоретически рассчитана по адсорбционному уравнению Гиббса (см. учебник коллоидной химии), так как нет приемлемых методов измерения поверхностного натяжения на границе раздела твёрдое тело – жидкость. Для адсорбции на поверхности активированного угля газов и неэлектролитов, а также слабых электролитов, зависимость удельной адсорбции от равновесной концентрации раствора (в области средних концентраций) может быть описана эмпирическим уравнением изотермы адсорбции Фрейндлиха:
![]() (1),
(1),
где х – количество адсорбата (в молях), m – масса адсорбента (в г), с – равновесная концентрация раствора, К и 1/n – константы.
Постоянная К зависит от природы адсорбента и адсорбата и колеблется в широких пределах. Её физический смысл – это величина удельной адсорбции при равновесной концентрации, равной единице. Значение адсорбционного показателя 1/n лежит в пределах от 0,1 до 1 и зависит от температуры и природы адсорбата. Обе константы легко определяются графически. Для этого логарифмируют уравнение (1), преобразуя его в уравнение прямой:
![]() . (2)
. (2)
Количество адсорбированного вещества (адсорбата) определяют по изменению его концентрации в растворе. Необходимо учитывать, что при адсорбции на твердой поверхности адсорбента, в особенности пористого, к которым относится активированный уголь, адсорбционное равновесие устанавливается медленно, так как скорость адсорбции лимитируется наиболее медленной стадией – диффузией.
Определив экспериментально ряд значений х/m, строят график в координатах lg(x/m) – lg c (рис.1). Отрезок прямой, отсечённый на оси ординат, представляет собой величину lg K, а тангенс угла наклона прямой – величину 1/n.
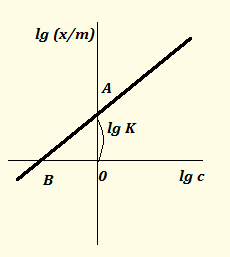
Рис.1
При расчёте по уравнению Фрейндлиха значение и размерность удельной адсорбции зависят от способа выражения равновесной концентрации (моль/л).
В данной работе исследуется поглощение уксусной кислоты из водных растворов поверхностью активированного угля. Для определения удельной адсорбции берутся объёмы растворов, равные 50 мл. Для определения количества адсорбированной кислоты х необходимо сначала определить её содержание (величину a в ммоль) в 50 мл раствора до адсорбции, с концентрацией с0. Величину a находят по формуле:
a = c0.50 (3),
Затем определяют содержание кислоты (величину b в ммоль) в 50 мл раствора после адсорбции, с концентрацией сравн :
b = cравн.50 (4).
Равновесные концентрации кислоты сравн (моль/л) обычно вычисляют по данным титрования раствором щелочи:
сравн = СщелочиVщелочи/Vкислоты (5),
где Сщёлочи и Vщёлочи - концентрация и объём щёлочи, пошедшие на титрование; Vкислоты – объём раствора кислоты, взятый для титрования.
Количество (ммоль) адсорбированной кислоты рассчитывается по формуле:
х = a – b (6).
Разделив х на массу угля m, находят удельную адсорбцию (моль/г) для каждого раствора кислоты:
А = x/m. (7)
Эту величину, а также сравн определяют для нескольких растворов кислоты с различными начальными концентрациями с0. На основании результатов и расчётов строят график изотермы адсорбции х/m = f(cравн).
Для определения констант уравнения Фрейндлиха К и 1/n находят значения логарифмов х/m и сравн и строят график линейной формы изотермы адсорбции.
Если точки ложатся на прямую, уравнение Фрейндлиха применимо для описания данного типа адсорбции, и можно определить параметры К и n этого уравнения.
Выполнение работы.
Группы студентов по 3-4 человека получают по банке с раствором уксусной кислоты неизвестной для них концентрации. Каждая группа имеет 6 пронумерованных колб, 3 вспомогательные колбы, воронки и бумажные фильтры, мерные цилиндры на 10 мл и на 50 мл, активированный уголь, ступку с пестиком.
В 3 вспомогательные колбы наливают по 10 мл исходного раствора кислоты неизвестной концентрации и оставляют их для титрования. Также из исходного раствора готовят последовательным разбавлением водой вдвое 6 растворов по 50 мл каждого и помещают в пронумерованные колбы. Сначала в колбу №1 наливается точно 50 мл исходного раствора из банки. Чтобы предусмотреть возможные ошибки при разбавлении, в колбу №2 можно налить раствор кислоты с небольшим запасом, например, 60 мл исходного раствора из банки, и затем добавить столько же по объему дистиллированной воды. Затем смесь тщательно перемешивается. Из полученной смеси отливается 60 мл и помещается в колбу №3. Оставшийся раствор в колбе №2 доводится (отливанием избытка) до объема точно 50 мл. К 60 мл раствора в колбе №3 добавляется 60 мл воды, смесь тщательно перемешивается. Из колбы отливается 60 мл смеси в колбу №4 и повторяют операции, описанные выше. Операции разбавления повторяются до заполнения колбы №6. В конце этих операций получаем 6 колб, в каждой из которых содержится точно по 50 мл растворов уксусной кислоты с разными концентрациями, последовательно отличающимися вдвое.
Далее, на весах отвешивают 6 навесок растёртого в ступках активированного угля по 1 г.
В каждую из шести колб с растворами уксусной кислоты вносят навеску угля и закрывают пробкой, затем тщательно перемешивают с периодическим взбалтыванием в течение 40мин, для ускорения достижения адсорбционного равновесия.
Параллельно в это время можно определить концентрацию выданного преподавателем исходного раствора уксусной кислоты (сисх). Для этого три раза титруют исходный раствор кислоты (отлитые ранее 10 мл исходного раствора в каждой из 3 колб) раствором NaOH с концентрацией 0.1моль/л в присутствии индикатора (добавляют 2-3 капли раствора фенолфталеина). Из трёх определений находят средний результат (Vсредн) и рассчитывают концентрацию исходного раствора по формуле:
Сисх = сщел∙Vщел/V0,
где V0 – объем исходного раствора, взятый для титрования (10 мл). Концентрации уксусной кислоты в последовательно разбавленных растворах, помещённых в колбы №№ 1 – 6, рассчитывают на основе этого результата.
По истечении заданного времени адсорбции (40 мин) образовавшуюся суспензию угля в шести колбах отфильтровывают через бумажные складчатые фильтры, смоченные растворителем. Первые порции фильтратов (10 мл) отбрасывают, т.к. в них концентрация кислоты может быть понижена за счёт адсорбции фильтровальной бумагой. Концентрацию равновесного раствора кислоты (сравн) в фильтратах также определяют титрованием, так же, как и исходного, Однако, поскольку часть кислоты из раствора перешла в адсорбированное состояние, концентрация понизилась, в этот раз титрование проводят раствором щёлочи меньшей концентрации (0.02моль/л). Для титрования берут из каждой из шести колб точно по 10 мл или (в последних колбах с наиболее разбавленными исходными растворами уксусной кислоты) по 20 мл фильтрата. Равновесные концентрации рассчитываются по формуле (5).
