
- •Часть I.
- •Часть I.
- •Список условных обозначений
- •Оглавление
- •Этиология воспаления
- •Причинные факторы воспаления (флогогены)
- •Патогенез воспаления Альтерация
- •Медиаторы воспаления
- •Сосудистая реакция
- •Экссудация и эмиграция лейкоцитов
- •Виды и состав экссудата
- •4. Внутриклеточное умерщвление и переваривание объекта.
- •Пролиферация
- •Системные эффекты при воспалении
- •Исходы острого воспаления
- •Классификация воспаления
- •Виды воспаления
- •Биологическое значение воспаления
Виды и состав экссудата
Биологическое значение экссудации:
1) отграничение очага воспаления от окружающих здоровых тканей (локализация повреждения);
2) дилюция (разбавление) вредных веществ – бактериальных токсинов, токсических продуктов распада тканей, метаболитов;
3) нейтрализация возбудителей воспаления (флогогенов) и поврежденных клеток с помощью защитных белков - иммуноглобулинов (антител), ферментов, лейкоцитов.
Наряду с положительным значением при определенных условиях экссудация может вызвать осложнения воспалительного процесса: 1) поступление экссудата в полости тела с развитием плеврита, перитонита, перикардита; 2) сдавление близлежащих органов; 3) образование гноя с развитием абсцесса, флегмоны, пиемии; 3) образование спаек может вызвать нарушение функций органов; 4) усиление воспалительной боли; 5) сдавление сосудов приводит к нарушению микроциркуляции (венозная гиперемия и стаз), что усугубляет нарушения метаболизма в воспалительном очаге; 6) образование свищей.
Эмиграция (от лат. emigrare – выселяться, переселяться) – выход лейкоцитов из сосудов в ткань, является ключевым событием патогенеза воспаления, поскольку лейкоциты являются основными эффекторами воспаления.
Выход лейкоцитов в очаг воспаления происходит, в основном, через стенки посткапиллярных венул. Различают следующие стадии эмиграции (рис. 3):
I – обратимая адгезия, скольжение лейкоцитов;
II – необратимая адгезия к эндотелию, трансэндотелиальная миграция;
III – хемотаксис.
Механизмы эмиграции.
I
 стадия. Эмиграция начинается с краевого
стояния (маргинации) лейкоцитов и их
адгезии к сосудистому эндотелию (рис.
2). Этому способствует экспрессия молекул
клеточной адгезии - селектинов на
поверхности эндотелиоцитов, соответствующих
определенным рецепторам лейкоцитов.
Экспрессия индуцируется медиаторами
воспаления – ИЛ-1, ФНО- альфа, ЛТ В4, С 5а
фрагментом системы комплемента,
гистамином, а также ЛПС. В результате
эндотелиоциты приобретают способность
«отбирать» лейкоциты, рецепторы которых
соответствуют эндотелиальным селектинам.
Такими лейкоцитами являются,
преимущественно, нейтрофильные
гранулоциты. Однако, вследствие непрочного
взаимодействия последние покидают
места контакта с эндотелием и перекатываются
(скользят) вдоль стенки сосуда (роллинг).
стадия. Эмиграция начинается с краевого
стояния (маргинации) лейкоцитов и их
адгезии к сосудистому эндотелию (рис.
2). Этому способствует экспрессия молекул
клеточной адгезии - селектинов на
поверхности эндотелиоцитов, соответствующих
определенным рецепторам лейкоцитов.
Экспрессия индуцируется медиаторами
воспаления – ИЛ-1, ФНО- альфа, ЛТ В4, С 5а
фрагментом системы комплемента,
гистамином, а также ЛПС. В результате
эндотелиоциты приобретают способность
«отбирать» лейкоциты, рецепторы которых
соответствуют эндотелиальным селектинам.
Такими лейкоцитами являются,
преимущественно, нейтрофильные
гранулоциты. Однако, вследствие непрочного
взаимодействия последние покидают
места контакта с эндотелием и перекатываются
(скользят) вдоль стенки сосуда (роллинг).
II стадия. Необратимая адгезия лейкоцитов осуществляется при действии другой группы молекул клеточной адгезии – интегринов, например, СД 18, и их лигандов на эндотелии ( ICAM-1,2,3; VCAM-1).
Адгезия
Скольжение
Диапедез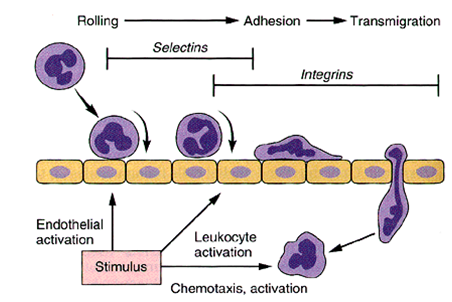
Селектины
Интегрины
Активация
эндотелия
Активация
лейкоцитов
Стимул
Активация
хемотаксиса
Рис.3 Стадии и механизмы эмиграции
лейкоцитов.
Прочная адгезия к эндотелию – необходимое условия для трансэндотелиальной миграции (диапедеза) лейкоцитов. В эмиграции лейкоцитов наблюдается определенная очередность: сначала мигрируют нейтрофильные гранулоциты через щели между эндотелиоцитами (интерэндотелиальный механизм миграции). За ними мигрируют моноциты и, наконец, лимфоциты. Мононуклеары мигрируют с помощью трансэндотелиального механизма, т.е. непосредственно через эндотелиальные клетки. Преодоление следующего барьера – базальной мембраны сосудистой стенки, осуществляется под действием лизосомных гидролаз лейкоцитов (протеиназ, эластазы, коллагеназы, гиалуронидазы), которые путем гидролиза соответствующих субстратов изменяют коллоидное состояние базальной мембраны (переход геля в золь) и таким путем облегчают выход лейкоцитов в ткань.
III стадия. Хемотаксис (греч. taxis – порядок), или направленное движение лейкоцитов к центру очага повреждения, осуществляется по градиенту хемоаттрактантов (лат. attraction – притяжение), максимальная концентрация которых возникает в участке наибольшего повреждения ткани (в эпицентре очага воспаления) (табл. 5).
Начальный этап (1-я стадия) эмиграции лейкоцитов длится 30-60 минут, второй этап (2-я стадия) – несколько минут, третий этап (3-я стадия) - несколько суток. Обычно через 2-3 суток вышедшие в ткань нейтрофильные гранулоциты, выполнившие свои функции, погибают и элиминируются из очага воспаления. Продолжительность жизни трансформировавшихся в макрофаги моноцитов в тканях значительно большая.
Классификация хемоаттрактантов
|
|
Хемоаттрактанты
|
|
Экзогенные |
Эндогенные |
микроорганизмы и продукты их распада |
-компоненты систем плазмы крови: С3 а, С5 а, калликреин, брадикинин, активатор плазминогена, тромбин; -продукты повреждения и метаболизма клеток: пурины – АТФ, ДНК; ФХН, ФХЭ, ФАТ, метаболиты арахидоновой кислоты ЛТ В4, ТхА2; -продукты деградации фибрина и коллагена; -другие медиаторы воспаления: катионные белки нейтрофилов, фибронектин, С – реактивный белок, - иммунные комплексы; Ig E; - хемокины: 1) ИЛ-8, ИЛ-1, воспалительный протеин-10 (IP – 10) 2) MIP - 1,2; MCP – 1,2,3,4; эотаксин и др.
|
Таблица 5
Наряду с хемоаттрактантами в регуляции направленного движения лейкоцитов к очагу воспаления участвуют и вещества, ингибирующие хемотаксис. К ним относятся: трипсин, хемотрипсин, ацетилхолинэстераза; кортикостероиды – гидрокортизон, преднизолон.
Поступившие с экссудатом в очаг воспаления лейкоциты, выполняют различные функции. Согласно И.И.Мечникову, центральным событием воспаления является фагоцитоз.
Фагоцитоз – эволюционно выработанная клеточная защитная реакция, проявляющаяся в узнавании, активном захвате (поглощении) и переваривании микроорганизмов, разрушенных клеток и инородных частиц специализированными клетками – «профессиональными» фагоцитами.
К последним относят гранулоциты, преимущественно нейтрофильные, и клетки системы мононуклеарных фагоцитов – моноциты и тканевые макрофаги.
Фагоцитам присущи три функции: 1 – защитная; 2 - представляющая (презентация антигена на мембране фагоцита); 3 – секреторная (секреция лизосомных ферментов и других БАВ).
Различают следующие стадии фагоцитоза (рис. 5):
1 – хемотаксис (приближение к объекту фагоцитоза);
2 – прилипание (аттракция, адгезия);
3– захват объекта фагоцитоза (преимущественно рецепторный эндоцитоз);
4 – внутриклеточное умерщвление и переваривание объекта.
1. Хемотаксис - направленное движение клеток, привлечённых хемоаттрактантами, выделяемыми микроорганизмами или поврежденными клетками и тканями.
Хемотаксис складывается из трех компонентов:
1) выбор вектора движения,
2) его стабилизация,
3) собственно движение.
Повреждение одного из этих компонентов нарушает нормальное течение процесса.
Выбор и стабилизация вектора движения – результат перераспределения внутриклеточных органелл, направленного на ориентацию нейтрофилов в хемотаксическом градиенте. Рецепция хемоаттрактантов плазматической мембраной фагоцита индуцирует сложную, многоэтапную реакцию, которая фиксирует пространственную ориентацию и активирует двигательный аппарат нейтрофила. Механизм хемотаксиса заключается в том, что вещества, вызывающие этот процесс, являются раздражителями цитоплазмы лейкоцитов и их органоидов – микрофиламентов и микротрубочек. Это раздражение вызывает деполяризацию поверхностной мембраны клетки и понижение поверхностного натяжения на границе клетка- среда. Образуется псевдоподия, в которую переливается часть цитоплазмы. Сокращение микрофиламентов подтягивает часть клетки вперед в направлении большей концентрации вещества, вызвавшего хемотаксис. В присутствие колхицина, который дезагрегирует микротрубочки, нейтрофил не поляризует свои органеллы, лишаясь способности к направленному движению. Случайная миграция и хемокинетическая функция ( ненаправленное, т.е. хаотичное движение) не страдают.
Движение лейкоцитов в воспаленной ткани продолжается много часов и суток. Причиной гибели лейкоцитов является вредное воздействие на них состава и свойств измененной воспалением ткани: увеличенного осмотического давления, местного ацидоза (снижение рН до 6 – 5 против 7,4 в норме), увеличенного содержания ионов калия, действия бактериальных токсинов и др.
Определенная регулирующая роль в отношении хемотаксиса принадлежит циклическим нуклеотидам: цАМФ подавляет, а цГМФ – стимулирует хемотаксис. При нарушении хемотаксиса фагоцитоз подавлен, что способствует развитию и неблагоприятному течению инфекционных заболеваний.
2. Адгезия – вторая стадия фагоцитоза. Адгезия – прилипание фагоцитов к объекту фагоцитоза. Адгезия осуществляется в первую очередь благодаря электростатическому взаимодействию между микробными телами и фагоцитам, что, как правило, происходит при учистии системы комплемента и специфических антител. В процессе узнавания фагоцитами микробов, веществ и частиц большую роль играют особые компоненты сыворотки крови – опсонины, облегчающие фагоцитоз. К ним относятся антитела Ig G1, IgG3, IgM, агрегированные IgA1 и IgA2, термолабильные компоненты комплемента, в основном C3b, а также альфа-1 и бета - глобулины, сывороточные альфа-2 гликопротеид, С - реактивный белок и другие.
Антитела IgC и IgM специфически связываются с антигеном, а их Fс – компонент - с Fс-рецептором фагоцитов. Фагоциты могут соединяться с объектом фагоцитоза и неспецифически – через гидрофобные связи Ван- дер- Вальса. Если частица опсонизирована иммуноглобулином и комплементом, связывание с фагоцитом осуществляется кооперативно через специфические к ним рецепторы, что значительно активирует ее поглощение.
В момент прилипания фагоцита к микроорганизмам в нем наблюдается так называемый метаболический, или респираторный взрыв. Он проявляется выраженным (в 2 – 5 раз) потреблением кислорода, активацией окисления глюкозы в пентозо-фосфатном цикле, что ведет к синтезу НАДФ-Н2. Последний расходуется для восстановления молекулярного кислорода с образованием активных форм кислорода – супероксид-анион радикала синглетного кислорода, гидроксильного радикала и перекиси водорода, являющихся сильнейшими бактерицидными факторами.
3. Поглощение чужеродного агента (эндоцитоз).
Взаимодействие частицы с плазматической мембраной фагоцита посредством образующихся комплексов опсонин- рецептор запускает механизм рецепторного эндоцитоза, основная роль в котором принадлежит работе сократительных белков, способствующих образованию псевдоподий.
Данный этап идет с потреблением энергии и завершается образованием фагосомы. У нейтрофилов потребляется энергия, запасенная в виде АТФ, образованной в результате гликолиза. Этот этап также сопровождается метаболическим взрывом и накоплением образуются активные формы кислорода, токсичные для микробов: супероксидный анион, перекись водорода, гидроксильный радикал. Фагоциты имеют систему антиокислительной защиты от разрушения активными формами кислорода, представленную СОД, каталазой, глутатионпероксидазой, восстановленным глутатионом.
