- •1.Биологическая роль кислорода в организме человека. Применение препаратов в медицине
- •2. Биологическая роль углерода в организме человека. Применение препаратов в медицине
- •3. Биологическая роль натрияи калия в организме человека. Применение препаратов в медицине.
- •4. Биологическая роль кальция в организме человека. Применение препаратов в медицине.
- •6. Биологическая роль железа в организме человека. Применение препаратов в медицине.
- •7. Биологическая роль цинка в организме человека. Применение препаратов в медицине.
- •Пиритион цинк активированный (Pyrithionezinc). Синонимы:Скин-кап
- •Цинка сульфат (Zincsulfate)
- •Поверхностное натяжение, поверхностная активность. Уравнение Гиббса. Пав, особенности строения, примеры, применение. Схема строения клеточной мембраны
- •Адсорбция на границе раздела твердое тело – газ. Изотерма адсорбции. Уравнение Ленгмюра.
- •Адсорбция на границе твердое тело – раствор. Правило Ребиндера. Изотерма адсорбции.Уравнение Ленгмюра.Гемосорбция, энтеросорбция.
- •Адсорбция электролитов. Правило Панета-Фаянса.
- •Хроматографические методы исследования. Классификация. Применение в медицине.
- •Общая характеристика вмс. Классификация. Применение в медицине. Коллоидная защита
- •Изоэлектрическая точка белка. Изменение свойств белков в изоэлектрическом состоянии
- •1.Координационная теория а. Вернера. Состав и классификация комплексных соединений
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Свойства коллоидных растворов
- •Классификацияколлоидныхрастворовпоагрегатному состоянию дисперсной фазы и дисперсионной среды. Примеры.
- •Охарактеризовать методы получения коллоидных растворов.
- •Методы диспергирования
- •Методы конденсации
- •Методы очистки коллоидных растворов. Схема диализа.Гемодиализ.
- •Молекулярно-кинетические свойства коллоидных растворов.
- •Электрокинетические свойства коллоидных растворов. Применение электрофореза в медицине
- •Факторы устойчивости коллоидных растворов. Коагуляция. Порог коагуляции. Правило Шульце-Гарди.
Поверхностное натяжение, поверхностная активность. Уравнение Гиббса. Пав, особенности строения, примеры, применение. Схема строения клеточной мембраны
Поверхностное натяжение (σ)-стремление вещества (жидкости или твердой фазы) уменьшить избыток своей потенциальной энергии на границе раздела с др. фазой (поверхностную энергию). Определяется как работа, затрачиваемая на создание единицы площади поверхности раздела фаз (размерность Дж/м2). Согласно др. определению, поверхностное натяжение-сила, отнесенная к единице длины контура, ограничивающего поверхность раздела фаз (размерность Н/м); эта сила действует тангенциально к поверхности и препятствует ее самопроизвольному увеличению.Поверхностное натяжение различных жидкостей на границе с собственным паром изменяется в широких пределах: от единиц для сжиженных низкокипящих газов до неск. тыс. мН/м для расплавленных тугоплавких в-в. Поверхностное натяжение зависит от температуры. Для мн. однокомпонентных неассоциирующихжидкостей (вода, расплавы солей, жидкие металлы) вдали от критической температуры хорошо выполняется линейная зависимость:
![]() где
σ и σ0-поверхностное натяжение
при температурах T и T0 соотв., a
где
σ и σ0-поверхностное натяжение
при температурах T и T0 соотв., a![]() 0,1
мН/(м·К)-температурный коэффициент
поверхностного натяжения. Основной
способ регулирования поверхностного
натяжения заключается в
использовании поверхностно-активных
веществ (ПАВ).
0,1
мН/(м·К)-температурный коэффициент
поверхностного натяжения. Основной
способ регулирования поверхностного
натяжения заключается в
использовании поверхностно-активных
веществ (ПАВ).
Поверхностная активность, способность вещества при адсорбции на границе раздела фаз понижать поверхностное натяжение(межфазное натяжение). Адсорбция Г в-ва и вызванное ею понижение поверхностного натяжения s связаны с концентрацией с вещества в фазе, из которой в-во адсорбируется на межфазную поверхность, уравнением Гиббса (1876):
 где
R-газовая постоянная, Т-абсолютная
температура (см. Адсорбция).
Производная
где
R-газовая постоянная, Т-абсолютная
температура (см. Адсорбция).
Производная ![]() служит
мерой способности вещества
понижать поверхностное
натяжение на данной
межфазной границе и также наз.
поверхностной активностью.
Обозначается G (в честь Дж.
Гиббса), измеряется в Дж·м/моль (гиббсах).
Поверхностную активность определяют
с помощью изотерм адсорбции,
на которых можно выделить линейный
участок роста Г
с увеличением
с и предельное значение
служит
мерой способности вещества
понижать поверхностное
натяжение на данной
межфазной границе и также наз.
поверхностной активностью.
Обозначается G (в честь Дж.
Гиббса), измеряется в Дж·м/моль (гиббсах).
Поверхностную активность определяют
с помощью изотерм адсорбции,
на которых можно выделить линейный
участок роста Г
с увеличением
с и предельное значение ![]() ,
соответствующее насыщению адсорбционного
слоя.
,
соответствующее насыщению адсорбционного
слоя.
ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА, в-ва, адсорбция к-рых из жидкости на пов-сти раздела с др. фазой (жидкой, твердой или газообразной) приводит к значит.понижению поверхностного натяжения. В наиб. общем и важном с практич. точки зрения случае адсорбирующиеся молекулы (ионы) ПАВ состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводородная жидкость, неполярная пов-сть твердого тела) обладает углеводородный радикал, к-рый выталкивается из полярной среды. В водном р-ре ПАВ на границе с воздухом образуется адсорбц. мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно пов-сти.
В зависимости от состояния ПАВ в р-ре условно различают истинно р-римые (молекулярно-диспергированные) и коллоидные ПАВ. Условность такого разделения состоит в том, что одно и то же ПАВ может относиться к обеим группам в зависимости от условий и хим. природы (полярности) р-рителя. Обе группы ПАВ адсорбируются на фазовых границах, т. е. проявляют в р-рах поверхностную активность, в то время как объемные св-ва, связанные с возникновением коллоидной (мицеллярной) фазы, проявляют лишь коллоидные ПАВ. Указанные группы ПАВ отличаются значением безразмерной величины, к-рая наз. гидрофильно-липофильным балансом (ГЛБ) и определяется отношением:
![]() где
где ![]() -сродство
(своб. энергия взаимодействия) неполярной
части молекулы ПАВ
к углеводородной жидкости (b-безразмерный
параметр, зависящий от природы
ПАВ,
-сродство
(своб. энергия взаимодействия) неполярной
части молекулы ПАВ
к углеводородной жидкости (b-безразмерный
параметр, зависящий от природы
ПАВ, ![]() -своб.
энергия взаимод. в расчете на одну группу
CH2, v-число групп CH2 в
углеводородном радикале), a-сродство
полярной группы к воде.
-своб.
энергия взаимод. в расчете на одну группу
CH2, v-число групп CH2 в
углеводородном радикале), a-сродство
полярной группы к воде.
Классификация ПАВ принятая на III Международном конгрессе по ПАВ и рекомендованная Международной организацией по стандартизации (ISO)в 1960. Она основана на хим. природе молекул и включает четыре основных класса ПАВ: анионактивные (содержат группы COOH(M), OSO2OH(M), SO3H(M), где M-металл) ,катионактивные (азотсодержащие соед,, пиридина, хинолина, фталазина, бензи-мидазола, бензотиазола, бензотриазола, производные пир-ролидина, имидазола, пиперидина, морфолина, пиперазина, оксиды, аминов) неионогенные (RO (C2H4O)n H, RCOO (C2H4O)n H) и амфотерные (RNH (CH2)n COOH, RCH [N+ (CH3)3] COO- ). Иногда выделяют также высокомолекулярные (белки, нуклеиновые к-ты), перфторированные и кремнийорганические ПАВ, однако по химической природе молекул эти ПАВ могут быть отнесены к одному из вышеперечисленных классов.
Применение ПАВ. Мировоепроиз-во ПАВ составляет 2-3 кг на душу населения в год. Примерно 50% производимых ПАВ используется для бытовой химии (моющие и чистящие ср-ва, косметика), остальное-в пром-сти и с. х-ве. Одновременно с ежегодным ростом произ-ва ПАВ соотношение между их применением в быту и пром-сти изменяется в пользу пром-сти.
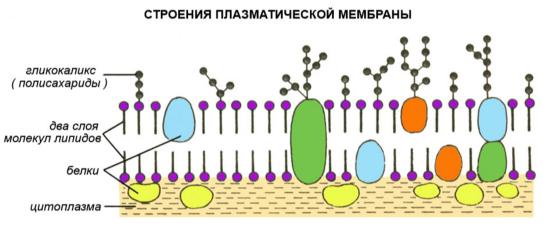
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7—8 нм.