
- •1.Биологическая роль кислорода в организме человека. Применение препаратов в медицине
- •2. Биологическая роль углерода в организме человека. Применение препаратов в медицине
- •3. Биологическая роль натрияи калия в организме человека. Применение препаратов в медицине.
- •4. Биологическая роль кальция в организме человека. Применение препаратов в медицине.
- •6. Биологическая роль железа в организме человека. Применение препаратов в медицине.
- •7. Биологическая роль цинка в организме человека. Применение препаратов в медицине.
- •Пиритион цинк активированный (Pyrithionezinc). Синонимы:Скин-кап
- •Цинка сульфат (Zincsulfate)
- •Поверхностное натяжение, поверхностная активность. Уравнение Гиббса. Пав, особенности строения, примеры, применение. Схема строения клеточной мембраны
- •Адсорбция на границе раздела твердое тело – газ. Изотерма адсорбции. Уравнение Ленгмюра.
- •Адсорбция на границе твердое тело – раствор. Правило Ребиндера. Изотерма адсорбции.Уравнение Ленгмюра.Гемосорбция, энтеросорбция.
- •Адсорбция электролитов. Правило Панета-Фаянса.
- •Хроматографические методы исследования. Классификация. Применение в медицине.
- •Общая характеристика вмс. Классификация. Применение в медицине. Коллоидная защита
- •Изоэлектрическая точка белка. Изменение свойств белков в изоэлектрическом состоянии
- •1.Координационная теория а. Вернера. Состав и классификация комплексных соединений
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Свойства коллоидных растворов
- •Классификацияколлоидныхрастворовпоагрегатному состоянию дисперсной фазы и дисперсионной среды. Примеры.
- •Охарактеризовать методы получения коллоидных растворов.
- •Методы диспергирования
- •Методы конденсации
- •Методы очистки коллоидных растворов. Схема диализа.Гемодиализ.
- •Молекулярно-кинетические свойства коллоидных растворов.
- •Электрокинетические свойства коллоидных растворов. Применение электрофореза в медицине
- •Факторы устойчивости коллоидных растворов. Коагуляция. Порог коагуляции. Правило Шульце-Гарди.
Молекулярно-кинетические свойства коллоидных растворов.
Установлено, что по своим молекулярно-кинетическим свойствам коллоидные растворы качественно не отличаются от истинных растворов низкомолекулярных веществ и обнаруживают лишь количественные различия. Молекулярно-кинетическая теория рассматривает коллоидные раствори как частный случай истинных растворов (дисперсная фаза - растворенное вещество, дисперсионная среда - растворитель). Это позволяет вполне удовлетворительно объяснить явления осмоса, диффузии, седиментационного равновесия и другие неспецифические свойства коллоидов.Как показали обширные теоретические и экспериментальные исследования, молекулярно кинетическая теория применима ко всем тем дисперсным системам, для которых выполняется два основных условия: 1 - частицы достаточно малы, чтобы принимать участие в тепловом движении, включая и броуновское (г 110-4 см); 2 - в единице объема содержится достаточно большое число частиц, чтобы можно было использовать законы статистики.
Рассмотрим эти свойства - явления, связанные с участием коллоидных частиц в тепловом движении.
Броуновское движение есть хаотическое и непрерывное движение частиц дисперсной фазы под действием ударов молекул дисперсионной среди, находящихся в состоянии интенсивного теплового движения.
Броуновское движение свойственно частицам любых веществ, если размеры их достаточно малы. От размера частиц зависит характер движения. Оно может бить колебательным, вращательным и поступательным. Особенно заметным броуновское движение становится у частиц коллоидной степени дисперсности.Испытывая с разных сторон многочисленные удары молекул жидкости, часть которых оказывается нескомпенсированной, такие частицы могут перемещаться поступательно в самых различных направлениях: статистически всегда возможно, что за время d число ударов молекул или их интенсивность (поскольку в большой совокупности молекул всегда имеются более "горячие", скорость которых превышает среднюю) с одной стороны будут больше, чем с другой; результирующая сила вызовет смещение частиц. Траектория их движения весьма сложна и представляет собой ломаную линию, совершенно неопределенной конфигурации (рис. 2.1).
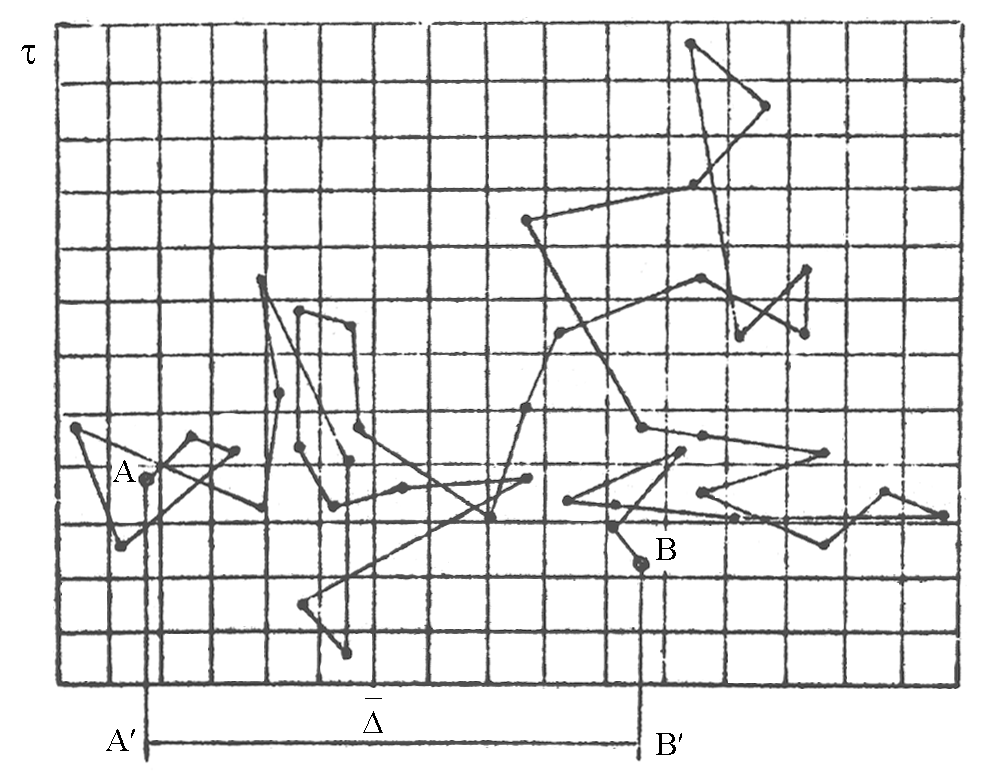
Рис.2.1. Схема перемещения частицы при броуновском движении:
- величина смещения от точки А до точки B: – время
Диффузией называют самопроизвольный процесс выравниванияконцентраций частиц по всему объему системы под влиянием теплового (или броуновского) движения.
Процесс диффузии всегда необратим. Он идет самопроизвольно, поскольку сопровождается увеличением энтропии системы. Равномерное распределение вещества в системе отвечает наиболее вероятному ее состоянию.
Количественно диффузия может быть описана уравнением, выражающим первый закон Фика в дифференциальной форме:
dm/dt = DS(-dc/dx), (2.6)
где dm/dt - масса вещества, продиффундировавшего за единицу времени, S- площадь поперечного сечения, через которое диффундирует вещество; dc/dx. - градиент концентрации, т.е. изменение концентрации на единицу расстояния в направлении процесса диффузии (величина, характеризующая степень невыравненности концентрации в системе). Знак минус указывает, что диффузия идет в сторону уменьшения концентрации; D - коэффициент диффузии.
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя.Малыевеличины осмотического давления обнаруживаются с трудом, не говоря уже о невозможности измерений с достаточной точностью даже при использовании современной измерительной техники.
Осмотическое давление, создаваемое коллоидными частицами, маскируется или искажается неизбежно присутствующими в золях примесями электролитов и растворимых низкомолекулярных веществ. Полностью очистить золь от таких примесей невозможно без нарушения его устойчивости. Также вследствие термодинамической неустойчивости коллоидных растворов в них непрерывно протекают процессы агрегации и дезагрегации, что приводит к непостоянству. Поэтому метод осмометрии для исследования коллоидных растворов применяется редко.
Перечисленные особенности коллоидных растворов затрудняют также измерение других связанных с осмотическим давлением величин: понижение упругости насыщенного пара, понижение температуры замерзания и повышение температуры кипения.
