
- •6.070800 «Экология и охрана окружающей среды»
- •Введение
- •1 Производство синтетического аммиака
- •1.1 Методы производства азота и водорода
- •1.2 Промышленный катализ
- •1.3 Очистка природных газов от соединений серы
- •1.4 Конверсия метана
- •1.5 Конверсия оксида углерода (II)
- •1.6 Технологическая схема производства конвертированного газа
- •1.7 Очистка конвертированного газа от диоксида углерода
- •1.8 Тонкая очистка конвертированного газа от кислородсодержащих соединений
- •1.9 Технологическая схема очистки конвертированного газа от кислородсодержащих соединений
- •1.10 Синтез аммиака из смеси азота и водорода
- •1.11 Синтез метанола из оксида углерода и водорода
- •2 Производство неорганических кислот
- •2.1 Производство азотной кислоты
- •2.2 Производство серной кислоты
- •3 Производство кальцинированной соды
- •3.1 Принципиальная схема производства соды аммиачным
- •3.2 Аммонизация очищенного рассола
- •3.3 Карбонизация аммонизированного рассола
- •3.4 Кальцинация гидрокарбоната натрия
- •3.5 Регенерация аммиака в производстве кальцинированной соды
- •4 Производство минеральных удобрений
- •4.1 Производство карбамида
- •4.2 Производство нитрата аммония
- •4.3 Производство сульфата аммония
- •4.4 Производство нитрата калия
- •4.5 Производство суперфосфата
- •Рекомендованная литература
1.5 Конверсия оксида углерода (II)
В результате конверсии метана различными окислителями получают газовую смесь, состоящую в основном из оксида углерода (II) и водорода. Дальнейшей технологической стадией переработки метана в водород является реакция конверсии оксида углерода (II) с водяным паром:
CО + H2O ↔ CO2 + H2 + 41,17 кДж.
Этот процесс настолько широко используется в промышленных масштабах, что стал одним из наиболее важных методов получения водорода. К тому же, учитывая в будущем замену углеводородного сырья каменным углем, данная реакция будет одной из основных в получении водорода.
При определенных условиях основная реакция сопровождается протеканием побочных процессов:
CО + 3H2 ↔ CН4 + H2О + Q
2CО ↔ C + CO2 + Q.
Протекание этих реакций приводит к увеличению расхода ценных продуктов (водорода), к образованию метана, содержание которого в азотоводородной смеси нежелательно, к выделению на катализаторе сажи.
Выходу водорода способствует применение пониженных температур, избытка водяного пара. Давление не оказывает влияния на термодинамическое равновесие, однако положительно сказывается на кинетических факторах и производительности системы (повышается скорость реакции, уменьшаются габариты аппаратуры, используется давление исходного газа).
Возможно также удаление из зоны реакции диоксида углерода, но этот метод не реализуется из-за сложности осуществления.
На рисунке 1.2 приведена зависимость равновесной степени превращения оксида углерода (ІІ) от температуры и соотношения объемов «пар:газ» в исходной парогазовой смеси. Состав газа, % об.: СО - 25; СО2 - 2,8; Н2 - 67,7; N2 -4,5.
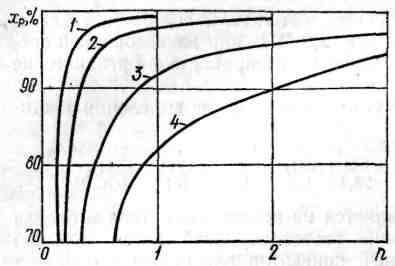
Значения температуры, К: 1 - 473, 2 - 573, 3 - 673, 4 - 773.
Рисунок 1.2 - Зависимость равновесной степени превращения оксида углерода (II) от соотношения «пар : газ»(n) и температуры
Анализ графических данных показывает, что увеличение соотношения «пар : газ» выше чем 2 : 1 нецелесообразно, поскольку в этом случае равновесная степень превращения оксида углерода (II) повышается незначительно.
Оптимальная температура процесса определяется типом и активностью катализатора, заданной степенью превращения оксида углерода (II) и выбором технологической схемы конверсии оксида углерода (II) СО.
При пониженных температурах расход водяного пара можно уменьшить, что менее резко сказывается на степени превращения, которая в этом случае может быть довольно высокой.
В промышленных условиях процесс конверсии оксида углерода (II) проводят в две ступени. В первой ступени на оксидном среднетемпературном железохромовом катализаторе поддерживают температуру 710-740 К, обеспечивая высокую интенсивность процесса, не опасаясь неполного превращения оксида углерода (II), обусловленного состоянием равновесия. Во второй ступени на низкотемпературном катализаторе при 500-550 К и низкой концентрации СО на входе во вторую ступень 3-6 % об. процесс проводят фактически до равновесия. Такая схема позволяет повысить степень превращения оксида углерода (II), снизить расход водяного пара и таким образом увеличить выход основного продукта - водорода.
Реакция конверсии оксида углерода (II) с водяным паром имеет достаточную скорость лишь в присутствии катализаторов. На ускорение этого процесса влияют оксиды железа, хрома, кобальта, никеля. Оксиды меди обладают большей активностью, чем оксиды железа, однако в силу своей быстрой отравляемости сернистыми соединениями они долгое время не находили широкого применения.
В настоящее время как в нашей стране, так и за рубежом широкое распространение получили сравнительно дешевые среднетемпературные железохромовые катализаторы. Один из важнейших показателей катализатора, а именно его активность, пока еще невысок. Поэтому первоочередной задачей в усовершенствовании железохромовых катализаторов является разработка методов повышения их активности. Не восстановленный катализатор имеет состав – 78-82 % оксида железа (III) и 7-8 % оксида хрома (III). Остальное вещество – оксиды щелочных и щелочно-земельных металлов, вводимые в катализатор для уменьшения скорости протекания побочных реакций. Оптимальными условиями работы катализатора являются:
- рабочая температура – 350-450 оС;
- рабочее давление – 0,1-4 МПа;
- объемная скорость по условиям входа в реактор – 450-900 ч-1.
В последнее время при осуществлении тонкой очистки технологических газов от сернистых соединений разработаны низкотемпературные цинк-хромомедные катализаторы конверсии (НТК). Оптимальными условиями работы этого катализатора являются:
- рабочая температура – 175-300 оС;
- рабочее давление – 0,1-4 МПа;
- объемная скорость по условиям входа в реактор – до 2000 ч-1.
Процесс конверсии оксида углерода (II) на этом катализаторе даже при невысоком давлении протекает во внутридиффузионной области, поэтому важно усовершенствовать его пористую структуру, не уменьшая механической прочности.
В процессе конверсии оксида углерода (II) примеси сернистых соединений в контактной массе гидрируются до сероводорода, загрязняя конвертированный газ, и влияют на активность низкотемпературного медьсодержащего катализатора второй ступени конверсии оксида углерода (II). Пористая структура катализаторов конверсии, приготовленных различными способами, отличается главным образом объемом пор, что влияет на насыпную массу. Чем выше пористость, тем меньше насыпная масса и, следовательно, меньше расход катализатора на загрузку реактора. Восстановленные катализаторы в процессе промышленной эксплуатации мало изменяют свою пористость и их активность определяется лишь фазовым и химическим составами.
В промышленных условиях, когда процесс конверсии осуществляется в диффузионной области, торможение реакции диффузионными факторами протекает в порах катализатора и изменяется в зависимости от температуры. С другой стороны, активность катализатора зависит от пористой структуры и размеров его гранул. При одинаковой пористости формованных и таблетированных катализаторов их активность мало отличается друг от друга. С повышением давления в системе степень использования внутренней поверхности катализатора возрастает, что приводит к увеличению его производительности.
После конверсии оксида углерода (II) средний состав газовой смеси (% об.): СО2 - 17,1; СО – 0,5; Н2 – 62,1; СН4 – 0,3; N2 + Ar – 20,0.
