
- •6.070800 «Экология и охрана окружающей среды»
- •Введение
- •1 Производство синтетического аммиака
- •1.1 Методы производства азота и водорода
- •1.2 Промышленный катализ
- •1.3 Очистка природных газов от соединений серы
- •1.4 Конверсия метана
- •1.5 Конверсия оксида углерода (II)
- •1.6 Технологическая схема производства конвертированного газа
- •1.7 Очистка конвертированного газа от диоксида углерода
- •1.8 Тонкая очистка конвертированного газа от кислородсодержащих соединений
- •1.9 Технологическая схема очистки конвертированного газа от кислородсодержащих соединений
- •1.10 Синтез аммиака из смеси азота и водорода
- •1.11 Синтез метанола из оксида углерода и водорода
- •2 Производство неорганических кислот
- •2.1 Производство азотной кислоты
- •2.2 Производство серной кислоты
- •3 Производство кальцинированной соды
- •3.1 Принципиальная схема производства соды аммиачным
- •3.2 Аммонизация очищенного рассола
- •3.3 Карбонизация аммонизированного рассола
- •3.4 Кальцинация гидрокарбоната натрия
- •3.5 Регенерация аммиака в производстве кальцинированной соды
- •4 Производство минеральных удобрений
- •4.1 Производство карбамида
- •4.2 Производство нитрата аммония
- •4.3 Производство сульфата аммония
- •4.4 Производство нитрата калия
- •4.5 Производство суперфосфата
- •Рекомендованная литература
4.4 Производство нитрата калия
Нитрат калия (калиевая селитра) КNО3 - кристаллический бесцветный порошок. Технический продукт может иметь сероватый оттенок. Нитрат калия используют в производстве дымного (черного) пороха, в пиротехнике, в пищевой и стекольной промышленности. Он является ценным безбалластным удобрением, содержащим два питательных элемента - азот и калий (теоретическое содержание - 13,85 % азота и 46,5 % оксида калия). Другие преимущества этого удобрения - малая гигроскопичность и физиологическая щелочность. В основном его применяют в промышленности, так как стоимость азота и калия в нитрате калия больше, чем в других комплексных удобрениях.
Получение нитрата калия нейтрализацией азотной кислоты или при абсорбции оксидов азота гидроксидом или карбонатом калия применяют редко из-за дефицитности и высокой стоимости щелочных реагентов. Наибольшее промышленное распространение имеют конверсионные способы получения нитрата калия из хлорида калия и нитратов натрия, аммония, кальция. Например, при использовании хлорида калия и натрата кальция процесс возможно осуществить методом катионного обмена, попеременно обрабатывая катионит растворами нитрата кальция (с получением раствора нитрата калия) и хлорида калия (регенерация катионита). Далее раствор нитрата калия упаривают, охлаждают, отделяют кристаллы соли на центрифуге и сушат.
Представляет интерес получение нитрата калия из хлорида калия и азотной кислоты или оксидов азота.
4.4.1 Теоретические основы производства нитрата калия конверсионными способами
Наиболее распространен способ, основанный на обменном разложении:
KCl + NaNО3 = NаСl + КNО3.
На рисунке 4.9 изображена диаграмма растворимости в водной системе KCl + NaNО3 = NаСl + КNО3 при температурах 5, 25, 50 и 100 оС.
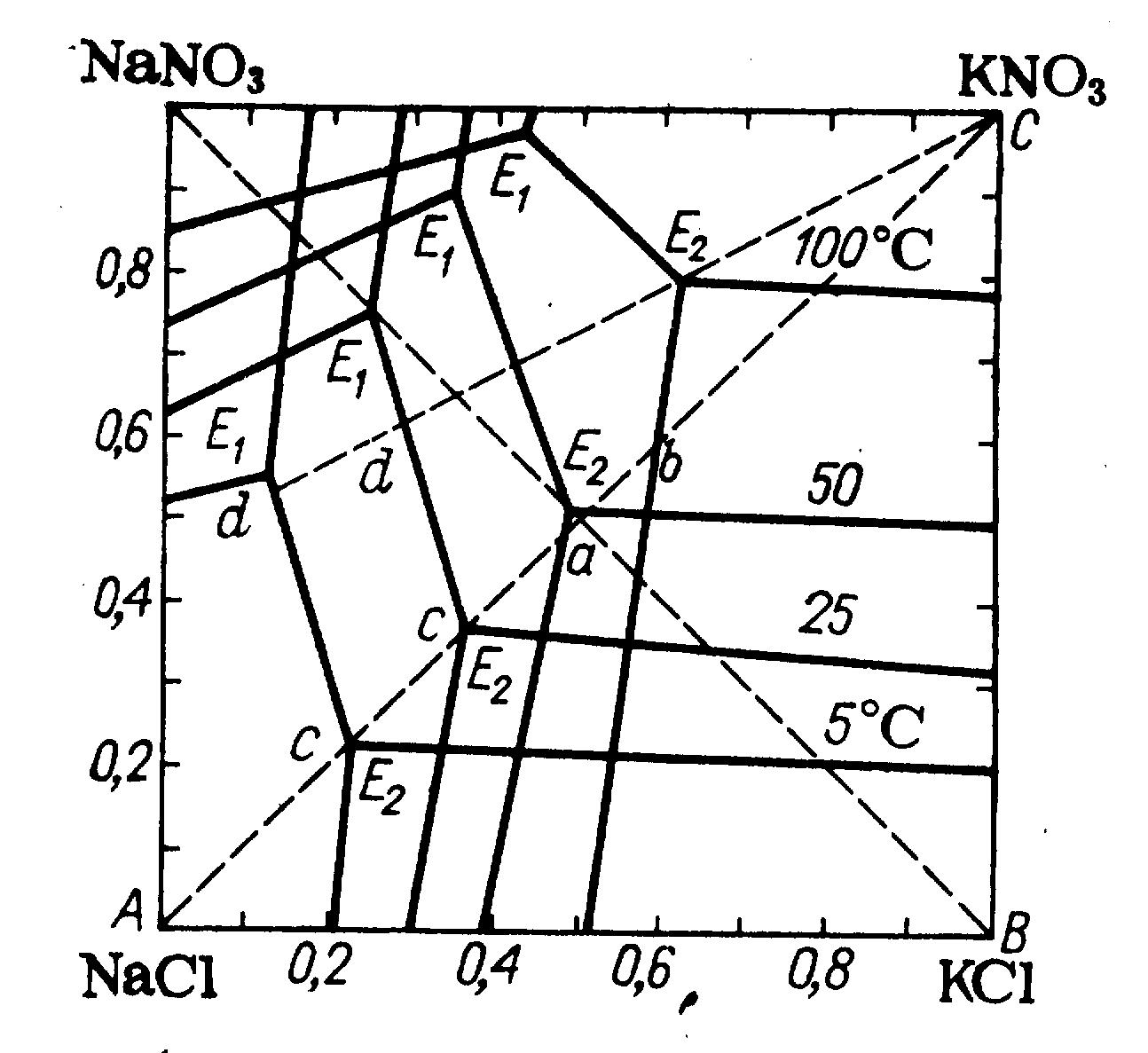
Рисунок 4.9 - Изотермы растворимости в водной системе KCl + NaNО3 = NаСl + КNО3 при температурах 5, 25, 50 и 100 оС
Как видно, при температурах 5-25 °С растворимость солей калия значительно меньше, чем солей натрия (поле кристаллизации нитрата калия занимает большую часть площади квадрата), при температуре 100°С, наоборот, резко увеличивается поле кристаллизации хлорида натрия. Если приготовить раствор эквимолекулярной смеси хлорида калия и нитрата натрия при температуре 100 °С, то фигуративная точка а солевой массы такого раствора, лежащая на пересечении диагоналей квадрата, окажется в поле кристаллизации хлорида натрия. При выпаривании из этого раствора воды при температуре 100 °С, когда будет достигнуто насыщение, начнется кристаллизация хлорида натрия, и состав солевой массы раствора будет изменяться по линии ab.
В точке b раствор станет насыщенным также и хлоридом калия. Если выделившиеся к этому моменту кристаллы хлорида натрия отделить и затем охладить раствор, например до температуры 5 °С то точка b окажется в поле кристаллизации нитрата калия - эта соль и будет выделяться в осадок при охлаждении, причем состав раствора будет изменяться по линии bc.
Так как расстояние между точками а и b невелико, то при выпаривании воды из раствора, содержащего эквимолекулярные количества нитрата натрия и хлорида калия, в осадок выделяется лишь небольшое количество хлорида натрия, и раствор вскоре становится насыщенным также и хлоридом натрия. Это уменьшает и выход кристаллического нитрата калия при охлаждении раствора. Чтобы увеличить количество отделяемого хлорида натрия и повысить выход нитрата калия, как видно из диаграммы, следует вводить в исходный раствор избыток нитрата натрия. Наибольший выход получается, если к концу выделения хлорида натрия раствор насыщен тремя солями — NаСl, КСl и КNО3, т. е. солевая масса его изображается точкой Е2. Тогда после отделения выделившегося хлорида натрия кристаллизация нитрата калия при охлаждении раствора идет по наиболее длинному пути Е2d, что обеспечивает наибольший выход продукта.
Наиболее рациональным и экономичным является осуществление обменного разложения нитрата натрия и хлорида калия в циклическом процессе, когда кристаллизация хлорида натрия идет во время выпаривания из системы воды при постоянном давлении и переменной температуре. Описание и расчет такого оптимального цикла могут быть произведены с помощью комбинации изотермического и изобарического сечений диаграммы. На рисунке 4.10 представлен пример оптимального цикла для случая, когда кристаллизация нитрата калия завершается при температуре 50°С.
Точка а на изотермическом сечении характеризует состав маточного раствора после кристаллизации нитрата калия на отрезке bа в процессе охлаждения. Вначале кристаллизации солевому составу раствора соответствует точка b. Перед кристаллизацией к нему добавляют такое количество воды, чтобы он насытился хлоридом натрия лишь при заданной температуре конца кристаллизации (температура 50 °С). Раствор b получается в результате выпаривания воды и кристаллизации хлорида натрия из кипящего раствора с. Точка с принадлежит к изобарическому сечению диаграммы и лежит на луче выпаривания Всb. Исходный раствор для выпаривания с получается при смешении маточного раствора а с эквимолекулярной смесью хлорида калия и нитрата натрия.
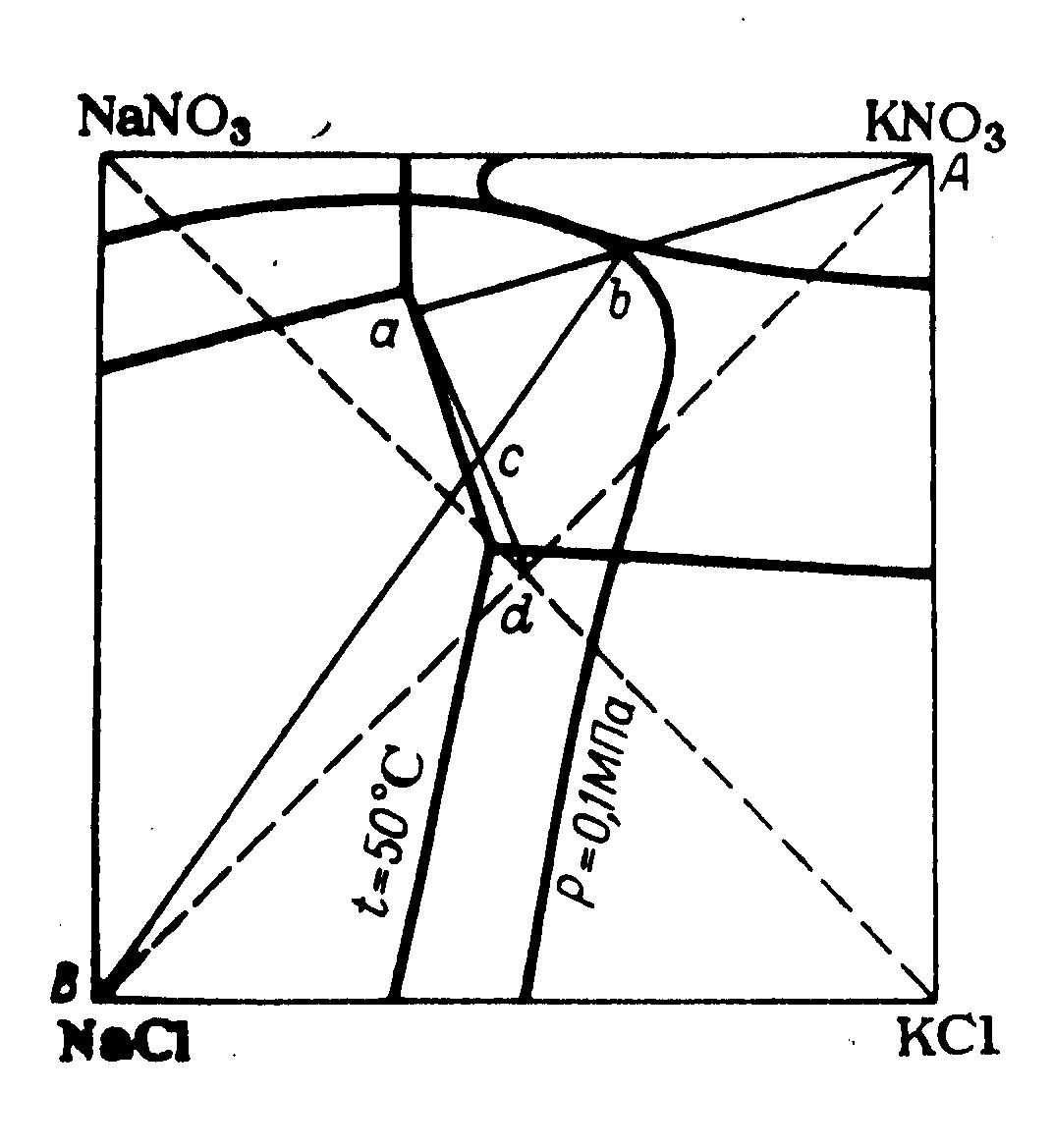
Рисунок 4.10 – Оптимальный цикл конверсии KCl + NaNО3 = NаСl + КNО3 в диаграмме с изотермическим (температура 50°С) и изобарическим (давление 0,1 МПа) сечениями
Таким образом, цикл осуществляется по треугольнику сbа. Чем выше солевой коэффициент цикла (т. е. отношение массы полученного нитрата калия к массе выпаренной воды), тем меньше расход энергии на выпаривание. Чем выше конечная температура кристаллизации нитрата калия, тем меньше затраты на охлаждение раствора. Наиболее экономичными являются циклы с температурными интервалами от точки кипения до конечной температуры кристаллизации, находящейся в пределах температур 50-25 °С. При этом для луча упаривания Вb оптимальные соотношения К+:NO3- находятся в пределах 0,69-0,96; они обеспечивают сравнительно высокие солевые коэффициенты и небольшие объемы циркулирующих растворов.
4.4.2 Технологическая схема производства нитрата калия
В технике нашли применение только конверсионные способы.
Процесс получения калиевой селитры конверсионным способом (рисунок 4.11) состоит из двух основных стадий:
1) обменное разложение нитрата натрия и хлорида калия;
2) очистка первичной («сырой») калиевой селитры от хлорида натрия и механических примесей.
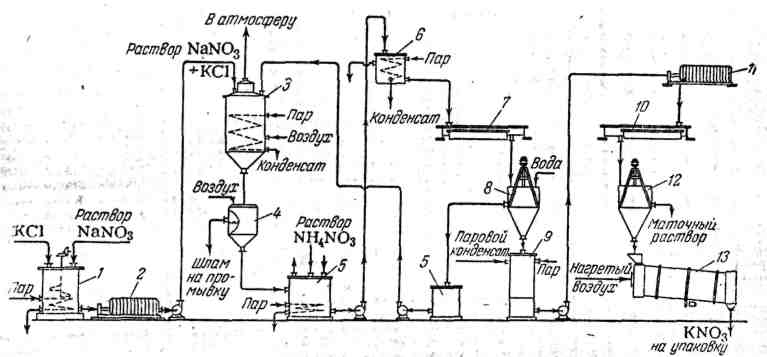
Рисунок 4.11 – Схема производства калиевой селитры конверсионным методом
Эти две основные стадии включают следующие операции (см. рисунок 4.11):
- растворение хлорида калия в предварительно упаренных растворах нитрата натрия (если в качестве сырья применяется твердый нитрат натрия, то его растворяют до получения раствора заданной концентрации, при этом отпадает процесс упаривания растворов) – проводится в смесителе (мешалка-растворитель) для приготовления раствора исходных солей 1;
- фильтрация смеси растворов хлорида калия и нитрата натрия от нерастворимых примесей (иногда вместо фильтрации ограничиваются отстаиванием смеси) - проводится в фильтр-прессе 2;
- обменное разложение солей - проводится в реакторе 3;
- отделение выпавшего в осадок шлама (хлорид натрия) от раствора нитрата калия - проводится в друк-фильтре или нутч-фильтре 4;
- промывка шлама хлорида натрия и его растворение (полученный раствор хлорида натрия используют в цехах пароснабжения для катионитной очистки воды и других целей) - проводится в сборнике растворов и промывных вод 5 с протеканием реакций разложения примесей:
Na2CO3 + 2NH4 NO3 = (NH4)2CO3 + 2NaNO3
NaNO2 + NH4 NO3 = NH4NO2 + NaNO3
(NH4)2CO3 → 2NH3 + CO2 + H2O
NH4NO2 → N2 + 2H2O
При этом газообразные продукты разложения примесей вместе с водяным паром, образующимся при проведении процесса конверсии, отводятся в атмосферу;
- кристаллизация нитрата калия из растворов и отделение кристаллов (получение «сырой» соли) – проводится в системе аппаратов «напорный бак первичных растворов нитрата калия 6 – кристаллизатор первичной кристаллизации 7 - центрифуга 8»;
- промывка кристаллов первичной кристаллизации – проводится в центрифуге 8;
- растворение («распарка») кристаллов и отфильтровывание растворов от нерастворимых примесей – проводится в системе аппаратов «растворитель кристаллов «распарник» 9 – фильтр-пресс 4»;
- вторичная кристаллизация нитрата калия из растворов – проводится в кристаллизаторе вторичной кристаллизации 10;
- отделение калиевой селитры от маточного раствора и промывка кристаллов от остатка хлоридов – проводится в центрифуге 12;
- сушка (проводится в сушильном барабане 13) и упаковка готового продукта.
Конверсионный способ производства калиевой селитры имеет крупные недостатки - в качестве сырья применяется дорогостоящий нитрат натрия, для получения которого расходуется дефицитная сода; технологический процесс и аппаратура громоздки и трудоемки, сравнительно велик расход пара.
