
- •6.070800 «Экология и охрана окружающей среды»
- •Введение
- •1 Производство синтетического аммиака
- •1.1 Методы производства азота и водорода
- •1.2 Промышленный катализ
- •1.3 Очистка природных газов от соединений серы
- •1.4 Конверсия метана
- •1.5 Конверсия оксида углерода (II)
- •1.6 Технологическая схема производства конвертированного газа
- •1.7 Очистка конвертированного газа от диоксида углерода
- •1.8 Тонкая очистка конвертированного газа от кислородсодержащих соединений
- •1.9 Технологическая схема очистки конвертированного газа от кислородсодержащих соединений
- •1.10 Синтез аммиака из смеси азота и водорода
- •1.11 Синтез метанола из оксида углерода и водорода
- •2 Производство неорганических кислот
- •2.1 Производство азотной кислоты
- •2.2 Производство серной кислоты
- •3 Производство кальцинированной соды
- •3.1 Принципиальная схема производства соды аммиачным
- •3.2 Аммонизация очищенного рассола
- •3.3 Карбонизация аммонизированного рассола
- •3.4 Кальцинация гидрокарбоната натрия
- •3.5 Регенерация аммиака в производстве кальцинированной соды
- •4 Производство минеральных удобрений
- •4.1 Производство карбамида
- •4.2 Производство нитрата аммония
- •4.3 Производство сульфата аммония
- •4.4 Производство нитрата калия
- •4.5 Производство суперфосфата
- •Рекомендованная литература
3.4 Кальцинация гидрокарбоната натрия
3.4.1 Физико-химические основы процесса
Осажденный в процессе карбонизации гидрокарбонат натрия отделяется от маточной (фильтровой) жидкости на обычных барабанных вакуум-фильтрах и при нагревании подвергается разложению, или кальцинации.
Отфильтрованный и промытый гидрокарбонат натрия содержит следующие вещества (в % масс.):
- собственно гидрокарбонат натрия – 76-80;
- карбонаты (в пересчете на карбонат натрия) - 2-6;
- общий аммиак - 0,6-0,8;
- общий хлорид-ион (в пересчете на хлорид натрия) - 0,2-0,4;
- вода – 14-18.
Опыт работы показывает, что аммиак нельзя отмыть при промывке осадка, его не удается полностью удалить даже при нагревании до 100 °С. С помощью данных химического анализа установлено, что аммиак в техническом гидрокарбонате натрия находится в виде карбамата натрия. Выделение его в твердую фазу происходит на протяжении всего процесса кристаллизации в карбонизационной колонне, т. е. карбамат натрия соосаждается вместе с гидрокарбонатом натрия. Его кристаллы включаются в кристаллическую решетку гидрокарбоната натрия, что и объясняет трудность удаления аммиака путем промывки.
Карбонат натрия Nа2СO3 может образоваться при гидролизе гидрокарбоната натрия и декарбонизации растворенного гидрокарбоната натрия на фильтрах. Объяснить присутствие карбоната натрия в техническом гидрокарбонате его кристаллизацией в процессе карбонизации нельзя ввиду малой концентрации карбонат-иона в карбонизуемом растворе.
При снижении давления диоксида углерода над суспензией при выходе ее из карбонизационной колонны и на вакуум-фильтре протекает процесс ретроградации, т. е. переход осажденного гидрокарбоната натрия в раствор и его взаимодействие с хлоридом аммония. В результате этого, а также вследствие растворения гидрокарбоната натрия в промывной воде, наблюдается повышение прямого титра жидкости после фильтров на 0,5—1,5 н.д., несмотря на разбавление ее промывной водой и выдувание на фильтре некоторого количества аммиака. Степень использования UNа после фильтров уменьшается примерно на 2,5 % по сравнению с этим показателем для суспензии, выходящей из колонны, где U Nа в среднем составляет 73 %. Следовательно, потери гидрокарбоната натрия на фильтрах достигают примерно 3,5 %.
Отфильтрованный и промытый осадок гидрокарбоната натрия подвергается термическому разложению — кальцинации. Сухой гидрокарбонат натрия разлагается по реакции:
2NaНСO3(тв.) → Nа2СO3 (тв.) + СO2 (г) + Н2O (п) - 125,6 кДж. (3.7)
С повышением температуры равновесие реакции сдвигается вправо. С точки зрения правила фаз эта система имеет одну степень свободы. Следовательно, равновесное давление газовой фазы будет зависеть только от температуры. При разложении влажного гидрокарбоната натрия количество компонентов и фаз увеличивается на единицу, а, следовательно, система остается моновариантной, т. е. и для влажной соли каждой температуре будет соответствовать определенное равновесное давление газовой фазы.
Влага в гидрокарбонате натрия по существу является его насыщенным раствором, поэтому равновесное давление газовой фазы над влажной солью определяется равновесным давлением над насыщенным раствором этой соли. При данной температуре это давление выше, чем над сухим гидрокарбонатом натрия. Поэтому при нагревании влажной соли вначале разлагается растворенный гидрокарбонат натрия с выделением в газовую фазу не только влаги, но и диоксида углерода. После удаления влаги равновесное давление над оставшимся сухим гидрокарбонатом натрия снижается, в связи с чем его разложение становится затруднительным. С помощью термограмм было установлено, что разложение сухого гидрокарбоната при суммарном давлении образующихся диоксида углерода и водяных паров, равном 98 кПа (1 кгс/см2), протекает при температуре 120 °С по реакции (3.7).
Влажный гидрокарбонат натрия может разлагаться и при температуре 110 °С. При доступе в зону разложения воздуха или другого газа, снижающего суммарное давление Pсо2 +Рн2о над осадком, разложение может протекать и при более низких температурах.
В практических условиях процесс кальцинации сырого технического гидрокарбоната натрия осложняется присутствием примесей и большого количества влаги, что вызывает комкование соли, ухудшает его перемешивание и процесс теплопередачи. Кроме того, при испарении влаги, представляющей собой насыщенный раствор солей, выделяется твердая фаза, которая, кристаллизуясь на стенках печи, образует плотно пристающую к поверхности стенки корку. Твердый слой соли, обладающий плохой теплопроводностью, ухудшает теплопередачу и может служить причиной прогорания стальной, обогреваемой снаружи, стенки печи. Чтобы исключить эти недостатки, сырой технический гидрокарбонат перед кальцинацией смешивают с готовой горячей содой (ретурная сода). При этом образуется, как показали микроскопические и рентгенографические исследования, новая твердая фаза - трона Nа2СО3 ×NаНСО3×2Н2O:
NaНСO3(тв.) + Nа2СO3 (тв.) + 2Н2O (ж) → Nа2СO3 ×NaНСO3 ×.2Н2O (тв.)
+ 21,9 кДж. (3.8)
Таким образом, гигроскопическая влага гидрокарбоната натрия переходит при образовании троны в кристаллизационную воду. Смесь становится сухой, рассыпчатой, и кальцинация такой смеси проходит без осложнений. Разложение троны протекает по реакции:
3(Na2СO3 ×NаНСO3×2Н2O) (тв.) → Nа2СO3 ×3NaНСO3 (тв.) + 2Na2СO3 (тв.) + 6Н2O (г) - 320,3 кДж. (3.9)
с последующим разложением двойной соли до карбоната натрия Nа2СО3.
Таким образом, на практике процесс кальцинации должен осуществляться при температуре не ниже 126 °С. Однако для ускорения процесса температуру повышают до 140 °С и более.
Кроме влаги, технический гидрокарбонат натрия содержит также карбамат натрия, кристаллы которого включены в его кристаллическую решетку. При образовании троны происходит разрушение кристаллической решетки гидрокарбоната и карбамат легко разлагается в присутствии водяного пара с образованием карбоната натрия Nа2СО3.
С фильтровой жидкостью в технический гидрокарбонат натрия попадают примеси карбоната и хлорида аммония. Карбонат аммония легко разлагается, а хлорид аммония реагирует с гидрокарбонатом натрия, загрязняя при этом соду образующимся хлоридом натрия. Таким образом, в процессе кальцинации технического гидрокарбоната натрия помимо вышеуказанных реакций протекают также следующие основные реакции:
2NаНСO3 = Na2СO3 + СO2 + Н2 O,
NH4С1 + NaНСO3 = NaС1 + NH3 + Н2O + СO2.
Наиболее легко протекают реакции (3.9) и последняя, несколько труднее - другие реакции и, наконец, наиболее медленно, лимитирующая скорость всего процесса - реакция разложения двойной соли.
Исследования кинетики процесса кальцинации показывают, что разложение гидрокарбоната натрия протекает, главным образом, в тепловой области, т. е. скорость разложения зависит от скорости подвода тепла к зоне разложения, т. е. от удельной поверхности теплообмена, ее температуры и гидродинамических условий. В практических условиях в присутствии ретурной соды для полного разложения гидрокарбоната натрия требуется, однако, значительно более продолжительное время.
3.4.2 Технологическая схема отделения карбонизации
На рисунке 3.4 показана технологическая схема процесса кальцинации с использованием огневых с наружным факельным обогревом печей, работающих с применением ретурной соды.
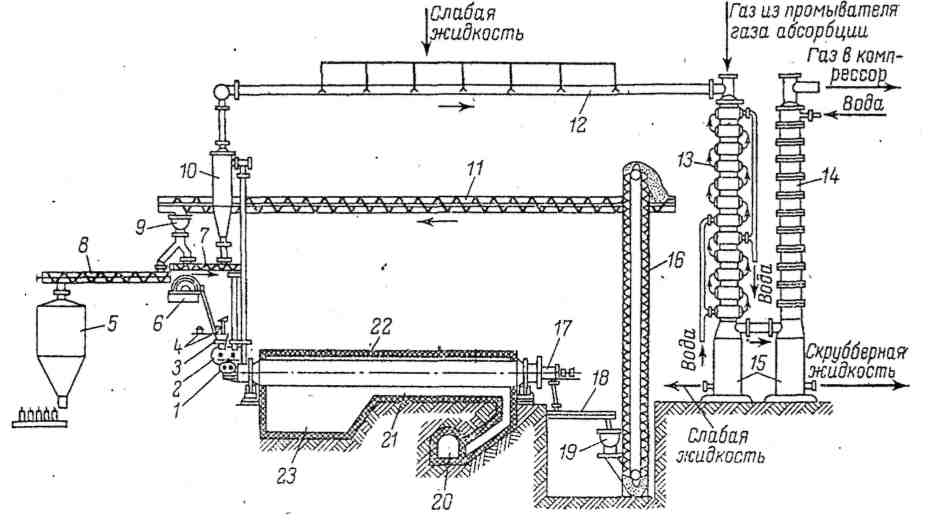
Рисунок 3.4 – Технологическая схема отделения кальцинации
Суспензия, получаемая в колоннах и содержащая 26 % масс. осажденного гидрокарбоната натрия, поступает на вакуум-фильтры 6, где осадок отделяется от маточной жидкости. Вместе с промывной водой маточник направляется в отделение дистилляции для регенерации аммиака. Воздух, прошедший через слой осадка и фильтрующую ткань, отсасывается из сепаратора фильтра вакуум-насосом через промыватель воздуха фильтров ПВФЛ, находящийся в отделении аммонизации-абсорбции.
Промытый сырой гидрокарбонат натрия с вакуум-фильтра подается скребковым или ленточным транспортером 4 в приемник 3 с вертикальной мешалкой, которая разрыхляет и проталкивает сырую соль в питатель 2 и далее в смеситель 1. Сюда же шнековым транспортером 7 подается горячая ретурная сода в заданном соотношении. Полученная смесь поступает далее во вращающуюся барабанную содовую печь 22, где и протекает процесс кальцинации.
Готовая кальцинированная сода из содовой печи с помощью выгружного шнека 17 и передаточного шнека 18 передается в общий сборный шнековый транспортер 19, а затем к элеватору 16. Элеватор разгружает соду на транспортер 11, из которого с помощью распределительного шнека 9 часть соды (ретурная сода) распределяется по содовым печам, а часть - готовая продукция - передается на склад в бункеры 5 транспортером 8.
Газ, выходящий из содовых печей при температуре 150 °С, содержит диоксид углерода, аммиак, водяной пар и содовую пыль. Этот газ направляется в циклон 10, где большая часть содовой пыли улавливается и передается обратно в содовую печь шнековым транспортером 7. Из циклона газ поступает в общий для всех печей газоход 12 - коллектор газа содовых печей, орошаемый внутри слабой жидкостью, которую получают при охлаждении газа в том же коллекторе до температуры 80 °С, а далее в холодильнике газа содовых печей ХГСП 13 до температуры 38 °С.
Образующийся конденсат извлекает из газа оставшуюся после циклона содовую пыль, аммиак и диоксид углерода. Этот раствор, содержащий гидрокарбонат и карбонат натрия, углеаммонийные соли, называют слабой жидкостью. Часть этой жидкости возвращается обратно на орошение коллектора газа содовых печей, а часть направляется в отделение дистилляции для отгонки аммиака и диоксида углерода, после чего направляется на вакуум-фильтры для промывки гидрокарбоната натрия.
Коллектор газа содовых печей имеет уклон в сторону холодильника газа содовых печей ХГСП, поэтому слабая жидкость из коллектора стекает в холодильник, орошая охлаждающие трубки, и вместе с дополнительно образующимся в холодильнике 13 конденсатом стекает в сборник слабой жидкости 15. В холодильнике 13 газ идет сверху вниз в межтрубном пространстве, а в трубках противотоком проходит охлаждающая вода.
В холодильник газа содовый печей ХГСП поступает также газ из промывателя газа абсорбции ПГАБ с целью повышения степени использования диоксида углерода, оставшегося в газе после аммонизации рассола. Из холодильника газа содовых печей ХГСП газ идет для окончательной очистки и охлаждения в промыватель газа содовых печей ПГСП 14 скрубберного типа, в котором хордовая насадка орошается сверху водой. Скрубберную жидкость после промывателя газа содовых печей ПГСП добавляют к слабой жидкости. Охлажденный и очищенный газ после промывателя газа содовых печей ПГСП смешивают с газом известковых печей и подают компрессором в карбонизационные колонны. На некоторых содовых заводах холодильник и промыватель газа содовых печей объединены в одну колонну.
