
- •6.070800 «Экология и охрана окружающей среды»
- •Введение
- •1 Производство синтетического аммиака
- •1.1 Методы производства азота и водорода
- •1.2 Промышленный катализ
- •1.3 Очистка природных газов от соединений серы
- •1.4 Конверсия метана
- •1.5 Конверсия оксида углерода (II)
- •1.6 Технологическая схема производства конвертированного газа
- •1.7 Очистка конвертированного газа от диоксида углерода
- •1.8 Тонкая очистка конвертированного газа от кислородсодержащих соединений
- •1.9 Технологическая схема очистки конвертированного газа от кислородсодержащих соединений
- •1.10 Синтез аммиака из смеси азота и водорода
- •1.11 Синтез метанола из оксида углерода и водорода
- •2 Производство неорганических кислот
- •2.1 Производство азотной кислоты
- •2.2 Производство серной кислоты
- •3 Производство кальцинированной соды
- •3.1 Принципиальная схема производства соды аммиачным
- •3.2 Аммонизация очищенного рассола
- •3.3 Карбонизация аммонизированного рассола
- •3.4 Кальцинация гидрокарбоната натрия
- •3.5 Регенерация аммиака в производстве кальцинированной соды
- •4 Производство минеральных удобрений
- •4.1 Производство карбамида
- •4.2 Производство нитрата аммония
- •4.3 Производство сульфата аммония
- •4.4 Производство нитрата калия
- •4.5 Производство суперфосфата
- •Рекомендованная литература
2.2 Производство серной кислоты
Среди минеральных кислот серная кислота по объему производства и потребления занимает первое место. Мировое производство ее за последние 25 лет выросло более чем в три раза, составляя в настоящее время более 160 млн. т в год.
Области применения серной кислоты и олеума весьма разнообразны. Значительная часть ее используется в производстве минеральных удобрений (от 30 до 60 %), а также в производстве красителей (от 2 до 16 %), химических волокон (от 5 до 15 %) и металлургии (от 2 до 3 %). Она применяется для различных технологических целей в текстильной, пищевой и других отраслях промышленности.
2.2.1 Краткий исторический очерк производства
В технике под серной кислотой подразумевают любые смеси триоксида серы с водой. Если на 1 моль SO3 приходится более 1 моль Н2О, смеси являются водными растворами серной кислоты, если менее 1 моль воды, то это растворы серного ангидрида в серной кислоте, которые называют олеумом, или дымящей серной кислотой.
Первое упоминание о серной кислоте относится к 940 году нашей эры (алхимик Абу Бекр Альрарес). До середины XVIII века ее получали сухой перегонкой сульфата железа - купороса (отсюда термин «купоросное масло») или нагреванием смеси серы и нитрата калия с последующим поглощением оксида серы (VI) водой.
В 1746 году был разработан камерный метод производства, в котором сера в смеси с нитратом калия сжигалась в свинцовых камерах, причем оксид серы (VI) и оксиды азота растворялись в воде на дне камеры. В последующем в камеры стали вводить пар, и процесс производства превратился в непрерывный процесс. Вначале XIX века серу сжигали в печах, а оксиды азота получали отдельно разложением нитрата калия серной кислотой. Вначале XX века в установку была включена специальная башня для улавливания оксидов азота, что повысило интенсивность камерного процесса. В последующем свинцовые камеры были заменены башнями с кислотоупорной насадкой. Тем самым камерный метод производства серной кислоты, сохранив принцип окисления оксида серы (IV) в оксид серы (VІ), трансформировался в башенный метод, существующий в настоящее время. С 1837 г. в качестве сырья вместо серы стал использоваться железный колчедан.
В 1831 году английский ученый П. Филипс разработал контактный способ производства серной кислоты на платиновом катализаторе. Позже платина была заменена контактной массой на основе оксида ванадия (V), что позволило снизить температуру зажигания. Вначале XX века Р. Книтч установил причины отравления катализатора при использовании в качестве сырья железного колчедана и разработал методы очистки оксида серы (IV) от каталитических ядов.
В 1930 году в практику сернокислотного производства были введены печи «кипящего слоя» (КС) на стадии обжига колчедана, существенно повысившие производительность и снизившие потери серы.
В 1931 году И.А. Ададуровым и др. был разработан метод окисления оксида серы (IV) на твердом катализаторе при высоком содержании паров воды в газе, получивший впоследствии название метода «мокрого катализа» производства серной кислоты из сероводорода.
В настоящее время практически вся серная кислота производится контактным методом при возрастающей мощности сернокислотных установок.
2.2.2 Сырье для производства серной кислоты
Сырьем в производстве серной кислоты могут быть элементарная сера и различные серосодержащие соединения, из которых могут быть получена сера или непосредственно оксид серы (IV).
Природные залежи самородной серы невелики, хотя ее кларк в земной коре равен 0,1 %. Чаще всего сера находится в природе в форме сульфидов и сульфатов металлов, а также входит в состав нефти, каменного угля, природного и попутного газов. Значительные количества серы содержатся в виде оксида серы (IV) в топочных газах и газах цветной металлургии, а также в виде сероводорода, выделяющегося при очистке горючих газов.
Таким образом, сырьевые источники для производсгва серной кислоты достаточно многообразны, хотя до сих пор в качестве сырья используют преимущественно элементарную серу и железный колчедан. Ограниченное использование таких видов сырья, как топочные газы тепловых электростанций и газы медеплавильного производства, объясняется низкой концентрацией в них оксида серы (IV).
При этом доля колчедана в балансе сырья уменьшается, а доля серы возрастает. В 1988 году она уже превышала 60 % от общего количества серосодержащего сырья.
Доля сырья в себестоимости продукции сернокислотного производства достаточно велика. Поэтому технико-экономические показатели этого производства существенно зависят от вида используемого сырья. В таблице 2.2 приведены основные технико-экономические показатели производства серной кислоты из различного сырья (за 100 % взяты показатели производства на основе железного колчедана).
Таблица 2.2 - Технико-экономические показатели сернокислотного производства (%)
Показатель
|
Сырье |
|||
Железный колчедан |
Самородная сера |
Газовая сера |
Сероводород |
|
Удельные капиталовложения в производство |
100 |
57 |
57 |
63 |
Себестоимость кислоты |
100 |
125 |
67 |
80 |
Приведенные затраты |
100 |
118 |
75 |
72 |
Замена колчедана серой приводит к снижению капитальных затрат на строительство и улучшению экологической обстановки в результате ликвидации отвалов огарка и уменьшения выбросов токсичных веществ в атмосферу.
2.2.3 Принципиальные технологические схемы производства
Производство серной кислоты из флотационного колчедана
Химическая схема получения серной кислоты из колчедана включает три последовательные стадии:
- окисление дисульфида железа пиритного концентрата кислородом воздуха:
4FeS2 +11O2 = 2Fe2O3 + 8SO2 ,
- каталитическое окисление оксида серы (IV) избытком кислорода печного газа:
2SO2 + O2 = 2SO3,
- абсорбция оксида серы (VI) с образованием серной кислоты:
SO3 + Н2О = Н2SО4 .
По технологическому оформлению производство серной кислоты из железного колчедана является наиболее сложным и состоит из нескольких последовательно проводимых стадий.
Принципиальная (структурная) схема этого производства представлена на рисунке 2.8.
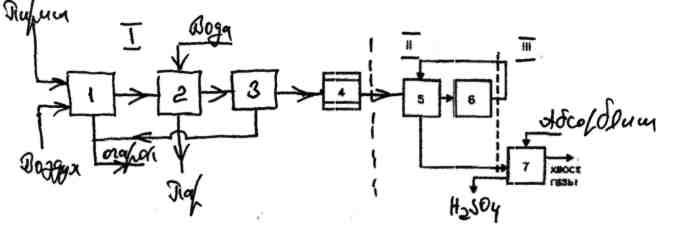
I - получение обжигового газа: 1 - обжиг колчедана, 2 - охлаждение газа в котле-утилизаторе, 3 - общая очистка газа, 4 - специальная очистка газа;
II - контактирование: 5 - подогрев газа в теплообменнике, 6 – процесс контактирования;
III - абсорбция: 7 - абсорбция оксида серы (VI) и образование серной кислоты.
Рисунок 2.8 - Структурная схема производства серной кислоты из флотационного колчедана
Производство серной кислоты из серы
Технологический процесс производства серной кислоты из элементарней серы контактным способом отличается от описанного выше процесса производства ив колчедана радом особенностей. К ним относятся:
- особая конструкция печей для получения печного газа;
- повышенное содержание оксида серы (IV) в печном газе;
- отсутствие стадии предварительной очистки печного газа.
Последующие операции контактирования оксида серы (IV) и абсорбции оксида серы (VI) по физико-химическим основам и аппаратурному оформлению не отличаются от таковых для процесса на основе колчедана и оформляются обычно по схеме двойного контактирования-двойной абсорбции (ДК-ДА), о которой речь будет идти ниже. Термостатирование газа в контактном аппарате в этом методе осуществляется обычно путем ввода холодного воздуха между слоями катализатора.
Принципиальная схема производства серной кислоты из серы представлена на рисунке 2.9.
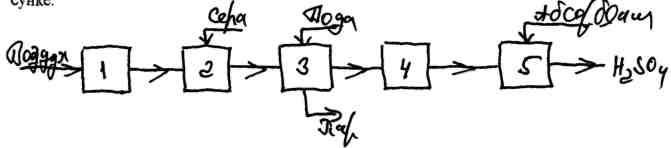
1 - осушка воздуха, 2 - сжигание серы, 3 - охлаждение газа, 4 - контактирование, 5 - абсорбция оксида серы (VI)
Рисунок 2.9 - Принципиальная схема производства серной кислоты из серы
Производство серной кислоты из сероводорода
Способ производства серной кислоты из сероводородсодержащего газа, получивший название «мокрого» катализа (И.А. Ададуров, Д, Гернет, 1931 г.), состоит в тем, что смесь оксида серы (IV) и паров воды, полученная сжиганием сероводорода в токе воздуха, подается без разделения на контактирование, где оксид серы (IV) окисляется на твердом ванадиевом катализаторе до оксида серы (VI). Затем газовая смесь охлаждается в конденсаторе, где пары образующейся серной кислоты превращаются в жидкий продукт.
Таким образом, в отличие от методов производства серной кислоты из колчедана и серы, в процессе мокрого катализа отсутствует специальная стадия абсорбции оксида серы (VI) и весь процесс состоит из трех последовательных стадий:
- cжигание сероводорода:
Н2S + 1,5О2 = SO2 + Н2O + 519 кДж
с образованием смеси оксида серы (IV) и паров воды эквимолекулярного состава;
- окисление оксида серы (IV) до оксида серы (VI):
SО2 + 0,5О2 = SO3 + 96 кДж
c сохранением эквимолекулярного состава смеси оксида серы (VI) и паров воды;
- конденсация паров и образование серной кислоты:
SO3 + Н2О = H2SO4 + 92 кДж.
Таким образом, процесс «мокрого катализа» описывается суммарным уравнением:
H2S + 2O2 = Н2SO4 + 707 кДж.
Технологическая схема производства серной кислоты из сероводородсодержащего газа приведена на рисунке 2.10.
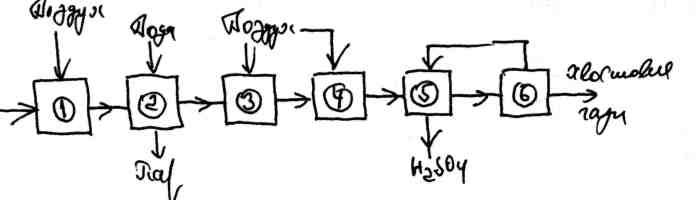
1 - сжигание сероводородного газа при большом избытке воздуха; 2 - охлаждение газопаровой смеси от 1000 до 400 °С; 3 - разбавление газопаровой смеси; 4 - контактирование в контактных аппаратах; 5,6 - охлаждение конвертированного газа в башнях, орошаемых серной кислотой, с образованием продукционной серной кислоты и сернокислотного тумана, улавливаемого в электрофильтрах
Рисунок 2.10 - Принципиальная схема производства серной кислоты из сероводородного газа
2.2.4 Производство серной кислоты из колчедана
Главной составной частью серного колчедана является сульфид железа FeS2 (53,44 % S и 46,56 % Fe), который встречается в виде минерала пирита и реже марказита (минералы имеют одинаковый состав, но отличаются формой кристаллов).
2.2.4.1 Обжиг колчедана
В технике сернистым газом называют газовую смесь, содержащую диоксид серы; концентрация компонентов сернистого газа (SO2, O2, N2 и др.) различна в зависимости от состава исходного сырья и методов его обжига.
При обжиге колчедана протекает несколько реакций. Вначале происходит термическое разложение дисульфида железа FeS2 с образованием сульфида железа FeS и выделением паров серы:
2FeS2 → 2FeS + S2 – 103,9 кДж (2.1)
Выделение серы начинается при температуре около 500 °С и ускоряется при дальнейшем ее повышении. Затем пары серы сгорают с образованием диоксида серы:
S(газ) + O2(газ) = SO2(газ) + 362,4 кДж (2.2)
Такая реакция протекает и при сжигании элементной серы. Сульфид железа FeS также сгорает, однако точный механизм этого процесса не установлен; предложено лишь несколько примерных схем. По одной из них первой стадией окисления этого сульфида является образование сульфатов железа, далее разлагающихся до оксидов железа. По другим схемам данный сульфид непосредственно окисляется до оксидов железа.
Суммарный процесс горения колчедана протекает с образованием либо оксида железа Fe2O3:
4FeS2 + 11O2 = 2 Fe2O3 + 8SO2 + 3415,7 кДж (2.3)
либо смешанного оксида железа Fe3O4:
3FeS2 + 8O2 = Fe3O4 + 6SO2 + 2438,2 кДж (2.4).
Благоприятными условиями для образования смешанного оксида железа Fe3O4 являются высокая температура, повышенное содержание диоксида серы в газе и относительно большое количество несгоревшего колчедана.
Медленное окисление пирита с выделением диоксида серы начинается уже при температуре 170 – 260 °С, температура же воспламенения колчедана различных сортов колеблется от 290 до 420 °С. При этом, чем тоньше измельчен колчедан, тем ниже температура его воспламенения. Например, при размере зерен 0,00 - 0,05, 0,08 - 0,1 и 1 - 2 мм температура воспламенения колчедана, соответственно, равна 290, 405 и 428 °С. В практических условиях возможности повышения температуры в печи и получения газа с высокой концентрацией диоксида серы ограничены тем, что при температуре выше 1300 °С быстро разрушается футеровка печи и газоходов.
Следует отметить, что с увеличением содержания кислорода в газовой смеси температура воспламенения сырья несколько повышается. По-види-мому, на поверхности частиц колчедана образуется защитная пленка сульфата железа тем более плотная, чем выше содержание кислорода в газе.
При горении колчедана протекают следующие процессы:
1) разложение сульфида железа FeS2 по реакции (2.1);
2) подвод кислорода из газовой фазы к поверхности зерен колчедана;
3) окисление серы по реакции (2.2);
4) окисление сульфида железа FeS с образованием диоксида серы и оксида железа;
5) отвод тепла, выделяющегося при окислении, от зерен колчедана к газовому потоку;
6) отвод диоксида серы из зоны реакции в газовую фазу.
В зависимости от условий обжига (температуры, размера зерен, скорости газового потока и др.) влияние этих процессов на общую скорость процесса различно. В большой степени скорость горения колчедана зависит от его химического и минералогического состава, а также от кристаллического строения. При низкой температуре скорость химических реакций (процессы 1),3),4)) ниже скорости диффузионных процессов (2),5) и 6)), поэтому общая скорость процесса определяется протеканием реакций 1),3) и 4), т. е. процесс проходит в кинетической области.
При обжиге колчедана в неподвижном слое наиболее медленными являются процессы 2), 5) и 6), т. е. процессы массо - и теплоотдачи (процесс протекает в диффузионном режиме).
При обжиге в производственных условиях большие затруднения вызывает спекание (шлакование) горящего материала. С повышением температуры спекание колчедана увеличивается, оно зависит также от состава (сорта) колчедана. Колчедан, содержащий около 35 % серы, спекается уже при 800 °С; большинство колчеданов спекается при 900 °С.
Благодаря интенсивному перемешиванию колчедана с воздухом в печах «кипящего слоя» (КС) обжиг сырья протекает с большой скоростью, поэтому в этих печах получают обжиговый газ с высоким содержанием диоксида серы (до 15 % SO2). Вследствие большой концентрации диоксида серы при низкой концентрации кислорода и высокой температуре обжига степень окисления диоксида серы в триоксид серы в печах КС незначительна; она тем меньше, чем выше концентрация диоксида серы в обжиговом газе.
При обжиге колчедана температура в печах КС во избежание слипания частиц сырья не должна превышать 800 °С.
Содержащиеся в колчедане примеси мышьяка, селена, теллура и рения в процессе обжига окисляются кислородом до оксидов Аs2О3, SeO2, TеО2 и Re2O7, поэтому при сжигании сырья в механических печах и печах пылевидного обжига они в основном переходят в состав обжигового газа.
На рисунке 2.11 изображена схема установки для сжигания пиритного колчедана в кипящем слое.
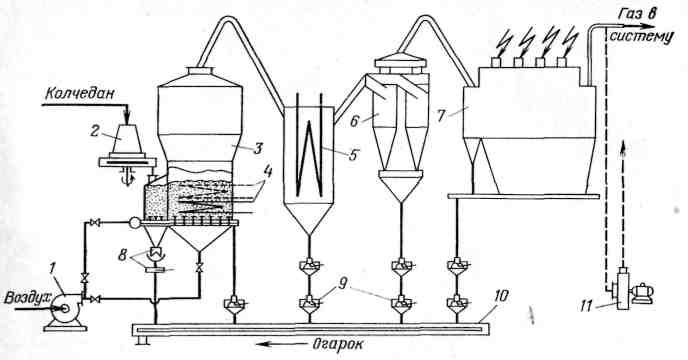
Рисунок 2.11 - Типовая схема печного агрегата
Дробленый (рядовой или флотационный) колчедан с размером частиц 3-5 мм из бункера-питателя 2 равномерно поступает в слой кипящего материала печи, смешивается с ним и сгорает. Воздух, необходимый для горения колчедана, нагнетается в печь вентилятором 1 и приводит в состояние кипения находящуюся там смесь огарка и горящего колчедана. Для поддержания требуемой температуры кипящего слоя около 800 °С в нем располагают охлаждающие элементы 4 (змеевики). Из печи кипящего слоя обжиговый газ поступает в котел-утилизатор 5, где охлаждается до 400 - 450 °С. С газом уносится в виде пыли до 90 % массы образующегося пиритного огарка.
В змеевиках 4 и в змеевиках котла-утилизатора 5 получают до 1,5 т пара на 1 т сжигаемого стандартного колчедана.
По выходе из котла-утилизатора обжиговый газ очищается от крупных частиц пыли в циклонах 6, тщательно обеспыливается в многопольном сухом электрофильтре 7 и далее направляется на переработку в серную кислоту. Огарок из печи кипящего слоя, пыль из бункеров котла-утилизатора, циклонов и электрофильтра поступают на скребковый транспортер 10, затем увлажняются, охлаждаются в холодильном барабане и удаляются из цеха ленточным транспортером.
2.2.4.2 Специальная очистка обжигового газа
Выходящий из печей обжиговый газ содержит частицы пыли, увлекаемые газовым потоком в процессе обжига сырья. Количество пыли в газе зависит от качества сжигаемого сырья, размера его частиц, конструкции печей и др. факторов. Запыленность газа, получаемого при сжигании пиритного колчедана в механических печах, составляет от 1 до 10 г/м3, в печах пылевидного обжига – от 20 до 100 г/м3, в печах «кипящего слоя» КС – до 300 г/м3 (считая на объемы газа, приведенного к нормальным условиям).
На различных стадиях производства серной кислоты образуется туман серной кислоты, вызывающий коррозию аппаратуры, ухудшение качества продукции и др. Наибольшие затруднения вызывает высокодисперсный конденсационный туман, образующийся в первой промывной башне контактного процесса, в сушильной башне, теплообменниках и ангидридных холодильниках, в олеумном и моногидратном абсорберах и др.
В очистном отделении газ подвергается обработке для выделения примесей, присутствие которых недопустимо в газе, поступающем в цех производства контактной серной кислоты (остатки пыли, мышьяк, фтор, пары воды и др.), и для извлечения ценных примесей (селен, теллур и др.).
По нормам технологического режима содержание пыли в газе после очистки не должно превышать 100 мг/м3. Поэтому обжиговый газ, прежде всего, тщательно очищают от пыли.
Основные примеси обжигового газа (оксиды Аs2O3, SеO2 и др.), находящиеся в газо- и парообразном состоянии, выделяются при промывке газа серной кислотой, имеющей более низкую температуру, чем очищенный газ. Эти примеси частично растворяются в серной кислоте, но большая их часть переходит в состав сернокислотного тумана. Кроме диоксида серы, обжиговый газ содержит небольшое количество триоксида серы и паров воды, которые при охлаждении газа взаимодействует с образованием паров серной кислоты. В первой промывной башне газ очень быстро охлаждается, при этом пары серной кислоты конденсируются в объеме в виде тумана — мелких, взвешенных в газе капель.
Суммарная поверхность капель тумана серной кислоты весьма велика, поэтому в них растворяется большое количество оксидов Аs2O3, SеO2 и других примесей, выделяющихся из газа вместе с туманом в промывных башнях и электрофильтрах. Тщательная очистка газа от тумана необходима для выделения не только примесей, отравляющих контактную массу, но и серной кислоты, содержащейся в каплях тумана. При прохождении газа через аппаратуру и трубопроводы этот туман осаждается на стенках, вызывая коррозию. При плохой очистке газа особенно большое количество тумана серной кислоты может выделяться в нагнетателях, так как высокая окружная скорость газа в них благоприятствует выделению мелких капель кислоты. Наиболее разрушительное действие производит туманообразная серная кислота в контактном отделении. Продукты коррозии, образующиеся при взаимодействии серной кислоты с металлом труб контактных аппаратов, подогревателей и теплообменников, увеличивают сопротивление аппаратуры, уменьшают коэффициенты теплопередачи и вызывают отложение твердых корок на первых слоях контактной массы.
В обжиговом газе после промывных башен содержится незначительное количество газообразных мышьяковистого ангидрида Аs2O3 и диоксида селена SеO2. Это объясняется невысоким давлением насыщенных паров этих веществ, которое снижается еще более в присутствии сернокислотного тумана в газе, поскольку оба оксида растворяются в серной кислоте.
Технологическая схема отделения специальной очистки представлена на рисунке 2.12.
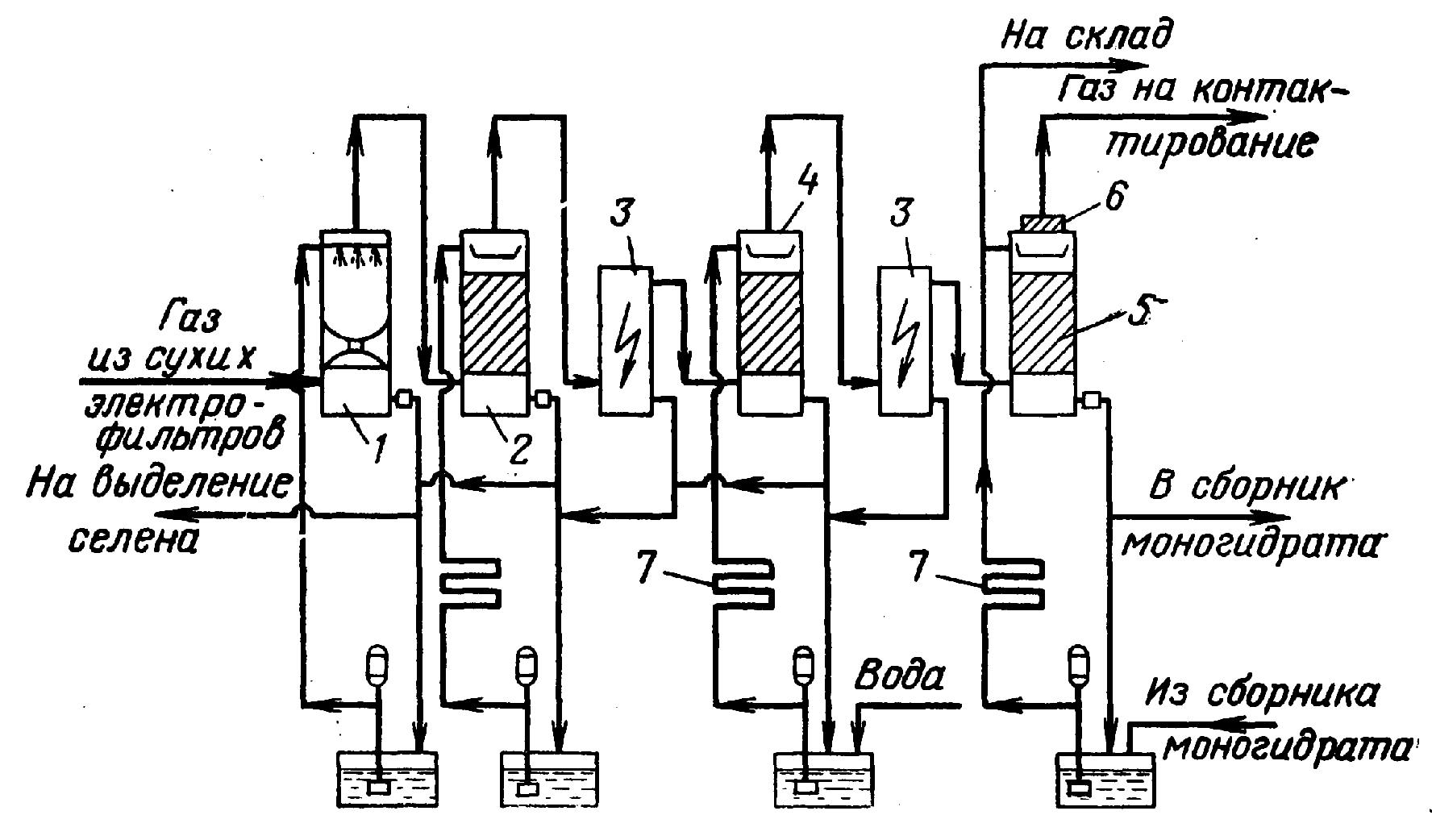
Рисунок 2.12 - Технологическая схема отделения специальной очистки
Очищенный от пыли обжиговый газ поступает в первую промывную башню 1, орошаемую 50-60 %-ной серной кислотой. При этом газ охлаждается, а основные его примеси (оксиды SO3, As2O3, SeO2, ТеO2 и Re2О7) превращаются в туман, небольшая часть которого абсорбируется орошающей кислотой в этой же башне. Далее газ направляется во вторую промывную башню 2, орошаемую 15-25 %-ной серной кислотой. Здесь происходит дальнейшее охлаждение газа и дополнительно выделяется туман. Большая его часть (около 95 % от содержания в газе после второй промывной башни) осаждается в первой ступени электрофильтров 3 и в газе остаются лишь наиболее мелкие капли тумана.
Для улучшения условий осаждения тумана во второй ступени электрофильтров 3 газ подают в увлажнительную башню 4, орошаемую 5 %-ной серной кислотой. При этом в результате поглощения паров воды повышается относительная влажность газа и увеличиваются размеры капель тумана. С увеличением размера капель возрастает их заряд и повышается скорость движения частиц тумана в электрическом поле. При отсутствии увлажнительной башни требуется установка более мощных электрофильтров.
Газ, освобожденный от тумана, но содержащий большое количество паров воды, поступает на осушку в сушильную башню 5, орошаемую 93-95 %–ной серной кислотой. В этой башне серная кислота разбавляется вследствие поглощения водяных паров. Осушенный сернистый газ направляют нагнетателем в последующую аппаратуру.
Брызги серной кислоты, увлекаемые газовым потоком из верхней части башни, отделяются от газа в фильтре 6.
Кислота, орошающая промывные башни, нагревается горячим обжиговым газом. В сушильной башне нагревание кислоты происходит за счет тепла, выделяющегося при абсорбции паров воды серной кислотой. Для охлаждения кислоты, орошающей различные башни, установлены холодильники 7.
В первой промывной башне осаждается также основное количество селена и пыли, остающейся в газе после сухих электрофильтров. Эта пыль переходит в орошающую серную кислоту, загрязняя ее. Часть раствора серной кислоты после первой промывной башни, образующей так называемый «селеновый» шлам, направляют на извлечение селена и пыли.
Концентрация серной кислоты, орошающей промывные башни, повышается за счет поглощения триоксида серы, присутствующего в обжиговом газе. Поэтому для поддержания заданной концентрации серной кислоты в сборник при увлажнительной (или второй промывной) башне непрерывно подается вода. Образующийся при этом избыток кислоты перетекает в сборник кислоты второй промывной башни и концентрация кислоты, орошающей эту башню, понижается до нужного предела. Из цикла второй промывной башни избыток кислоты перетекает в сборник при первой промывной башне; в результате сохраняется требуемая концентрация кислоты, орошающей башню 1. Описанная схема обеспечивает полное связывание серного ангидрида, поступающего с обжиговым газом.
Избыток серной кислоты, накапливающейся в цикле первой промывной башни, передают на склад готовой продукции, где ее «укрепляют», т. е. повышают концентрацию до 75 или 92,5 % добавлением олеума или моногидрата, и отправляют потребителю как кислоту башенную или кислоту контактную техническую.
Конденсат из мокрых электрофильтров присоединяется к кислоте, орошающей башни 2 и 4. Газ, направляемый в первую промывную башню, содержит фтор в виде фторида водорода НF. Последний реагирует с диоксидом кремния футеровки и насадки, образующийся при этом фторид кремния SiF4 растворяется в серной кислоте и выводится из системы вместе с кислотой из первой промывной башни.
2.2.4.3 Контактное окисление диоксида серы
В производстве серной кислоты контактным методом окисление диоксида серы по реакции:
SO2 + 0,5O2 ↔ SO3 + 96,05 кДж
происходит в присутствии катализатора. Для этого сернистый газ приводят в соприкосновение с катализатором, находящимся в стационарном или в псевдоожиженном состоянии.
Промышленный ванадиевый катализатор (ванадиевая контактная масса) представляет собой смесь каталитически активного вещества пентаоксида ванадия V2O5, некоторых веществ, повышающих активность катализатора – активаторов, и носителя, который создает структурную основу катализатора.
Количество окисленного диоксида серы характеризуют долей общего содержания диоксида серы в газе или в процентах (к общему первоначальному его количеству в газе). Эту величину называют степенью превращения, или степенью окисления. Степень превращения диоксида серы, достигаемая на катализаторе, зависит от активности катализатора, состава газа, продолжительности контакта газа с катализатором, давления и др. факторов. Для газа данного состава теоретически возможная, т. е. равновесная степень превращения, зависит от температуры.
С понижением температуры и повышением давления газа значение степени превращения диоксида серы возрастает. Это обусловлено тем, что реакция окисления протекает с выделением тепла и уменьшением общего числа молекул. В таблице 2.3 приведены значения степени превращения при различных температурах и давлениях для сернистого газа, содержащего в своем составе 7 % SO2, 11 % O2 и 82 % N2.
Таблица 2.3 - Зависимость равновесной степени превращения от давления
t, ºС |
Xp ∙ 100 при давлении (в МПа) |
|||||
0,1 |
0,5 |
1 |
2,5 |
5,0 |
10,0 |
|
400 |
99,2 |
99,6 |
99,7 |
99,9 |
99,9 |
99,9 |
450 |
97,5 |
98,9 |
99,2 |
99,5 |
99,6 |
99,7 |
500 |
93,4 |
96,9 |
97,8 |
98,6 |
99,0 |
99,3 |
550 |
85,5 |
92,9 |
94,9 |
96,7 |
97,7 |
93,3 |
600 |
73,4 |
85,8 |
89,5 |
93,3 |
95,0 |
96,4 |
Вышеуказанные данные таблицы 2.3 позволяют сделать следующие выводы:
- в зависимости от температуры процесса в зоне эффективной работы катализатора достигаются достаточно высокие величины степени превращения диоксида серы;
- влияние давления на процесс окисления незначительно.
Равновесная степень превращения диоксида серы зависит от соотношения между концентрациями диоксида серы и кислорода газе, которое, в свою очередь, зависит от вида обжигаемого сырья и количества подаваемого воздуха. Чем больше введено воздуха, тем меньше SO2 и больше O2 содержится в газовой смеси и, следовательно, тем выше равновесная степень превращения диоксида серы (см. данные таблицы 2.4). Таким образом, избыток кислорода благоприятно сказывается на степени превращения.
Таблица 2.4 - Зависимость равновесной степени превращения Xp от состава газовой смеси (при температуре 475 °С и давлении 0,1 МПа)
Содержание в газе, % об. |
Xp ∙ 100 |
Содержание в газе, % об. |
Xp ∙ 100 |
||
SO2 |
O2 |
SO2 |
O2 |
||
2 |
18,4 |
97,1 |
7 |
11,0 |
95,8 |
3 |
16,72 |
97,0 |
8 |
9,58 |
95,2 |
4 |
15,28 |
96,8 |
9 |
8,15 |
94,3 |
5 |
13,86 |
96,5 |
10 |
6,72 |
92,3 |
6 |
12,43 |
96,2 |
|
|
|
Оптимальные условия процесса окисления диоксида серы можно определить с помощью данных рисунка 2.13, на котором изображена диаграмма t – Х, характеризующая зависимость температуры от степени превращения, для пятистадийного процесса с промежуточным теплообменом при содержании в газе 7 % диоксида серы и 11 % кислорода.
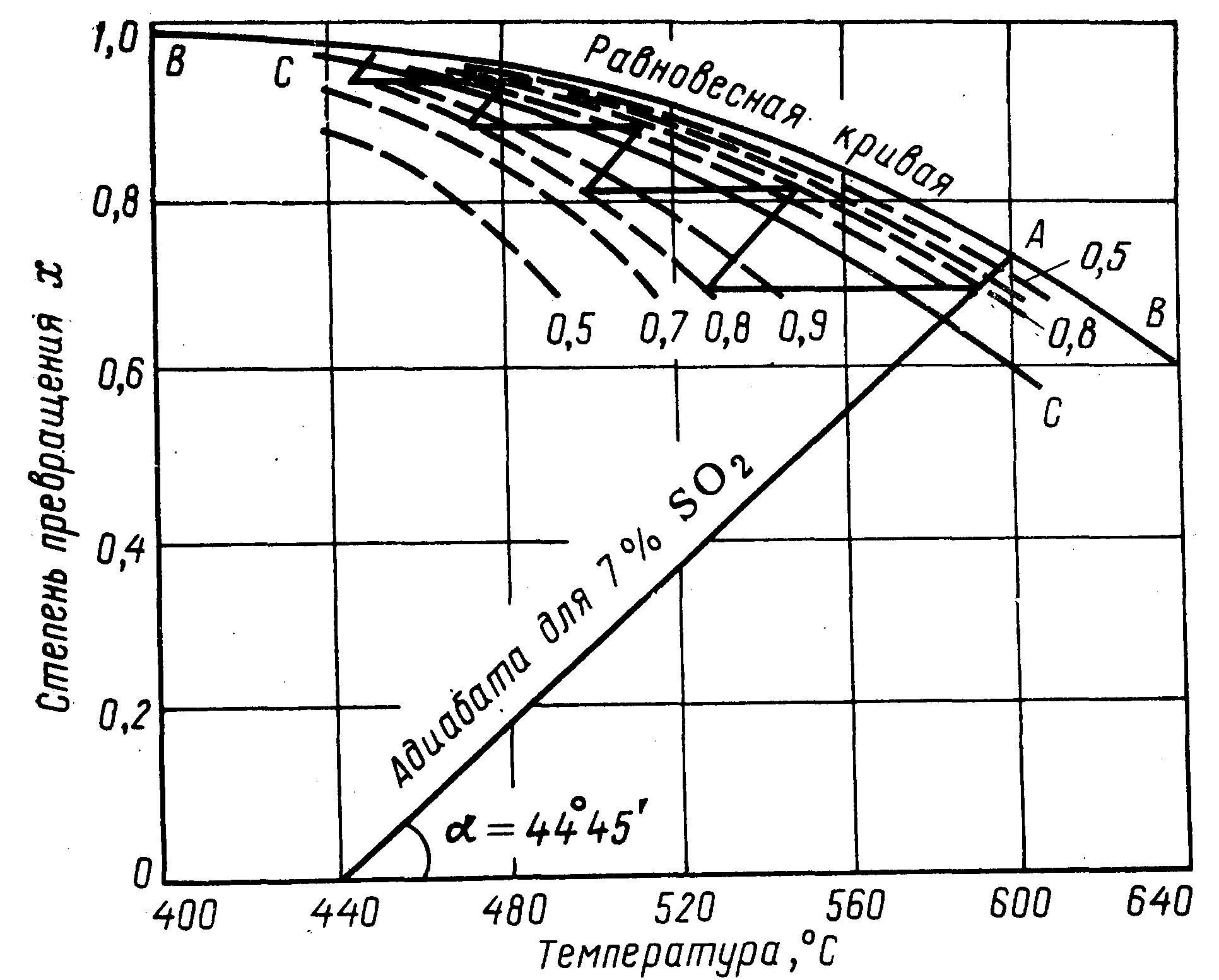
Рисунок 2.13 - Диаграмма t – Х для пятистадийного контактирования с
промежуточным теплообменом
Прямая АА - адиабата - соответствует адиабатическому процессу, когда в первом слое контактной массы происходит повышение температуры газа за счет тепла реакции; ВВ — кривая равновесной степени превращения диоксида серы, СС - кривая оптимальных температур. Пунктирные кривые соответствуют скоростям реакции, составляющим 0,9; 0,8; 0,7 и 0,5 от максимальной (вследствие отклонения температуры от оптимального значения).
Из рисунка 2.13 очевидно, что при адиабатическом повышении температуры примерно до 600 °С степень превращения диоксида серы достигает 0,73. На практике для достижения более высокой скорости процесса в первом слое степень превращения доводят примерно до 0,7, хотя в этом случае условия процесса отклоняются от оптимальных условий.
Перед поступлением во второй слой контактной массы газ охлаждается в теплообменнике, что на диаграмме t – Х соответствует участку прямой, параллельной оси абсцисс. Газ охлаждается до температуры 525 °С, при этой температуре скорость процесса составляет 0,8 оптимальной.
Во втором слое контактной массы процесс протекает также в адиабатических условиях. Здесь температура повышается до 550 °С, а степень превращения диоксида серы достигает 0,81. После второго слоя контактной массы газ снова охлаждается (новый участок прямой на диаграмме) и поступает в третий слой и т. д.
Таким образом, на каждом слое протекает адиабатический процесс, а в общем (в контактном аппарате в целом), процесс является политропическим.
Из данных рисунка 2.13 следует, что для процесса окисления диоксида серы в целом не может быть постоянной оптимальной температуры и по мере роста степени превращения диоксида серы температуру процесса следует понижать в соответствии с линией АА на рисунке 2.13. Однако начинать процесс окисления диоксида серы при очень высокой температуре также невыгодно, так как нагревание газа до высокой температуры связано с затратами энергии. Поэтому на практике поступают следующим образом. Обжиговый газ нагревают до температуры несколько выше температуры зажигания (в зависимости от активности катализатора – до 400 – 440 °С) и направляют в первый слой катализатора в контактном аппарате. В ходе реакции окисления выделяется большое количество тепла, вследствие чего температура газа резко повышается. Процесс ведут адиабатически (без отвода тепла) до тех пор, пока температура не достигнет оптимального значения. Далее ведение адиабатического процесса нецелесообразно, поэтому начинают отводить тепло с таким расчетом, чтобы температура дальнейшего процесса окисления диоксида серы стала максимально близкой к оптимальной температуре.
Вместе с тем, из данных рисунка 2.13 следует, что достижение степени превращения диоксида серы более 98 % связано с резким увеличением объема катализатора. Для увеличения конечной степени превращения диоксида серы применяют двойное контактирование (ДК). Сущность его состоит в том, что окисление (контактирование) ведут в две стадии. При этом на первой стадии обеспечивается степень превращения 90 %. Затем из реакционной смеси выделяют триоксид серы абсорбцией раствором серной кислоты, после чего проводят вторую стадию контактирования, на которой достигается степень превращения диоксида серы, равная 95 % от оставшегося количества диоксида серы. В конечном итоге за счет проведения процесса двойного контактирования – двойной абсорбции (ДК-ДА), разработанного советскими учеными Г.К. Боресковым, В.С. Бесковым и др., общая степень превращения диоксида серы составляет 99,5 %.
Кроме того, применение процесса ДК-ДА на несколько порядков снизило выброс токсичных газов и дало значительную экономию на строительстве очистных сооружений в производстве серной кислоты.
2.2.4.4 Абсорбция триоксида серы серной кислотой
Последней стадией процесса производства серной кислоты контактным методом является извлечение триоксида серы из газовой смеси и превращение его в серную кислоту. В зависимости от того, подвергается ли газ осушке перед контактным аппаратом или нет, механизм процесса выделения триоксида серы различен. В первом случае он абсорбируется серной кислотой, во втором случае происходит конденсация серной кислоты.
На большинстве заводов серный газ подвергается осушке и триоксид серы абсорбируется серной кислотой в башнях и абсорберах. Триоксид серы растворяется в серной кислоте, а затем взаимодействует с содержащейся в ней водой:
nSO3 + H2O = H2SO4 + (n – 1)SO3
В зависимости от количественного соотношения воды и триоксида серы получают серную кислоту различной концентрации. При n > 1 образуется олеум, при n = 1 – моногидрат (100 %-ная серная кислота), а при n < 1 – водный раствор серной кислоты, т. е. разбавленная серная кислота.
После абсорбции газовая смесь вместе с непоглощенным триоксидом серы удаляется в атмосферу. Для уменьшения потерь триоксида серы с отходящими газами обеспечивается условия наиболее полного его поглощения в абсорбционном отделении.
Газообразный триоксид серы наиболее полно абсорбируется 98,3 %-ной серной кислотой (см. рисунок 2.14); при меньшей или большей концентрации серной кислоты способность ее к поглощению ухудшается.
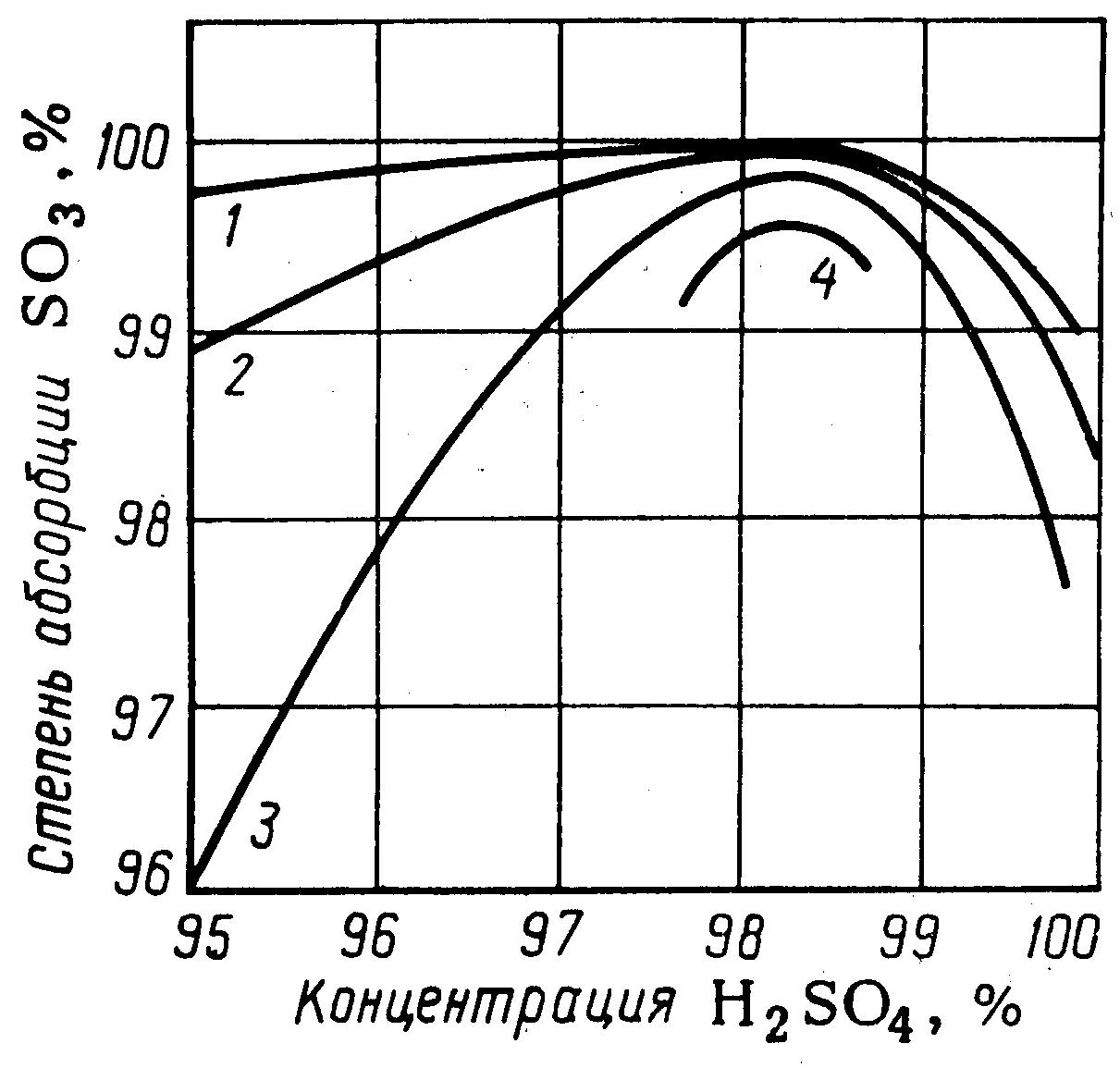
1 – при температуре 60 °С; 2 – при температуре 80 °С;
3 – при температуре 100 °С; 4 – при температуре 120 °С
Рисунок 2.14 - Степень абсорбции триоксида серы в моногидратном абсорбере
Такая зависимость объясняется тем, что над серной кислотой концентрацией ниже 98,3 % H2SO4 равновесное давление триоксида серы ничтожно мало (р*SO3 ≈ 0), а равновесное давление паров воды значительное (р*Н2О > 0), поэтому с поверхности серной кислоты происходит испарение (десорбция) молекул воды.
Основное количество молекул триоксида серы диффундирует к поверхности серной кислоты и абсорбируются ею, но часть молекул триоксида серы встречается с молекулами воды, испаряющимися с поверхности серной кислоты и диффундирующими в основной газовый поток. Сталкиваясь, эти молекулы соединяются с образованием паров молекул серной кислоты, которые затем конденсируются в объеме с образованием мельчайших капель (тумана) серной кислоты:
SO3(газ) + Н2О(газ) = H2SO4(газ) = H2SO4(туман)
Туман серной кислоты плохо улавливается в обычной абсорбционной аппаратуре и, в основном, уносится с отходящими газами в атмосферу. Чем ниже концентрация серной кислоты и выше ее температура, тем больше выделяется из нее паров воды, больше образуется тумана и больше теряется триоксида серы (см. рисунок 2.14).
Над серной кислотой концентрацией выше 98,3 % H2SO4 равновесное давление р*SO3 > 0, поэтому триоксид серы абсорбируется серной кислотой не полностью. В этом случае отходящие газы также уносят в атмосферу часть триоксида серы. Таким образом, при концентрации орошающей серной кислоты менее и более 98,3 % H2SO4 степень абсорбции триоксида серы снижается; она тем ниже, чем выше температура, поскольку равновесные давления паров воды и триоксида серы над кислотой возрастают с повышением температуры.
При концентрации серной кислоты 98,3 % H2SO4 равновесные давления паров воды и триоксида серы малы (р*Н2О ≈ 0; р*SO3 ≈ 0), но равновесное давление паров самой серной кислоты значительное (р*H2SO4 > 0), поэтому происходит испарение (десорбция) паров серной кислоты с ее поверхности и степень абсорбции триоксида серы существенно снижается. Однако при температуре ниже 100 °С (при которой на практике ведут процесс абсорбции триоксида серы) равновесное давление паров серной кислоты очень мало, поэтому в производственных условиях 98,3 %-ная серная кислота обладает наиболее высокой абсорбционной способностью по отношению к триоксиду серы (см. рисунок 2.14).
Современная схема производства серной кислоты из флотационного колчедана с окислением диоксида серы и абсорбцией триоксида серы в процессе двойного контактирования – двойной абсорбции (ДК-ДА) приведена на рисунке 2.15.
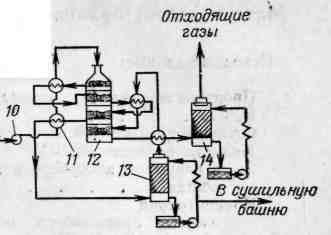
Рисунок 2.15 - Технологическая схема контактно-абсорбционного отделения
Из нагнетателя 10 газ проходит теплообменники 11 и поступает на первый, а затем на второй и третий слои контактной массы контактного аппарата 12. После третьего слоя газ подают в промежуточный моногидратный абсорбер 13, а затем в теплообменник и в четвертый слой контактной массы. Охлажденный в теплообменнике газ проходит абсорбционную башню 14 и далее выводится в атмосферу. Чаще всего отходящие газы для обезвреживания – санитарной очистки от оксидов серы проходят через башни с насадкой, орошаемой раствором кальцинированной соды.
2.2.5 Производство серной кислоты методом мокрого катализа
Метод мокрого катализа состоит в том, что диоксид серы, полученный от сжигания сероводорода по реакции:
Н2S + 1,5О2 = SO2 + Н2O + 519 кДж
вместе со значительным количеством паров воды окисляется на ванадиевом катализаторе в триоксид серы. Далее газовая смесь охлаждается в конденсаторе, где конденсируются образующиеся пары серной кислоты. Поскольку окисление диоксида серы этим методом происходит в присутствии паров воды, метод получил название - метод мокрого катализа.
Возможность получения серной кислоты методом мокрого катализа впервые установили в СССР И.А. Ададуров и Д. Гернет (1931 г.). Особенно удобен этот метод для получения серной кислоты из сероводородсодержащих газов, являющихся отходами некоторых производств. Выделяющийся сероводород тщательно промывают, поэтому он не нуждается в дополнительной очистке, что упрощает процесс производства серной кислоты.
Процесс мокрого катализа состоит всего из трех этапов:
- сжигания сероводорода;
- окисления образующегося диоксида серы на катализаторе;
- выделения серной кислоты.
При очистке горючих газов обычно получают концентрированный сероводородный газ (до 90 % сероводорода), поэтому в печах, где он сжигается, выделяется большое количество тепла. В связи с этим при сжигании сероводорода в печь вводят большой избыток воздуха или располагают в ней змеевики котла-утилизатора. Стадия окисления диоксида серы на катализаторе в процессе мокрого катализа оформлена примерно так же, как в схемах с использованием пиритного колчедана. Для снижения температуры в газовую смесь на выходе из слоев контактной массы обычно добавляют атмосферный неосушенный воздух. Поскольку в газе уже присутствуют пары воды, они не влияют на процесс катализа.
При охлаждении такого газа происходит образование серной кислоты по реакции:
SO3(газ) + Н2О(газ) = Н2SО4(газ) = Н2SО4(жидкость)
Процесс конденсации паров на поверхности изучен достаточно подробно. Однако, поскольку в производстве серной кислоты конденсация паров на поверхности происходит в присутствии большого количёства неконденсирующегося газа, всегда образуется пересыщенный пар, приводящий к конденсации паров серной кислоты в объеме с образованием тумана.
На рисунке 2.16 показано соотношение между компонентами газовой смеси, содержащей 6,29 % триоксида серы и 10,09 % паров воды, при различных температурах. Из данных рисунка 2.16 следует, что конденсация паров серной кислоты начинается при температуре 273 °С (точка росы) и практически заканчивается при температуре 150 °С. К началу конденсации около 30 % паров серной кислоты диссоциировано (см. кривую для триоксида серы); при температуре 240 °С степень диссоциации снижается до 5 %. Концентрация конденсирующейся кислоты уменьшается от 97,5 % в точке росы до 92 % при температуре 150 °С.
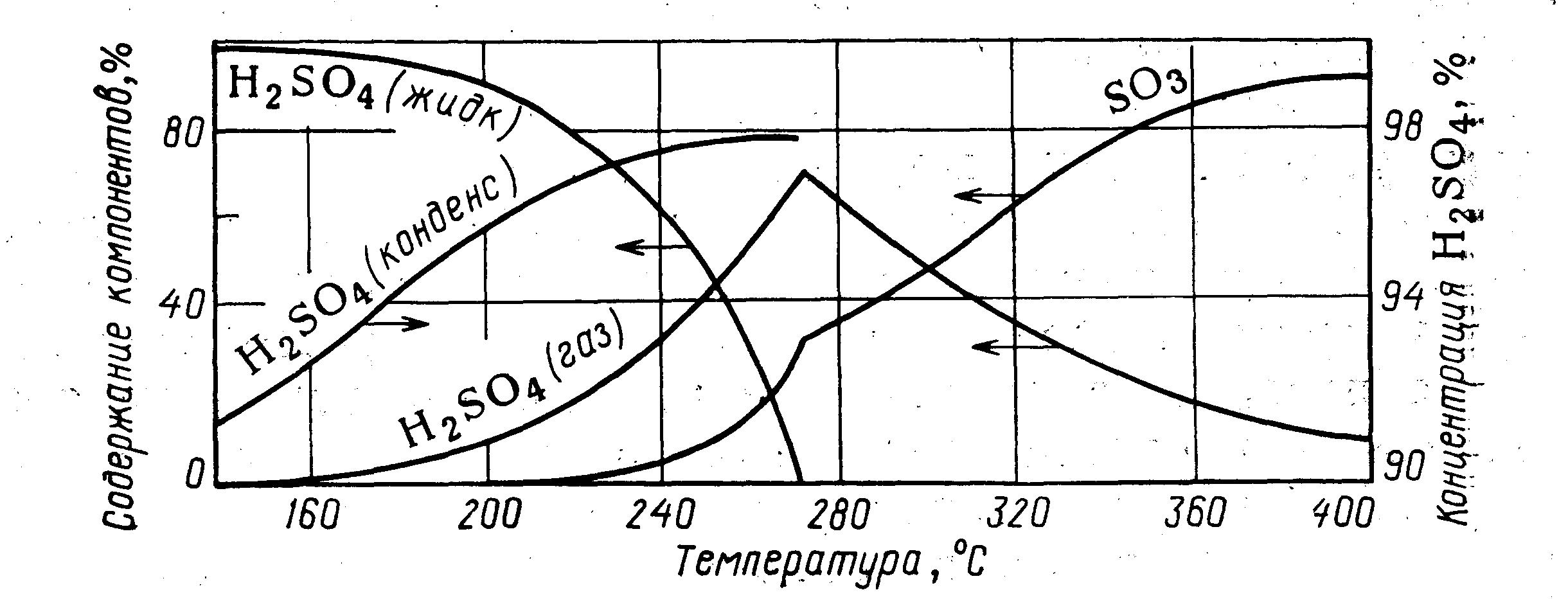
Рисунок 2.16 - Диаграмма состояния системы
SO3+Н2О = Н2SО4(г) = Н2SО4(ж)
Необходимо создавать такие условия конденсации серной кислоты, при которых пары серной кислоты могут быть сконденсированы на поверхности без образования тумана с любой заданной степенью полноты. Для этого при конденсации должна поддерживаться определенная скорость охлаждения газа и для достижения высокой степени конденсации требуется большая поверхность охлаждения. Как показывают расчеты и опыт, часто экономически выгоднее вести процесс конденсации при больших скоростях охлаждения, когда одновременно с конденсацией паров серной кислоты на поверхности происходит конденсация паров в объеме с образованием тумана, который затем выделяют в фильтрах. Выделение капель тумана происходит тем полнее, чем больше размер капель, поэтому при конденсации паров серной кислоты стремятся создать условия, при которых образуются возможно более крупные капли. Одним из таких условий является уменьшение пересыщения пара в процессе конденсации паров серной кислоты.
Конденсацию паров серной кислоты ведут в орошаемых башнях с насадкой (скрубберы), трубчатых конденсаторах, аппаратах распылительного типа (например, в трубе Вентури) или в барботажных аппаратах (например, в башне с провальными тарелками) и др. аппаратах. Механизм процесса во всех перечисленных аппаратах одинаков и состоит в том, что парогазовая смесь охлаждается в результате соприкосновения с более холодной поверхностью жидкости или пленки конденсата.
Схема производства серной кислоты из концентрированного сероводородного газа приведена на рисунке 2.17.
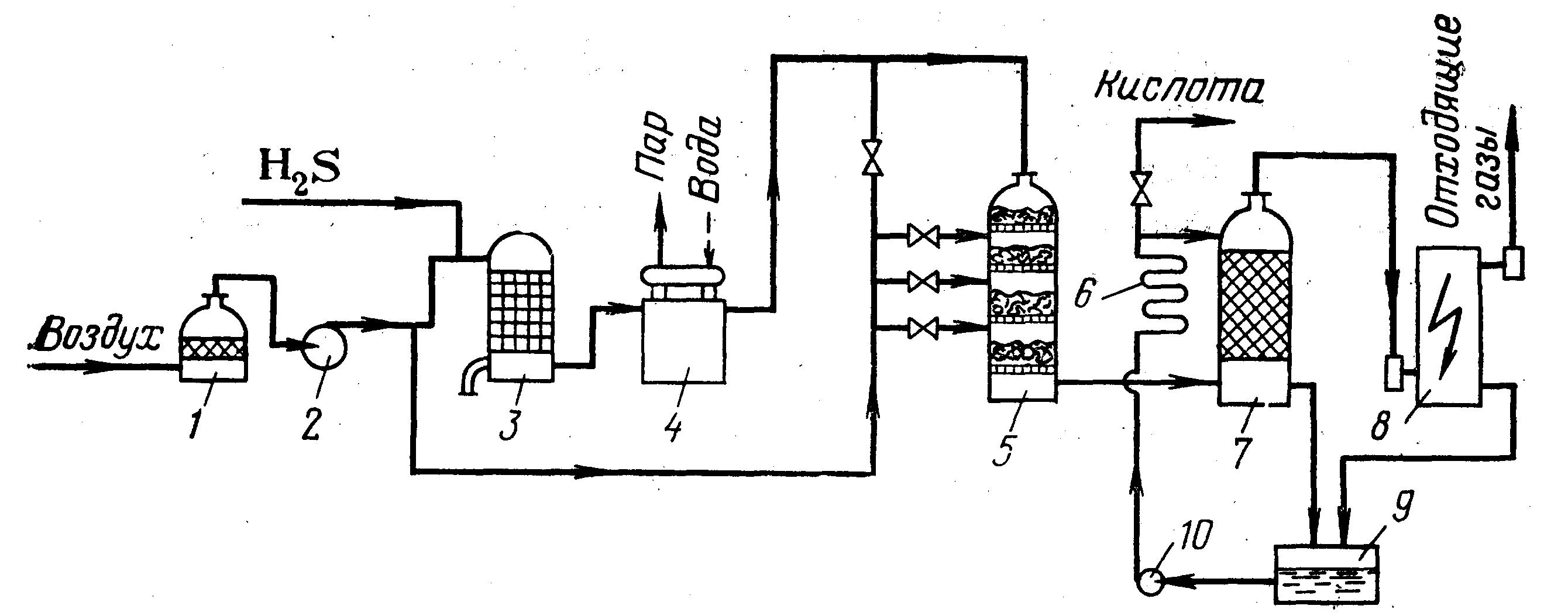
Рисунок 2.17 - Схема производства серной кислоты из сероводородного газа высокой концентрации
Сероводородсодержащий газ поступает в печь 3 для сжигания в смеси с воздухом, подаваемым вентилятором 2. Из печи газ при температуре около 1000 °С поступает в котел-утилизатор 4, где тепло газа используется для получения пара. Охлажденный газ при температуре 400–420 °С поступает в контактный аппарат 5. Между слоями контактной массы в газ вводят атмосферный воздух.
Из контактного аппарата газ, содержащий триоксид серы и пары воды, поступает в башню-конденсатор 7, заполненную кольцевой насадкой и орошаемую серной кислотой. Температура орошающей кислоты на входе в башню 50-60 °С, на выходе из нее температура равна 80-90 °С. При охлаждении газа триоксид серы и пары воды образуют пары серной кислоты, которые затем конденсируются. В башне 7 происходит быстрое охлаждение газа, поэтому возникает высокое пересыщение паров серной кислоты. Часть паров (около 35 %) конденсируется в объеме с образованием тумана, который выделяется далее в мокром электрофильтре 8.
Циркуляция раствора серной килоты обеспечивается наличие циркуляционного контура «сборник серной кислоты 9 – кислотный насос 10».
2.2.6 Совершенствование сернокислотного производства
Большие масштабы производства серной кислоты особенно остро ставят проблему его совершенствования. Здесь можно выделить следующие основные направления:
1. Расширение сырьевой базы за счет использования отходящих газов котельных теплоэлектроцентралей и различных производств.
2. Повышение единичной мощности установок. Увеличение мощности в два-три раза снижает себестоимость продукции на 25-30 %.
3. Интенсификация процесса обжига сырья путем использования кислорода или воздуха, обогащенного кислородом. Это уменьшает объем газа, проходящего через аппаратуру, с повышением ее производительности.
4. Повышение давления в процессе, что способствует увеличению интенсивности работы основной аппаратуры.
5. Применение новых катализаторов с повышенной активностью и низкой температурой зажигания.
6. Повышение концентрации оксида серы (IV) в печном газе, подаваемом на контактирование.
7. Внедрение реакторов кипящего слоя на стадиях обжига сырья и контактирования.
8. Использование тепловых эффектов химических реакций на всех стадиях производства, в том числе, для выработки энергетического пара.
