
- •6.070800 «Экология и охрана окружающей среды»
- •Введение
- •1 Производство синтетического аммиака
- •1.1 Методы производства азота и водорода
- •1.2 Промышленный катализ
- •1.3 Очистка природных газов от соединений серы
- •1.4 Конверсия метана
- •1.5 Конверсия оксида углерода (II)
- •1.6 Технологическая схема производства конвертированного газа
- •1.7 Очистка конвертированного газа от диоксида углерода
- •1.8 Тонкая очистка конвертированного газа от кислородсодержащих соединений
- •1.9 Технологическая схема очистки конвертированного газа от кислородсодержащих соединений
- •1.10 Синтез аммиака из смеси азота и водорода
- •1.11 Синтез метанола из оксида углерода и водорода
- •2 Производство неорганических кислот
- •2.1 Производство азотной кислоты
- •2.2 Производство серной кислоты
- •3 Производство кальцинированной соды
- •3.1 Принципиальная схема производства соды аммиачным
- •3.2 Аммонизация очищенного рассола
- •3.3 Карбонизация аммонизированного рассола
- •3.4 Кальцинация гидрокарбоната натрия
- •3.5 Регенерация аммиака в производстве кальцинированной соды
- •4 Производство минеральных удобрений
- •4.1 Производство карбамида
- •4.2 Производство нитрата аммония
- •4.3 Производство сульфата аммония
- •4.4 Производство нитрата калия
- •4.5 Производство суперфосфата
- •Рекомендованная литература
1.11 Синтез метанола из оксида углерода и водорода
Метанол (метиловый спирт) СН3ОН представляет бесцветную легкоподвижную жидкость с температурой кипения 64,65 °С, температурой кристаллизации -97,9 °С и плотностью 0,792 т/м3. Критическая температура метанола равна 239,65 °С. Метанол смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и другими органическими растворителями, образуя с некоторыми из них азеотропные смеси. Хорошо растворяет многие газы, в том числе оксиды углерода, ацетилен, этилен и метан, вследствие чего используется в технике для абсорбции примесей из технологических газов. Метанол является токсичным веществом, вызывая отравление через органы дыхания, кожу и при приеме внутрь, действуя на нервную и сосудистую системы. Предельно-допустимая концентрация метанола составляет 5 мг/м3. Прием внутрь человеческого организма 5 -10 мл метанола приводит к тяжелому отравлению, доза 30 мл и более может быть смертельной.
Метанол - сырье для многих производств органического синтеза. Основное количество его расходуется на получение формальдегида. Он служит промежуточным продуктом в синтезе сложных эфиров органических и неорганических веществ (диметилтерефталата, метилметакрилата, диметилсульфата), пентаэритрита. Его применяют в качестве метилирующего средства для получения метиламинов и диметиланилина, карбофоса, хлорофоса и других продуктов. Метанол используют также в качестве растворителя и экстрагента, в энергетических целях как компонент моторных топлив и для синтеза метил-трет-бутилового эфира - высокооктановой добавки к топливу. В последнее время наметились новые перспективные направления использования метанола, такие как производство уксусной кислоты, очистка сточных вод, производство синтетического протеина, конверсия в углеводороды с целью получения топлива.
В течение длительного времени метанол получали как продукт сухой перегонки древесины (отсюда его иногда применяемое название – древесный спирт). В настоящее время более 75 % мирового производства метанола получается исходя из природного газа – основного сырьевого источника. Традиционно это производство относится к азотной промышленности, поскольку получение синтез-газа (смеси водорода и оксида углерода (II)) осуществляется по технологии, аналогичной технологии получения синтез-газа в производстве синтетического аммиака.
1.11.1 Физико-химические основы процесса синтеза метанола
Реакция синтеза метанола из синтез-газа представляет гетерогенно-каталитическую обратимую экзотермическую реакцию, протекающую по уравнению:
CO + 2H2 ↔ CH3OH - ΔН1,
где ΔН1 = 90,7 кДж.
Тепловой эффект реакции возрастает с повышением температуры и давления, составляя для условий синтеза величину 110,8 кДж.
Параллельно основной реакции протекают и побочные реакции:
CO + 3H2 ↔ CH4 + H2О – ΔН2,
где ΔН2 = 209 кДж;
2CO + 2H2 ↔ CH4 + СО2 – ΔН3,
где ΔН3 = 252 кДж;
CO + H2 ↔ НСНО – ΔН4,
где ΔН4 = 8,4 кДж,
а также продукционная реакция образования метанола из содержащегося в синтез-газе диоксида углерода:
СО2 + 3H2 ↔ CH3OH + H2О – ΔН5,
где ΔН5 = 49,5 кДж.
Кроме этого, образовавшийся метанол может подвергаться вторичным превращениям по реакциям:
2CH3OH ↔ (СН3)2О + H2О
2CH3OH + H2 → CH4 + H2О
2CH3OH + nСО + 2nH2 ↔ СН3(СН2)nОН.
Синтез метанола из оксида углерода (II) и водорода сопровождается образованием целого ряда различных продуктов - метанола, изобутилового спирта, бензила, парафина, олеина и др. в зависимости от применяемого катализатора. Поэтому катализаторы синтеза метанола должны обладать высокой селективностью, а кроме того, устойчивостью против старения и большой механической прочностью.
Основная реакция и побочные реакции протекают с выделением тепла и уменьшением объема, но различаются величиной теплового эффекта и степенью контракции. Поэтому, хотя для всех этих реакций степень превращения возрастает с увеличением давления и понижением температуры, в наибольшей степени повышение давления влияет на равновесие основной реакции синтеза из оксида углерода (II) и водорода, для которой степень контракции максимальна и составляет 3 : 1. В то же время, понижение температуры ниже некоторого предела нецелесообразно, так как при низких температурах скорость процесса синтеза настолько мала, что не существует катализатора, который в этих условиях мог бы существенно ускорить достижение высокой степени превращения сырья.
Вследствие противоречивого влияния температуры на скорость процесса и равновесную степень превращения выход метанола за один проход реакционной смеси через реактор не превышает 20 %, что делает необходимой организацию циркуляционной технологической схемы синтеза.
Промышленные катализаторы синтеза метанола работают при высоких температурах. Температура процесса зависит главным образом от активности применяемого катализатора и варьируется в пределах от 250 до 420 °С. В соответствии с температурным режимом работы катализаторы синтеза метанола подразделяются на высокотемпературные и низкотемпературные катализаторы. Наибольшее распространение получили цинк-хромовые катализаторы и тройные низкотемпературные катализаторы с добавкой оксидов меди. Низкотемпературные катализаторы не обладают высокой селективностью и очень чувствительны к соединениям серы, поэтому их эффективное применение началось с 70-х годов прошлого столетия после создания систем глубокой очистки природного газа от соединений серы.
Высокотемпературные катализаторы, получаемые методом соосаждения оксидов цинка и хрома, например, катализатор СМС-4 состава 2,5 ZnO ∙ ZnCr2O4, термостойки, мало чувствительны к каталитическим ядам, причем отравляются обратимо, имеют высокую селективность, но активны только при высоких температурах 370 - 420 °С и давлениях 20 - 35 МПа. Низкотемпературные катализаторы, например, цинк-медь-алюминиевый состава ZnO ∙ CuO ∙ Al2O3 или цинк-медь-хромовый состава ZnО ∙ СиО ∙ Сг2О3, менее термостойки, необратимо отравляются каталитическими ядами, но проявляют высокую активность при относительно низких температурах 250 – 300 °С и давлениях 5 - 10 МПа, что более экономично. При пониженных температурах в метаноле-сырце снижается содержание различных примесей от 3 - 6 до 0,2 - 0,8 %, что упрощает последующую его очистку.
Оба типа катализаторов проявляют свою активность и селективность в узком интервале температур 20 – 30 °С. Исходя из температурного режима работы катализаторов, выбирается давление синтеза, которое тем больше, чем выше температура синтеза.
Наиболее вредной примесью в газе для синтеза метанола является пентакарбонил железа Fе(СО)5, который, разлагаясь на катализаторе, выделяет металлическое железо, что способствует образованию метана. Для очистки газа от пентакарбонила железа в системах синтеза метанола устанавливают угольные фильтры, а стальные стенки аппаратов футеруют медью, алюминием или серебром.
Рассмотрим влияние ряда технологических параметров на эффективность протекания процесса синтеза метанола из оксида углерода (II) и водорода. Скорость образования метанола зависит от концентрации компонентов исходной газовой смеси, времени контакта, температуры и давления.
При повышении давления выход метанола почти прямо пропорционально увеличивается и резко возрастает степень превращения оксида и диоксида углерода (при 380 °С):
Давление, МПа .......... 5 10 20 30 40
Выход СН3ОН, % об. .. ...... 0,37 1,56 5,54 9,31 11,68.
Следует заметить, что с увеличением давления более резкий рост равновесного выхода метанола наблюдается при повышенных температурах. Так, при изменении давления от 5 до 30 МПа равновесный выход метанола при 280 °С увеличивается в 2,4 раза, а при 380 °С - в 2,3 раза (отношение H2 : СО = 4 : 1).
С повышением температуры равновесный выход метанола понижается. Наиболее резкое понижение наблюдается при температурах выше 340°С. В этих условиях (при давлении 30 МПа) начинает снижаться степень превращения оксида и диоксида углерода в метанол, причем более резко для оксида углерода (ІІ):
Температура, °С ....... 250 300 340 360 380 400
Выход метанола, % об. ….... 15,44 14,81 12,88 11,37 9,31 7,40
Степень превращения, %
- по СО ........... 99,75 97,20 87,52 78,96 66,19 53,29
- по СО2 ........... 98,00 89,80 77,00 71,50 66,61 64,00.
При давлении 5 МПа и повышении температуры от 180 до 300 °С равновесный выход метанола снижается более чем в 7 paз (отношение Н2 : СО = 3,6, содержание диоксида углерода 6,0 % об.). При этом степень превращения оксида и диоксида углерода в метанол уменьшается с 75,3 до 14,6 %.
Большое значение для проведения процесса синтеза метанола имеет соотношение Н2 : СО в газовой смеси, поступающей на синтез. При поддержании стехиометрического соотношения, равного двум, образуется загрязненный метанол. Повышение содержания водорода уменьшает образование метана; чрезмерное снижение содержания оксида углерода приводит к значительному уменьшению выхода метанола (см. рисунок 1.7).
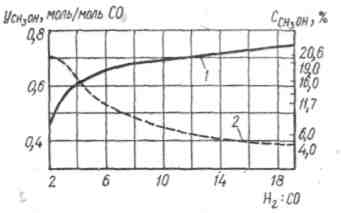 Рисунок
1.7
-
Зависимость степени конверсии оксида
углерода (II) в метанол (1) и содержания
метанола в газе (2) от мольного соотношения
Н2
: СО в газовой смеси
Рисунок
1.7
-
Зависимость степени конверсии оксида
углерода (II) в метанол (1) и содержания
метанола в газе (2) от мольного соотношения
Н2
: СО в газовой смеси
Максимальная производительность наблюдается при соотношении Н2 : СО = 4. При синтезе метанола на медьсодержащем катализаторе в газовой смеси должно быть 3-15 % СО2, который участвует в фазовых превращениях катализатора и длительное время сохраняет его активность. При работе на цинк-хромовом катализаторе наличие СО2 не всегда желательно.
С увеличением объемной скорости поступающего газа содержание метанола в газе уменьшается. Однако за счет большего объема газа, проходящего за единицу времени через единицу объема катализатора, производительность его увеличивается (см. рисунок 1.8). В промышленных условиях вначале работы системы объемная скорость в колонне синтеза составляет 40000 - 45000 ч-1, к концу работы ее снижают до 15000 - 20000 ч-1 из-за снижения активности катализатора.
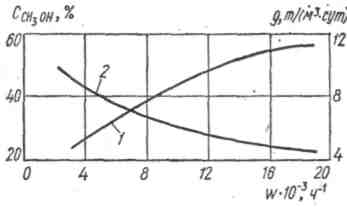 Рисунок
1.8
– Зависимость производительности
катализатора СНМ - 1 (1) и содержания
метанола в газе на выходе из колонны
синтеза (2) при концентрациях оксида и
диоксида углерода, равных 8 % об. и водорода
20 % об.
Рисунок
1.8
– Зависимость производительности
катализатора СНМ - 1 (1) и содержания
метанола в газе на выходе из колонны
синтеза (2) при концентрациях оксида и
диоксида углерода, равных 8 % об. и водорода
20 % об.
В промышленных условиях синтез метанола протекает в присутствии инертных к данному процессу газов (метан, азот). Они в реакции не участвуют и не оказывают прямого влияния на равновесие реакции образования метанола. Однако наличие их в газе снижает парциальное (эффективное) давление реагирующих веществ, что ведет к уменьшению равновесного выхода метанола. Поэтому концентрацию инертных компонентов необходимо поддерживать на минимальном уровне.
Конденсация метанола из газовой смеси после его синтеза производится значительно легче, чем конденсация аммиака. При температурах 20 – 30 оС давление паров метанола над жидкостью очень мало, поэтому для конденсации метанола достаточно охлаждения газа при давлении 5 - 10 МПа водой, охлажденной до 20 – 25 оС. При этом степень конденсации составляет 95 - 98 %.
На основании изложенного следует отметить, что синтез метанола на цинк-хромовом катализаторе, который работает при 360 - 380 °С, целесообразно проводить только при давлениях выше 20 МПа. На низкотемпературных катализаторах, эксплуатируемых в температурном интервале 220 – 280 °С, возможна работа при давлениях ниже 10 Мпа.
1.11.2 Технологическая схема синтеза метанола
Многочисленные технологические схемы производства метанола включают три обязательных стадии:
- очистка синтез-газа от сернистых соединений, карбонилов железа и частиц компрессорного масла;
- собственно синтез метанола;
- очистка и ректификация метанола-сырца с получением готового продукта.
Ниже рассмотрена технологическая схема синтеза метанола при низком давлении (см. рисунок 1.9), который проводится на цинк-медь-алюминиевых или цинк-медь-хромовых катализаторах при температуре 250 – 300 °С и давлении 5 - 10 МПа. Использование в этом методе низкотемпературных катализаторов, активных при более низких давлениях, позволяет снизить энергозатраты на сжатие газа и уменьшить степень рециркуляции не прореагировавшего сырья, то есть увеличить степень его конверсии. Однако, в этом методе требуется особо тонкая очистка исходного газа от различных соединений, отравляющих катализатор.
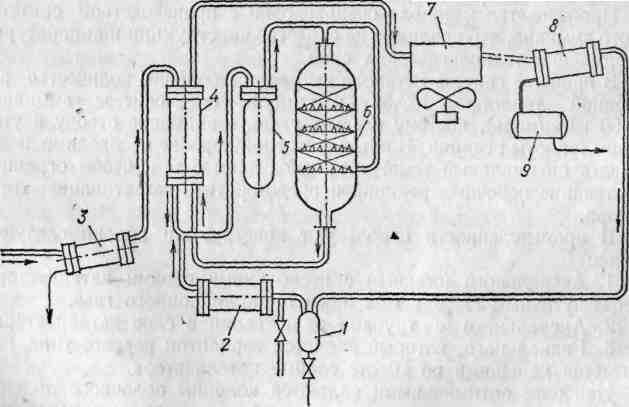 1-
сепаратор; 2- циркуляционный центробежный
компрессор; 3- сепаратор-влагоотделитель;
4 – теплообменник; 5 – фильтр; 6 – реактор
синтеза; 7 – воздушный холодильник; 8 –
сепаратор; 9 - сборник
1-
сепаратор; 2- циркуляционный центробежный
компрессор; 3- сепаратор-влагоотделитель;
4 – теплообменник; 5 – фильтр; 6 – реактор
синтеза; 7 – воздушный холодильник; 8 –
сепаратор; 9 - сборник
Рисунок 1.9 – Технологическая схема синтеза метанола
Из цеха получения синтез-газа конвертированный газ с давлением 6 – 11 МПа поступает в отделение синтеза метанола. Свежий газ проходит сепаратор-влагоотделитель (3) и вместе с циркуляционным газом, подаваемым циркуляционным центробежным компрессором (2), поступает в темплообменник (4), где подогревается за счет теплоты газа, выходящего из реактора синтеза (6). Подогретые газы проходят затем фильтр (5) очистки от пентакарбонила железа Fe(CO)5. Фильтр заполнен гравием и активированным углем.
Очищенный и подогретый газ направляется в реактор синтеза (6). В реакторе из смеси газов водорода, оксида углерода (II) и диоксида углерода на медьсодержащем катализаторе при температуре 130 – 280 оС и давлении около 10 МПа образуется метанол. Из реактора синтеза горячий непрреагировавший газ с парами метанола проходит теплообменник (4), а затем охлаждается в воздушном холодильнике (7) и, если необходимо, в водяном холодильнике-конденсаторе. Сконденсировавшийся метанол отделяется в сепараторе (8) и собирается в сборнике (9), откуда направляется на ректификацию. Непрореагировавший газ циркуляционным центробежным компрессором (2) направляется в цикл. При накоплении в цикле более 4 - 6 % об. инертных примесей (СН4, Аг, N2) часть циркуляционного газа отводится после сепаратора (1) в коллектор природного газа отделения конверсии.
Теоретический расход газов на 1 т метанола составляет 700 м3 оксидов углерода и 1400 м3 водорода. Практически же суммарно расходуется 2450 - 2500 м3 газов. Степень конверсии газа в метанол составляет 86 - 88 % от теоретически рассчитанной.
Возросшая потребность в метаноле вызвала разработку новых перспективных методов его производства. К ним относятся:
1) Синтез в трехфазной системе «газ—жидкость—твердый катализатор», проводимый в суспензии из тонкодисперсного катализатора и инертной жидкости, через которую барботирует синтез-газ. В трехфазной системе может бытъ обеспечено более благоприятное состояние равновесия системы, что позволяет повысить равновесную концентрацию метанола в реакционной смеси до 15 % вместо 5 %, доведя степень конверсии оксида углерода (II) до 35 % вместо 15 %.
Синтез метанола прямым окислением метана воздухом на цинк-никель-кадмиевом катализаторе, который позволяет использовать в качестве сырья природный газ непосредственно из скважин.
Совместное производство из синтез-газа метанола и спиртов С2—С4 в виде так называемой «спиртовой композиции», используемой как добавка к моторному топливу.
Совместное производство метанола и аммиака на основе конвертированного газа по малоотходным энерготехнологическим схемам, обеспечивающим рациональное и комплексное использование сырья.
