
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
Полиморфизм
Некоторые металлы, например, железо, титан, олово и др. способны по достижении определенных температур изменять кристаллическое строение, т. е. изменять тип элементарной ячейки своей кристаллической решетки. Это явление получило название аллотропии или полиморфизма, а сами переходы от одного кристаллического строения к другому называются аллотропическими или полиморфными.
Процесс перехода одной модификации в другую может быть обратимым или необратимым. Так, при нагревании белого мягкого графитоподобного вещества состава BN (нитрид бора) при 1500-1800oС и давлении в несколько десятков атмосфер образуется его высокотемпературная модификация - боразон, по твердости близкий к алмазу. При понижении температуры и давления до значений, отвечающих обычным условиям, боразон сохраняет свою структуру. Примером обратимого перехода может служить взаимные превращения двух модификаций серы (ромбической и моноклинной) при 95о.С.
Полиморфные превращения могут проходить и без существенного изменения структуры. Иногда изменение кристаллической структуры вообще отсутствует, например, при переходе α-Fe в β-Fe при 769оС структура железа не меняется, однако исчезают его ферромагнитные свойства.Некоторые вещества имеют более двух полиморфных модификаций. Например, диоксид кремния имеет десять модификаций, фторид кальция - шесть, нитрат аммония - четыре.
Аллотропные модификации углерода
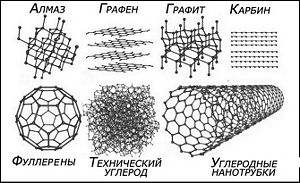
Алмаз сформирован
sp3
гибридными атомами, графен, графит,
фулярены и нанотрубки sp2
гибридными атомами карбин sp
гибридными атомами, а т ехнический
углерод(сажа) аморфный углерод.
ехнический
углерод(сажа) аморфный углерод.
Молекулярная решетка
Молекулярные кристаллы построены из отдельных молекул, внутри которых атомы соединены ковалентными связями. Между молекулами действуют более слабые межмолекулярные силы. Поэтому молекулярные кристаллы имеют низкие температуры плавления, малую твердость, высокую летучесть. Вещества, образующие молекулярные кристаллические решетки, не обладают электрической проводимостью, их растворы и расплавы также не проводят электрический ток. Молекулярную кристаллическую решетку имеют йод, сера, вода, СО2, НСl, твердые органические соединения (глюкоза, нафталин и т.д..
Металлическая решетка
В узлах кристаллической решётки расположены катионы металла. Между ними беспорядочно, подобно молекулам газа, движутся валентные электроны. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть.
Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8).В металлических кристаллах ядра атомов расположены таким образом, чтобы их упаковка была как можно более плотной.
Связь в таких кристаллах является делокализованной и распространяется на весь кристалл.
Металлические кристаллы обладают высокой электрической проводимостью и теплопроводностью, металлическим блеском и непрозрачностью, легкой деформируемостью.. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, Wα-Fe, Cr. Кубическую гранецентрированную решётку имеют металлы:, Ni, Ag, Au, , Pt. Гексагональную решётку имеют металлы: Mg, , Zn, Be, др.
Классификация кристаллических решеток отвечает предельным случаям. Большинство кристаллов неорганических веществ принадлежит к промежуточным типам - ковалентно-ионным, молекулярно-ковалентным и т.д. Например, в кристалле графита внутри каждого слоя связи ковалентно-металлические, а между слоями - межмолекулярные.
