
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
Кристаллические тела
Кристаллические тела имеют кристаллическую решетку, упорядоченную структуру (дальний порядок).
Для кристаллическиз соединений характерны следующие свойства:
а) однородность строения (регулярная кристаллическая решетка).
б) анизотропия. Такие свойства как теплопроводность, электропроводность, твёрдость и т.д. неодинаковы в разных направлениях. в) симметричность.
По симметрии выделяют различные типы решетки. Ниже приведены основные типы решеток.



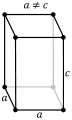
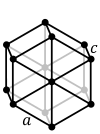
объемоцентричная гранецентрическая базоцентрическая примитивная гексагональная
В зависимости от того что находится в узлах решетки кристаллические решетки подразделяют на:
1. Ионные
2. Атомарные
3. Молекулярные
Металлические.
Ионные решетки
Кристаллические решетки, в узлах которых находятся ионы, называются ионными. В качестве иона могут выступать как одноатомные (Na+, Ca2+, Cl- ), так и многоатомные ионы (SO42-, CO32). Каждый ион окружен противоионами. Число таких соседей называется координационным числом.
Связь удерживающие ионы в узлах решетки – электростатическая. обычно ионные кристаллы твердые, но хрупкие. Их хрупкость обусловлена тем, что даже при небольшой деформации кристалла катионы и анионы смещаются таким образом, что силы отталкивания между одноименными ионами начинают преобладать над силами притяжения между катионами и анионами, и кристалл разрушается.
Ионные кристаллы отличаются высокими температурами плавления. В расплавленном состоянии вещества, образующие ионные кристаллы, электропроводны. При растворении в воде эти вещества диссоциируют на катионы и анионы, и образующиеся растворы проводят электрический ток.
Атомные решетки
Атомные кристаллы состоят из отдельных атомов, объединенных ковалентными связями. Из простых веществ только бор и элементы IVA-группы углерод , кремний и др. имеют такие кристаллические решетки. Нередко соединения оксидов также образуют атомные кристаллы (например, диоксид кремния, оксида алюминия, оксида хрома).
Так же как и ионные, атомные кристаллы можно считать гигантскими молекулами. Они очень прочные и твердые, плохо проводят теплоту и электричество. Вещества, имеющие атомные кристаллические решетки, плавятся при высоких температурах. Они практически нерастворимы в каких-либо растворителях. Для них характерна низкая реакционная способность.
Некоторые атомы в узлах решетки могут замещаться на атомы сходные по размеру. Это явление называется сокристаллизацией (изоморфизм). В зависимости от примесей могут изменяться свойства кристаллов. Оксид алюминия может формировать корунд, рубин (ионы хрома придают красную окраску) и сапфир ионы железа и титана придают синюю окраску).
В кристаллах алюмокалиевых квасцов KAl(SO4)2 . 12H2O катионы калия могут быть частично или полностью заменены катионами рубидия или аммония, а катионы алюминия - катионами хрома(III) или железа(III). Изоморфизм широко распространен в природе. Большинство минералов представляет собой изоморфные смеси сложного переменного состава.
