
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
Фазовые переходы (Лекция №3)
Термодинамическая фаза - однородная по составу и свойствам часть термодинамической системы, отделенная от других фаз поверхностями раздела, на которых скачком изменяются некоторые свойства системы. Другое определение: Фаза — гомогенная часть гетерогенной системы.
Разные фазы могут быть представлены различными агрегатными состояниями или разными полиморфными модификациями вещества.
Фа́зовый перехо́д — переход вещества из одной термодинамической фазы в другую при изменении внешних условий. Выделяют фазовые переходы 1ого и 2ого рода. Переход из одного агрегатного состояния в другое – фазовый переход 1ого рода. Переход 2 ого рода – это переход между аллотропными модификациями веществ.
В однокомпонентной системе разные фазы могут быть представлены различными агрегатными состояниями или разными полиморфными модификациями вещества. В многокомпонентной системе фазы, кроме того, могут иметь различный состав и структуру.
При фазовом переходе второго рода (переход между аллотропными модификациями). Плотность и внутренняя энергия не меняются, или мало меняются, так что невооружённым глазом такой фазовый переход может быть незаметен.
В ходе фазового перехода температура остается постоянной, а энергия поглощается или выделяется. Если в ходе процесса энтропия возрастает, то энергия поглощается процесс эндотермический. Q = –ТΔS (Н =ТΔS) К эндотермическим процессам относятся процессы происходящие в направлении от твердого тела к газу:
плавление, кипение, возгонка.
Энергия, подводимая к системе тратится на возрастание энтропии.
К экзотермическим процессам относятся процессы, происходящие в направлении от газа к твердому телу (с уменьшением энтропии):
конденсация, кристаллизация, десублимация.
Сколько энергии поглощается в ходе плавления, столько же и выделяется в ходе кристаллизации. Количество теплоты необходимо, чтобы обратить жидкость массой 1 кг в пар без изменения температуры, называется удельной теплотой парообразования. Для полного обращения в пар 1 кг воды (при температуре кипения) необходимо затратить 2,3 МДж. Для обращения в пар спирта требуется значительно меньше энергии ~ 0,9 МДж.
Для понимания фазовых диаграмм фундаментальное значение имеет правило фаз Гиббса. Согласно этому правилу число компонент (К), число фаз (Ф) и число степеней свободы (С) связано уравнением: С = К – Ф + 2. Число степеней свободы – это число параметров, которые можно менять независимо при процессе фазового перехода.
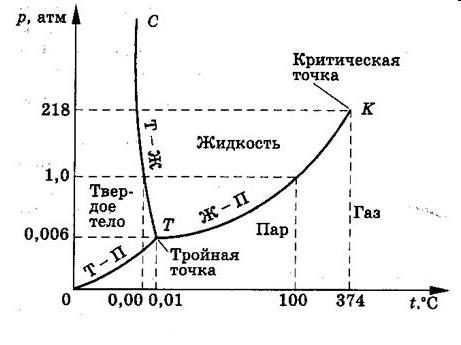 .
.
На рисунке приведена фазовая диаграмма для однокомпонентной системы (воды). По оси абсцисс откладывается температура, по оси ординат – давление. Буквой Т обозначена тройная точка, при которой существует одновременно три фазы (лед, жидкая вода и пар). Этой точке для воды соответствует температура 0,01оС и давление 0,06 атм. Линия 0–Т разграничивает твердое тело и пар – это кривая возгонки. Линия Т–К разграничивает жидкость и пар – это кривая кипения. Линия Т–С разграничивает жидкость и твердое тело – это кривая плавления.
Точка К называется критическая точка. Для воды она соответствует 218 атм. и 374оС. При таких параметрах свойства жидкости и пара, становятся одинаковыми, так что различие между жидким и парообразным состоянием исчезает.
