
- •Агрегатные состояния (лекция №1)
- •Газовые законы
- •Хроматография
- •Использование плазмы в медицине
- •Плазма используется в технике.
- •Структура воды
- •Роль воды в организме
- •Баланс воды в организме
- •Распределение воды в организме
- •Твердые тела
- •Кристаллические тела
- •Ионные решетки
- •Атомные решетки
- •Полиморфизм
- •Аллотропные модификации углерода
- •Металлическая решетка
- •Жидкие кристаллы
- •Фазовые переходы (Лекция №3)
- •Уравнение Клайперона – Клаузиса
- •Уравнение Трутона
- •Кипение
- •Плавление
- •Перекристаллизация из раствора
- •Экстракция
Агрегатные состояния (лекция №1)
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью сохранять объём и форму, наличием дальнего и ближнего порядка и другими. Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
Газ
Газ (франц. gaz, от греч. chaos хаос), агрегатное состояние вещества, в котором составляющие его атомы и молекулы почти свободно и хаотически движутся в промежутках между столкновениями, во время которых происходит резкое изменение характера их движения. Скорость движения молекул газа при комнатной температуре близка к скорости пули. Столкновения могут быть упругими и неупругими ( с изменением скорости движения).
Газообразное состояние вещества является распространенным состоянием вещества во Вселенной. Межзвездное вещество, туманности, атмосферы планет состоят из газов. Газы широко распространены в природе: они образуют атмосферу Земли, в значительных количествах содержатся в твердых земных породах, растворены в воде океанов, морей и рек. Встречающиеся в природных условиях газы представляют собой, как правило, смеси химически индивидуальных газов.
Газы равномерно заполняют доступное для них пространство и не сохраняют форму. В отличие от жидкостей и твердых тел, не образуют свободной поверхности. Газ характеризующееся очень слабыми связями между составляющими его частицами. Они оказывают давление на ограничивающую заполняемое ими пространство оболочку.
Плотность газов
при нормальном давлении в 1000 раз меньше
плотности жидкостей. В отличие от твердых
тел и жидкостей, объем газов существенно
зависит от давления и температуры.
Распределение молекул газа по скоростям
описывается уравнением Максвелла.
Графически зависимость представлены
на рисунке, где F(v)
– число молекул с данной скоростью.
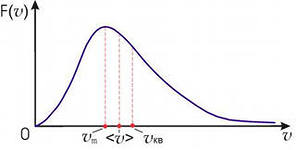
В области от 0 до vm находятся «холодные молекулы», а в области > vкв горячие молекулы большинство молекул газа имеют скорости близкие к средним. Внутренняя энергия идеального газа зависит только от его температуры. Внутренняя энергия одноатомного газа, имеющего 3 поступательные степени свободы и состоящего из N атомов, равна: Е = (3/2)kTN, где Т — абсолютная температура, а k — постоянная Больцмана k = R/NA = 1,38·10 Дж/град K , R - универсальная газовая постоянная, NA- число Авагадро.
Свойства большинства газов — прозрачность, бесцветность и легкость. По химическим свойствам газы и их смеси весьма разнообразны — от малоактивных инертных газов до взрывчатых газовых смесей.
Идеальный газ - газ, в котором взаимодействие между молекулами сводится к парным столкновениям, причём время межмолекулярного столкновения много меньше среднего времени между столкновениями. Идеальный газ является простейшим модельным объектом молекулярной физики. И полностью подчиняется газовым законам. Газы при нормальных условиях близки к идеальным. При повышении плотности газа и при снижении температуры его свойства перестают быть идеальными, Процессы столкновения начинают играть все большую роль и размерами молекул и их взаимодействия пренебречь уже нельзя. Такой газ называют реальным. В газовые законы для таких газов вносятся поправки.
