- •Оглавление
- •Исследование газовой коррозии металлов
- •Лабораторная работа 1
- •Лабораторная работа 2
- •Исследование коррозии металла на модели микроэлемента
- •Лабораторная работа 3
- •Исследование протекторной защиты металлов.
- •Экспериментальная часть
- •Список рекомендованной литературы
- •Потенциостат «элинс p-30s»
- •Потенциодинамический метод – снятие поляризационных кривых при различных скоростях развертки потенциала.
Исследование протекторной защиты металлов.
В качестве вспомогательного анода используется протектор – растворимый электрод с более отрицательным потенциалом, чем у анода коррозионного элемента.
Сначала потенциометром П измеряют потенциалы анода, катода и протектора при разомкнутых ключах Кл1 и Кл2, их потенциалы отождествляются с «равновесными» ЕравАн , ЕравКт , ЕравПр. Далее при полностью введенном сопротивлении магазина Rм1 замыкают ключ Кл1 и дожидаются установления постоянного тока коррозии, замеренного миллиамперметром (мА 1), после чего измеряют величины потенциалов анода ЕрабАн и катода ЕрабКт. Путем уменьшения сопротивления магазина Rм 1 устанавливают новую постоянную силу тока и измеряют рабочие потенциалы анода и катода до тех пор, пока сопротивление магазина Rм 1 не станет равным нулю. По полученным данным строят диаграмму коррозии, для чего необходимо не менее 5 ÷ 6 значений потенциалов и при определенных значениях тока коррозии на одной шкале миллиамперметра.
Измеряют величину "стационарного" потенциала протектора ЕравПр и записывает ее значение. Подключают магазин сопротивления Rм 2 поворотом ключа Кл 3 в правое положение. Включают Кл 2. В цепи протектора появляется ток, который показывает миллиамперметр (мА 2). В цепи коррозионного элемента ток уменьшается. Выждав некоторое время до установления постоянных значений тока, в обеих цепях замеряют потенциалы всех трех электродов ЕрабАн, ЕрабКт, ЕрабПр, записывают величины токов. Уменьшая сопротивление Rм 2, задают новое значение силы тока в цепи протектора и в коррозионном элементе. Вновь замеряют величины потенциалов при установившихся токах, и т.д. до тех пор, пока сила тока в коррозионном элементе не станет равной нулю, что соответствует отсутствию тока коррозии в моделируемом коррозионном элементе. Таких замеров должно быть 5÷6 при разных величинах тока в цепи протектора. Экспериментальные данные заносят в таблицу 1. Во время опытов ванночка должна стоять неподвижно, т.к. малейшее колебание раствора приводит к уменьшению поляризации электродов и соответственно изменяются все электрохимические параметры элемента.
Исследование электрохимической катодной защиты
Проводят путем катодной поляризации коррозионного элемента от внешнего источника постоянного тока (ИПТ) или от аккумуляторной батареи. Для более легкого установления постоянной величины катодного тока в цепь вспомогательного инертного электрода включает регулируемое высокоомное сопротивление или делитель напряжения Rм 2, позволяющий изменять величину тока от нуля до 150 мА. Вместо протектора устанавливают инертный вспомогательный электрод (графитовый или свинцовый).
Порядок выполнения работы. Сначала устанавливают постоянную величину тока в коррозионном элементе. Для этого при полностью введенном сопротивлении магазина Rм1 замыкают ключ Кл1 и постоянно уменьшают сопротивление магазина Rм 1 до нуля. Ключ Кл З перекидывают в левое положение, Кл 2 замыкают вновь. Задавая определенную постоянную величину катодного тока, замеряют установившуюся величину тока в элементе с одновременным замером электродных потенциалов ЕрабАн, и ЕрабКт до тex пор, пока сила тока в коррозионном элементе не станет равной нулю, всего не менее 5÷6 замеров. Равенство тока нулю в элементе свидетельствует о прекращении коррозии в элементе. При каждом замере записывают напряжение для каждой силы тока катодной защиты по вольтметру (V). По величине силы тока в коррозионном элементе можно рассчитать скорость коррозии металла анода К-вес Ан, а по величине тока в цепа протектора – скорость коррозии протектора К-вес Пр
, г/м2 ∙ час
где I – сила тока в элементе, А;
Sан – рабочая (смоченная электролитом)поверхность анода, см2;
АМе – атомный вес металла, г;
z – изменение валентности металла;
F – число Фарадея, 26,8 А· час/г-экв.
По скорости коррозии может быть рассчитан глубинный показатель коррозии П (проницаемость):
,мм/год,
где dМе – плотность металла, г/см.3
У![]() дельный
расход электроэнергии при катодной
защите с наложением внешнего тока
рассчитываем по формуле:
дельный
расход электроэнергии при катодной
защите с наложением внешнего тока
рассчитываем по формуле:
Степень протекторной защиты при каждой величине тока от протектора или от внешнего источника
![]()
Здесь Iкор. – сила тока коррозии при сопротивлении магазина Rм1 = 0; Iост. – остаточная сила тока коррозии при заданном токе от протектора или внешнего источника тока по (мА1).
Электрохимическая эффективность катодной и протекторной защиты рассчитывается по формуле
![]()
Jкорр., jвнешн., jост. – плотности тока соответственно: коррозии, на протекторе (внешней катодной защиты), остаточной плотности коррозионного тока при данной плотности тока протектора или от внешнего источника тока, А/см2.
Теоретическое смещение потенциала конструкции под действием катодной поляризации
![]()
Экспериментальные и расчетные данные приводятся в сводных таблицах, примерная форма которых дается ниже.
Таблица 1
Исследование протекторной защиты на модели гальванического элемента
Коррозионный элемент (………… ). Протектор – ………….
Электролит……..…; Sрабан = ………см2; Sрабкт =………см2;
Межэлектродное расстояние……………………см.
Сила тока, мА |
Потенциал (по цинку), В |
Параметры защиты |
||||||
В корр. элементе |
На про-текторе |
Еан |
Ект |
Епр |
Р % |
Э % |
Δ E, В |
|
Эксп. |
Теор. |
|||||||
0 |
0 |
|
|
|
|
|
|
|
I1 |
0 |
|
|
|
|
|
|
|
I2 |
0 |
|
|
|
|
|
|
|
и.т.д. |
|
|
|
|
|
|
|
|
In |
0 |
|
|
|
|
|
|
|
С протектором |
|
|
|
|
|
|
|
|
Iк1 |
I1 |
|
|
|
|
|
|
|
Iк2 |
I2 |
|
|
|
|
|
|
|
и.т.д. |
|
|
|
|
|
|
|
|
0 |
In |
|
|
|
|
|
|
|
Защита внешним током |
|
|
|
|
|
|
|
|
Iк1 |
I1 |
|
|
|
|
|
|
|
По данным измерений построить коррозионную диаграмму, нанести на оси ординат потенциал по цинковому электроду (начало кривых из рассчитанных по уравнению Нернста или определенных по диаграмме Пурбэ обратимых потенциалов), а на оси абсцисс – величину тока (на одной диаграмме построить изменение потенциалов при протекторной защите, на другой при защите внешним током)
Таблица 2.
Параметры протекторной защиты
Сила тока, мА |
Скорость коррозии анода, К-вес Ан, г/м2час |
Расход протектора, анода, К-вес Пр кг/м2год |
Скорость разрушения протектора П, мм/год |
|
в гальваническом элементе |
на протекторе |
|||
|
|
|
|
|
Таблица 3
Параметры электрохимической катодной защиты
Сила тока, мА |
Скорость коррозии анода К-вес Ан, г/м2час |
Напряжение, В |
Удельный расход эл. энергии W, кВтчас/годм2 |
|
в гальваническом элементе |
на инертный анод |
|||
|
|
|
|
|
Отчет по работе должен состоять из введения, методики эксперимента, экспериментальных результатов, обсуждения результатов и списка использованной литературы.
ВАРИАНТ «Б» – для студентов металлургических специальностей.
Экспериментальная часть
|
Ан – анод, Кт – катод, Пр – протектор, Кл 1– электрический ключ цепи микоэлемента Кл 2 – электрический ключ цепи протектора Rм 1 и Rм 2 – магазины сопротивлений мА1 и мА 2 – миллиамперметры |
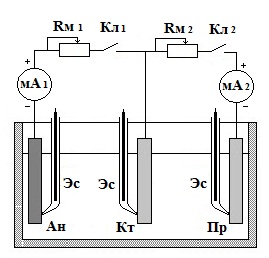
Рис. 2. Электрическая схема протекторной защиты.
До начала работы тщательно обработать наждачной бумагой электроды элемента и вспомогательный анод, с тем чтобы удалить с их поверхности оксидные пленки (замерить рабочие поверхности электродов). Затем электроды обезжирить протиркой влажной содой, промыть водой, установить в элемент, залитый заданным раствором. В первой части опыта в качестве вспомогательного анода использовать протектор - растворимый электрод с более отрицательным потенциалом, чем у анода элемента. Электрическая схема опыта приведена на рис.2.
Замыкают ключ Кл1, ключ Кл2 разомкнут. После 35 минут выдержки отмечают силу тока, проходящего через миллиамперметр (мА 1). Затем при полностью включенном магазине сопротивлений Rм 1 замыкают ключ Кл2 и, уменьшая сопротивление, добиваются отсутствия тока в цепи элемента (по миллиамперметру мА 1). По достижении этого отмечают величину протекающего тока в цепи протектора (по миллиамперметру мА 2).
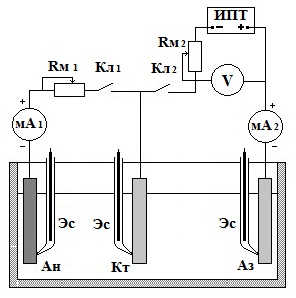
После окончания первого этапа опыта заменяют электрод – протектор не инертный электрод и изменяют схему опыта для проведения исследования катодной защиты с наложением внешнего тока (рис.3).
Первоначально определяют интенсивность работы гальванопары Ан – Кт. Затем замыкают ключ Кл.2 и включают внешний источник постоянного тока. Постепенно, увеличивая подаваемое напряжение, уменьшая сопротивление магазина Rм 2, добиваются отсутствия тока в миллиамперметре мА l. Записать протекающую при этом силу тока в цепи катодной защиты (по миллиамперметру мА 2) и напряжения между электродами Кт – Аз. Равенство тока нулю в элементе свидетельствует о прекращении коррозии.
|
Ан – анод, Кт – катод, Аз – анод внешней защиты (инертный электрод), Кл 1– электрический ключ цепи микоэлемента Кл 2 – электрический ключ цепи протектора Rм 1 и Rм 2 – магазины сопротивлений мА1 и мА 2 – миллиамперметры ИПТ – источник постоянного тока, V - вольтметр |
Рис. 3. Электрическая схема защиты с наложением внешнего катодного тока
По величине силы тока в коррозионном элементе можно рассчитать скорость коррозии металла анода К-вес Ан, а по величине тока в цепа протектора – скорость коррозии протектора К-вес Пр
, г/м2 ∙ час
где I – сила тока в элементе, А;
Sан – рабочая (смоченная электролитом)поверхность анода, см2;
АМе – атомный вес металла, г;
z – изменение валентности металла;
F – число Фарадея, 26,8 А· час/г-экв.
По скорости коррозии может быть рассчитан глубинный показатель коррозии П (проницаемость):
, мм/год,
где dМе – плотность металла, г/см.3
У![]() дельный
расход электроэнергии при катодной
защите с наложением внешнего тока
рассчитываем по формуле:
дельный
расход электроэнергии при катодной
защите с наложением внешнего тока
рассчитываем по формуле:
Степень протекторной защиты при каждой величине тока от протектора или от внешнего источника
![]()
Здесь Iкор. – сила тока коррозии при Rv 1 = 0; Iост. – остаточная сила тока коррозии при данном токе от протектора или внешнего источника тока по (мА1).
Электрохимическая эффективность катодной и протекторной защиты рассчитывается по формуле
![]()
Jкорр., jвнешн., jост. – плотности тока соответственно: коррозии, на протекторе (внешней катодной защиты), остаточной плотности коррозионного тока при данной плотности тока протектора или от внешнего источника тока, А/см2.
Таблица 4.
Исследование протекторной защиты на модели гальванического элемента
Коррозионный элемент (………… ). Протектор – ………….
Электролит……..…; Sрабан = ………см2; Sрабкт =………см2;
Межэлектродное расстояние……………………см.
Сила тока, мА |
Скорость коррозии анода, К-вес Ан, г/м2час |
Расход протектора, анода, К-вес Пр кг/м2год |
Скорость разрушения протектора П, мм/год |
|
в гальваничес-ком элементе |
на протекторе |
|||
|
|
|
|
|
Таблица 5
Исследование электрохимической катодной защиты
Сила тока, мА |
Скорость коррозии анода, К-вес Ан г/м2час |
Напряжение, В |
Удельный расход эл. энергии W, кВтчас/годм2 |
|
в гальваническом элементе |
на инертный анод |
|||
|
|
|
|
|
Отчет по работе должен состоять из введения, методики эксперимента, экспериментальных результатов, обсуждения результатов, выводов и списка использованной литературы.
Литература
1. Томашов Н. Д. «Теория коррозии и защиты металлов». Академизлит, М„ 1960.
2. Жук Н. П. «Курс коррозии и защиты металлов». Металлургия. М.. 1968
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. Как изменится локальный ток коррозии двухэлектродной системы при подключении дополнительного макроанода? (Дать диаграмму коррозии).
2. При каких условиях достигается полная электрохимическая защита?
3. Докажите графически, что ток внешней катодной поляризации в большинстве случаев больше, иногда равен, но никогда не меньше тока коррозии.
4. Каким требованиям должен удовлетворять протектор?
5. Докажите графически, что коррозионный процесс, имеющий большую катодную поляризуемость, будет иметь больший защитный эффект при одинаковой величине катодного тока внешней поляризации?
6. В каких случаях полная электрохимическая защита становится экономически невыгодной и когда она практически недостижима?
7. Что такое перезащита и чем она вызвана?
8. Каков физический смысл коэффициента защитного эффекта?
9. Каков физический смысл понятия «радиус действия»
протектора?
10. Сокращаются ли суммарные потери металла в случае
защиты протектором?
11.Напишите реакцию, протекающую на электродах в Вашем случае коррозионных испытаний.
12. Какие материалы могут использоваться в качестве анода при катодной электрохимической защите?
13.Как будет меняться локальный ток коррозии двухэлектродной системы при внешней катодной поляризации? (Пояснить на коррозионной диаграмме).
14. Дать сравнительную характеристику катодной электрохимической и протекторной защит?
ИСПЫТАНИЯ ХРОМОНИКЕЛЕВЫХ СПЛАВОВ НА СКЛОННОСТЬ К МЕЖКРИСТАЛЛИТНОЙ КОРРОЗИИ
Лабораторная работа № 6
Межкристаллитная коррозия, вызывающая избирательное разрушение по границам кристаллитов, приводит к снижению или полной потере прочности и пластичности металлов. Этот вид коррозии наблюдается в газовых средах и растворах электролитов. Появление межкристаллитной коррозии в электролитах чаще всего связано с электрохимической неоднородностью сплавов. Неоднородность сплавов является следствием распада некоторых твердых растворов в определенных условиях с выделением вторичных фаз, которые могут быть либо анодами, либо катодами по отношению к близлежащим участкам твердого раствора.
Особый интерес представляет межкристаллитная коррозия хромоникелевых сталей. Склонность к межкристаллитной коррозии хромоникелевых аустенитных сталей возникает в результате определенной термической обработки при неблагоприятных химическом и фазовом составе сплава. Склонность к межкристаллитной коррозии этих сталей объясняется обеднением хромом твердого раствора вблизи границ зерен из – за выделения на поверхности кристаллитов карбидов хрома. Однако сам факт выделения карбидов хрома по границам зерен не мог бы вызвать обеднение сплава хромом, если бы скорости диффузии углерода и хрома были одинаковы. Высокая скорость диффузии углерода и низкая скорость диффузии хрома, вследствие чего в образовании карбидов участвует почти весь углерод сплава, а хром только из пограничной зоны. Стали с большим содержанием углерода должны быть более восприимчивы к появлению склонности к межкристаллитной коррозии.
На основе экспериментальных исследований в последние годы считают, что максимальное содержание углерода, не вызывающее появление у стали склонности к межкристаллитной коррозии, равно 0,007%.
Большое влияние на склонность хромоникелевых сталей к межкристаллитной коррозии оказывает длительность выдержки стали при температурах, вызывающих эту склонность (600 ÷ 650 0С). При правильном режиме термической обработки хромоникелевых сталей, при температуре 1080 ÷ 1150 0С углерод и хром переходит из карбидной фазы в твердый раствор аустенита, содержание этих компонентов выравнивается по всему объему зерна. При достаточно быстром фиксировании этого состояния (охлаждение в воде) достигается однородность твердого раствора и исключается вероятность появления у стали склонности к межкристаллитной коррозии.
Существующие методы определения склонности сплавов к межкристаллитной коррозии можно подразделить на химические, физические и электрохимические.
Один из способов электрохимического метода – анодное травление испытуемого образца в растворе серной кислоты с добавкой уротропина или другого замедлителя коррозии. Метод анодного травления, заключающийся в анодной поляризации исследуемого участка поверхности стали, обладает тем достоинством, что позволяет быстро определить склонность стали к межкристаллитной коррозии непосредственно на полуфабрикатах и готовых сварных изделиях.
Применение этого метода дает возможность производить межоперационную проверку склонности металла к межкристаллитной коррозии и соответствующей термической обработкой устранить эту склонность.
Цель работы:
Определение склонности хромистоникелевой стали к межкристаллитной коррозии, устранение или проявление её путем соответствующей термической обработки.
Экспериментальная часть
По заданию преподавателя получить образец хромистоникелевой стали. Образец должен быть шлифованным и отполирован, не иметь на поверхности язв, раковин и грубых изъянов.
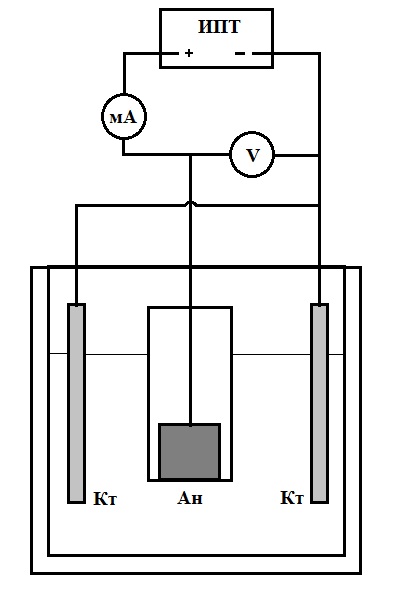
В стеклянный стакан наливают раствор H2SO4, 60% концентрации, содержащей 0,5% уротропина, закрывают крышкой с закрепленными свинцовыми катодами. Температура комнатная. Собирают электрическую схему (рис.1).
|
Ан – анод – исследуемый электрод, Кт – свинцовые катоды, ИПТ – источник постоянного тока, V – вольтметр, мА – миллиамперметр. |
Рисунок 1. Электрическая схема установки
На образце отмечают, можно карандашом, участок, который будет погружен в раствор кислоты и замеряют его поверхность (см2). Рассчитывают силу тока, которую необходимо подать на образец. Плотность анодного тока при этом должна быть равна 0,65 А/см2. Образец помещают в раствор кислоты и присоединяют его к положительному полюсу источника постоянного тока, включают ток и ведут электролиз в течение 5 минут, замеряя напряжение между анодом и катодом. Затем образец вынимают и тщательно промывают водой, протирают и высушивают фильтровальной бумагой, затем помещают на столик микроскопа для визуального осмотра.

Рисунок 2 Снимок поверхности хромоникелевой стали после анодного травления, склонной к межкристаллитной коррозии
В случае наличия склонности стали к межкристаллитной коррозии при увеличении не менее х20 ÷ хЗ0 видна непрерывная сетка протравленных границ зерен. С помощью средств визуализации изображения (фото-видеокамеры) записывают в память компьютера кристаллическое строение поверхности образца (рисунок 2). При наличии межкристаллитной коррозии образца проводят термическую обработку в муфельной печи при температуре 1080-1150°С в течение 25÷30 минут, затем быстро охлаждают (окунанием в емкость с водой) и вновь проводят анодное травление как описано выше. После закаливания склонность к межкристаллитной коррозии должна уменьшиться или полностью исчезнуть.
По проделанной работе пишется отчет.
Литература
1. Клинов И. Я. «Коррозия химической аппаратуры и коррозионно-стойкие материалы». Машиностроение. М., 1967.
2. Романов В. В. «Методы исследования коррозии металлов», изд-во. «Металлургия», Москва, 1965.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. В чем заключается эффект воздействия МКК на сталь?
2. Какие теории существуют для объяснения появления у легированных хромом сталей склонности к межкристаллитному разрушению?
3. Какая из теорий является общепринятой и в чем она заключается?
4. Почему межкристаллитная коррозия хромоникелевых сталей наблюдается после некоторой выдержки её в температурной зоне 400-800°С?
5. В чем выражается взаимосвязь между склонностью к МКК нержавеющей стали и содержанием хрома в ней?
6. От чего зависит температурный режим, при котором наблюдается максимальная склонность нержавеющей стали к межкристаллитной коррозии?
7. Каковы методы предотвращения склонности стали к межкристаллитной коррозии?
8. Почему при понижении содержания углерода в стали склонность к МКК уменьшается?
9. В чем заключается предупреждение МКК путем закалки изделий?
10. Продолжительный отпуск стали при t =750-900°С как метод предупреждения МКК.
11. В чем заключается легирование сталей, проводимое с целью защиты от МКК?
12. Борьба с МКК путем воздействия на агрессивную среду.
13.Какие существуют методы испытания на склонность к межкристаллитной коррозии и в чем они заключаются?
УСКОРЕННЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ УСТОЙЧИВОСТИ НЕРЖАВЕЮЩИХ СТАЛЕЙ К МЕЖКРИСТАЛЛИТНОЙ КОРРОЗИИ
Лабораторная работа № 7
Межкристаллитная коррозия (МКК) относится к наиболее опасным видам местной коррозии, приводящим к значительному снижению механической прочности металла. Основной причиной МКК нержавеющих сталей является обеднение хромом приграничных зон зерен кристаллитов за счет связывания его при выделении вторичных фаз - карбидов хрома, σ – фазы и других.
В настоящее время устойчивость к МКК определяется: для сталей типа XI8HI0T после кипячения образцов в течение 15 ÷ 24 часов, а более коррозионностойкой стали 0Х23Н28ИЗДЗТ (ЭИ–943) – 144 часа в серно-кислом растворе медного купороса (ГОСТ 6032–58; метод AM и метод В). Разработанный метод определения устойчивости сталей к МКК, заключающийся в потенциостатическом травлении с последующим металлографическим исследованием полированных образцов, более трудоемок.
Электрохимические исследования поведения сталей показывают, что потенциодинамические анодные кривые сталей, склонных и несклонных к МКК, различаются значениями потенциалов и токов в области перехода от активного состояния к пассивному. Значительно лучше эти различия проявляются на кривых обратного тока.
Стали типа XI8HI0T, склонные к МКК, активируются при обратном ходе анодной кривой в области потенциалов от + 0,28 до – 0,1 В, в то время как не склонные – не активируются и анодный ток у них постоянно уменьшается, постепенно переходя в катодную область, вследствие электрохимического превращения анодных продуктов (рис.1).
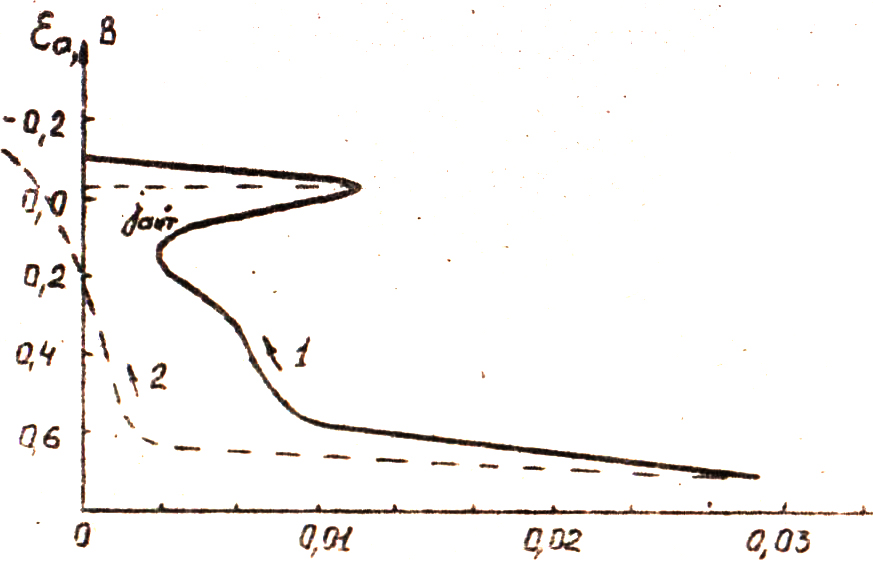
Рис. 1. Анодная поляризационная кривая для стали.
1 – склонная к МКК; 2 – не склонная.
Эти зависимости и были положены в основу потенциодинамического метода определения склонности стали к МКК, позволяющего уменьшить время определения до 3 ÷ 8 мин.
На основании этого метода критерием склонности стали к МКК необходимо считать наличие петли анодного тока при обратном ходе. Между глубиной МКК сталей и плотностью тока их активации jакт (рис.1) наблюдается симбатная зависимость. Большим величинам плотности токаобычно соответствует меньшая стойкость стали в этой среде к МКК.
Цель работы
Определение стойкости к МКК аустенитных нержавеющих сталей и влияние на нее операции термообработки.