- •Оглавление
- •Исследование газовой коррозии металлов
- •Лабораторная работа 1
- •Лабораторная работа 2
- •Исследование коррозии металла на модели микроэлемента
- •Лабораторная работа 3
- •Исследование протекторной защиты металлов.
- •Экспериментальная часть
- •Список рекомендованной литературы
- •Потенциостат «элинс p-30s»
- •Потенциодинамический метод – снятие поляризационных кривых при различных скоростях развертки потенциала.
Лабораторная работа 2
У металлов с более отрицательным потенциалом, чем у водородного электрода в той же коррозионной среде, процесс коррозии может протекать по двум механизмам: с водородной деполяризацией и с кислородной деполяризацией. При низкой скорости подачи кислорода и высокой коррозионной активности среды долей последнего процесса можно пренебречь. В этом случае скорость коррозии металла может быть рассчитана по объёму выделившегося водорода, который, учитывая эквивалент массе разрушющегося металла в этой реакции.
Me + 2H+ → Me2+ + H2,
где Me – корродирующий металл.
Эта реакция имеет электрохимический характер и её интенсивность определяется степенью затруднения работы микрогальванопар, образующихся на поверхности корродирующего металла. В простейшем виде эту микрогальванопару можно представить как Ме |электролит| Н2 (Ме'), где Me' — примесь – инородный металла. В зависимости от легкости протекания анодного процесса окисления металла (например, ионизация металла Me - 2е → Ме2+ ) или катодного процесса выделения водорода, который в зависимости от кислотности электролита может протекать по реакциям:
в кислой среде 2Н+ + 2е → Н2 Е0= 0 В;
в нейтральной и щелочной 2 H2O + 2 e → H2 + 2 OH- E0= – 0,828 B.
Процесс коррозии может подразделяться на коррозию с катодным или анодным контролем (при высоком электрическом сопротивлении электролита может наблюдаться «омический» контроль процесса). Поэтому наиболее эффективное воздействие на скорость коррозии металла можно оказать, изменяя интенсивность протекания того электродного процесса, который определяет скорость коррозии. Вещества, замедляющие скорость коррозии металла, носят название ингибиторов. По влиянию на тот или иной электродный процесс они подразделяются на катодные и анодные ингибиторы.
Определение скорости коррозии металла по количеству выделившегося водорода во много раз точнее, чем весовой метод. Подобным способом удается снять кинетику коррозии во времени. Однако этот способ не может быть использован при наличии кислородной деполяризации и для металлов с более положительным потенциалом, чем у водородного электрода. Коррозионная устойчивость металла не может быть оценена по выделению водорода в случае межкристаллитной коррозии.
Присоединение к корродирующему металлу другого металла изменит локальную и общую скорость коррозии, так как изменяется поляризация электродных процессов. Когда присоединяется металл, имеющий более отрицательный потенциал, чем потенциал корродирующего металла, последний поляризуется катодно. По этой причине можно ожидать некоторого уменьшения локальной скорости коррозии на испытуемом образце. Снижение скорости коррозии будет зависеть от поляризуемости катодного процесса выделения водорода: при большей поляризуемости произойдет более заметное уменьшение скорости локальной коррозии (положительный защитный эффект). Если присоединяется металл, имеющий более положительный потенциал (при отсутствии на испытуемых образцах оксидных пленок), в средах неокисляющих кислот можно ожидать снижения локальной коррозии (положительный разностный «дифференц» эффект).
В большинстве случаев суммарная скорость коррозии будет больше (потери металла в грамм-эквивалентах возрастут).
Цель работы
Определить локальную и общую скорость коррозии металла и его глубинный показатель коррозии (проницаемость) в зависимости от контакта с ним некоторых металлов или других факторов (по заданию руководителя).
Экспериментальная часть
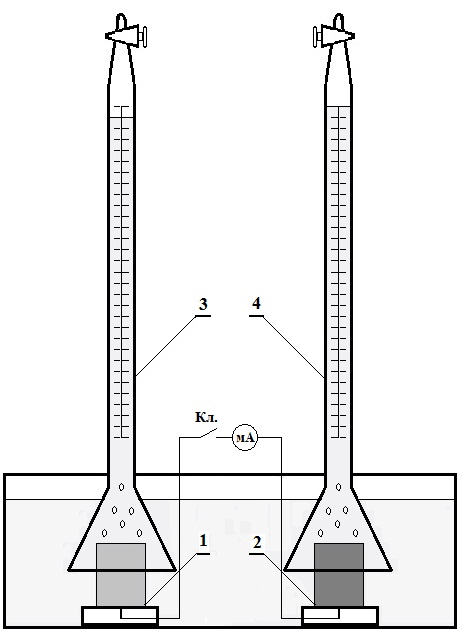
Прибор для определения скорости коррозии го выделению водорода представляет собой эвдиометр (в простейшем случае две перевернутые бюретки), заполненные раствором, находящимся в сосуде, под которые в нижней части помещены образцы, под одну – испытуемый 1, под другую - контактирующим с ним 2 (рис.1).
|
1 – исследуемый металл 2 – контактирующий металл 3 бюретка для сбора водорода при коррозии исследуемого металла 4 – бюретка для сбора водорода с контактирующего металла мА – амперметр, для определения силы тока между исследуемым и контактирующими металлами Кл. – электрический ключ замыкания металлов. |
Рис. 1 Установка для определения скорости коррозии металла
по объему выделившегося водорода
Образцы 1 и 2 плоские пластинки с изолированным токоподводом. До начала опыта замерить полную поверхность обоих образцов, обезжирить их, промыть, протравить в растворе HCl (I : I) и вновь тщательно промыть. Поместить образцы под бюретки (образцы должны находиться в вертикальном положении), залить раствор в соcуд и заполнить бюретки, пользуясь резиновой грушей. Записать уровень электролита в каждой бюретке и тотчас же включить секундомер для отсчета времени опыта. Затем произвести замеры уровня заполнения бюреток водородом (в бюретке над образцом 2 выделения водорода может не быть. Ключ Кл. должен быть разомкнут. Длительность и периодичность ведения опыта зависит от скорости заполнения бюретки водородом и задается преподавателем. Записать температуру воздуха и атмосферное давление в помещении.
Вторая часть работы заключается в том, что замыкается ключ при полностью заполненных раствором бюретках и вновь снимается уровни заполнения обеих бюреток водородом. Записывается сила тока коррозии в миллиамперах на постоянном диапазоне шкалы миллиамперметра. Объемы выделившегося водорода за каждый промежуток времени приводится к нормальным условиям, пользуясь уравнением Менделеева–Клайперона:
![]() мл,
(1)
мл,
(1)
где Vt – объем выделившегося водорода за промежуток времени при условиях ведения опыта, мл;
Р – атмосферное давление, мм рт. ст.;
ω – парциальное давление водяных паров над раствором при условиях опыта, мм рт. ст. (Справочник химика);
t – температура, 0С.
Объем выделившегося водорода на контактирующем металле (приведенный к нормальным условиям) может быть рассчитан по закону Фарадея:
![]()
![]() ,
мл (2)
,
мл (2)
где I – сила тока, А;
Δτ =(τn – τn-1) – время контакта образца с коррозионной средой, за период от предыдущего измерения, час;
qV – объемный электрохимический эквивалент водорода, см3/А·час.
Затем следует сложить объемы выделившегося водорода за каждые промежутки времени.
Учитывая, что при растворении одного грамм-эквивалента металла выделяется в нормальных условиях 11,2 л водорода, определяем количество растворенного металла g
![]() ,
г
(3)
,
г
(3)
где А – атомный вес металла;
z – изменение его валентности.
Тогда скорость коррозии
![]() ,г/м2
∙
час (4)
,г/м2
∙
час (4)
где S – поверхность обоих сторон образца, м2;
τ – время опыта, час.
Глубинный показатель коррозии П (проницаемость)
![]() ,
мм/год (5)
,
мм/год (5)
где dMe — плотность металла, г/см3.
По рассчитанному глубинному показателю коррозии определить группу и балл стойкости металла в данной коррозионной среде.
Экспериментальные и расчётные данные приводят в сводных таблицах, примерная форма которых дается ниже.
Таблица 1
Экспериментальные данные по кинетике выделения водорода при коррозии ………… образцов
Раствор.........................; Давление.................мм.рт.ст.; Температура ...............0С; Поверхность образцов: исследуемого............см2, контактирующего.................см2
Металл образцов |
Наличие контакта |
Время с начала опыта, (периоды времени измерений по заданию преподавателя), мин |
|||
И / К |
|
15 |
30 |
45 |
и.т.д. |
|
|
Объем выделившегося водорода, мл |
|||
|
нет |
|
|
|
|
|
есть |
|
|
|
|
|
Сила тока, мА |
||||
|
есть |
|
|
|
|
Примечание: Над чертой – экспериментально определенный объём водорода Vt; под чертой – приведенный к нормальным условиям V0.
Таблица 2
Коррозионные характеристики ……… образцов
№№ образцов |
Характе-ристика опыта |
Общее время опыта, мин. |
V0, мл
|
g, г
|
К-вес., г/м2∙час
|
П. мм/год
|
Группа и балл стойкости |
|
|
|
|
|
|
|
|
Графически выражается зависимость объёма выделившегося водорода, приведенного к нормальным условиям (отнесенного к единице поверхности и времени) V0 – τ или скорости коррозии К-вес. – τ от времени процесса.
Исходя из теории водородного перенапряжения на многофазных электродах, зависимость между содержанием примесей ионов металла в электролите, осаждающихся на исследуемом металле и скоростью саморастворения электрода выражается эмпирическим уравнением
![]() (6)
(6)
где V – объем водорода выделившегося на чистом свинце;
VМе – объем водорода выделившегося на свинце с осажденным металлом – примеси;
aPb и aМе – постоянные в уравнении Тафеля для свинца и металла примеси;
Величина увеличения поверхности (катода) за счет осаждения примесного металла
![]() (7)
(7)
где dMeи dPb – плотности металлов;
mMe и mPb – массы металлов;
![]() (8)
(8)
Где СМе – концентрация ионов примесного металла в электролите, г/дм3;
Vэл – объем электролита, дм3
Объем электролита в свинцовом кислотном аккумуляторе Vэл≈ 10-2·Q,
где Q, А· час – электрическая емкость аккумулятора, может быть рассчитана
Q = 0,26 · Кисп · mPb,
0,26 А·час/г – электрохимический эквивалент Pb в электрохимической реакции Pb →PbSO4;
Кисп – коэффициент использования свинца при разряде, Кисп≈ 0,5.
Уравнение (7) справедливо при S << 1.
Тогда
![]() (9)
(9)
Подставим выражение (9) в уравнение (7), а полученный результат в уравнение (6), и, решая относительно СМе, получим
![]() (10)
(10)
Это уравнение устанавливает связь между относительным возрастанием скорости газовыделения (саморазряда) и содержанием в электролите примесных ионов металлов, осаждающихся на электроде.
Отчёт по работе должен состоять из введения, методики эксперимента, экспериментальных результатов, обсуждения результатов, выводов и списка использованной литературы.
Литература
1. Томашов Н.Д. «Теория коррозии и защиты металлов». Академиздат, М., 1960.
2. Toмашов Н. Д. и др, «Лабораторные работы по коррозии и защите металлов». «Металлургия» М. 1971
3. Жук Н. П. «Курс коррозии и защиты металлов» «Металлургия».М.,1968.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. Что такое объемный показатель коррозии, как он вычисляется и каков его физический смысл?
2. Как пересчитать объемный показатель коррозии в отрицательный весовой и глубинный?
3. Почему различные металлы в растворе кислоты одной и той же концентрации корродируют с различной скоростью?
4.Как изменится стационарный потенциал и скорость коррозии стального образца при увеличении концентрации соляной кислоты? Дать подробное объяснение.
5. Как влияет па скорость коррозии контакт образца с металлом, имеющим потенциал более положительный, в другом случае - более отрицательный?
6. Какие знаете способы подавления коррозии с водородной деляризацией?
7. Каковы особенности процесса коррозии с водородной деляризацией?
8. В каких случаях возможен процесс коррозии с выделением водорода с термодинамической и кинетической точек зрения?
9. Как будет меняться скорость коррозии и стационарный потенциал стального образца во времени при растворении его в ограниченном объеме раствора соляной кислоты?
10. Влияет ли скорость движения электролита на скорость коррозии с водородной деполяризацией?