- •Оглавление
- •Исследование газовой коррозии металлов
- •Лабораторная работа 1
- •Лабораторная работа 2
- •Исследование коррозии металла на модели микроэлемента
- •Лабораторная работа 3
- •Исследование протекторной защиты металлов.
- •Экспериментальная часть
- •Список рекомендованной литературы
- •Потенциостат «элинс p-30s»
- •Потенциодинамический метод – снятие поляризационных кривых при различных скоростях развертки потенциала.
Министерство образования и науки российской федерации
федеральное государственное бюджетное
образовательное учреждение
высшего профессионального образования
«нижегородский государственный технический
университет им. Р.Е.АЛЕКСЕЕВА»
Кафедра «Технология электрохимических производств»
лабораторный практикум
по курсу
«Коррозия и защита металлов от коррозии»
Методическое руководство для студентов, обучающихся
по направлению 240100 – «химическая технология»
Нижний Новгород 2012
УДК 669: 620.193.013
ББК 35.35+24.57
Л 125
Авторы: В.А. Козырин, А.А. Бачаев, В.В. Бакаев
Л 125 Лабораторный практикум по коррозии и защите металлов: методическое руководство к лабораторным работам / В.А. Козырин, А.А. Бачаев, В.В. Бакаев ; НГТУ им. Р. Е. Алексеева. – Нижний Новгород, 2012.- 47 с.
ISBN 978-5-93272-961-8
Изложены теоретическое введение для выполнения работы, методика эксперимента. Приведены схемы установок и даны рекомендации по выполнению лабораторных работ, оформлению экспериментальной части и обсуждения полученных результатов. К каждой работе даны вопросы для самопроверки. Приведен обширный список рекомендованной литературы.
Предназначена для студентов, обучающихся по направлению
240100 - «Химическая технология».
Рис.21. Табл.11 . Библиогр.: 20 назв.
УДК 669: 620.193.013
ББК 335.35+24.57
ISBN 978-5-93272-961-8
Нижегородский государственный
технический университет
им. Р.Е.Алексеева, 2012
Оглавление
Лабораторная работа 1 ………………………………….
Лабораторная работа 2 ………………………………........
Лабораторная работа 3 …………………………………….
Лабораторная работа 4 …………………………………….
Лабораторная работа 5 …………………………………….
Лабораторная работа 6 ……………...…………………….
Лабораторная работа 7 ……………………………………
|
4
10
16
20
24
33
36
39
40
|
Исследование газовой коррозии металлов
Лабораторная работа 1
Газовая коррозия — это химическая коррозия металлов в газах. Её отличительным признаком является то, что она протекает при отсутствии конденсации жидкости из коррозионной среды на корродирующей поверхности. Особенность в том, что она чаще всего имеет место при повышенных температурах.
Как и в любом случае коррозионного процесса, протекающего по химическому механизму, газовая коррозия представляет собой гетерогенную реакцию, на скорость и протекание которой оказывает значительное влияние плёнка продуктов коррозии, образующихся па корродирующей поверхности. Термодинамически возможность протекания химической коррозии может быть определена по изменению изобарно-изотермического потенциала ΔG химической реакции, лежащей в основе коррозионного процесса. Если ΔG > 0, то реакция не идёт, коррозии нет; если ΔG < 0 то реакция идёт, коррозия есть. Применительно к процессу окисления металлов о возможности протекания коррозионного процесса можно судить по парциальному давлению кислорода Ρо2 в коррозионной среде и давлению диссоциации образующихся продуктов коррозии Ρпк. Если Ρпк > Ρо2 — процесс коррозии не идет; если Ρпк < Ρо2 — процесс коррозии идёт.
Если плёнка продуктов коррозии, образующаяся на корродирующей поверхности несплошная, то она не препятствует доступу коррозионного агента к корродирующей поверхности; скорость коррозии в этом случае равна скорости реакции, лежащей в основе коррозионного процесса. В этом случае плёнка продуктов коррозии не обладает защитными свойствами.
Одним из условий образования сплошных плёнок продуктов коррозии, обладающих защитными свойствами, является соблюдение условия Vпк / Vмe >1 , где Vпк - объем продуктов коррозии, образовавшихся на данной корродирующей поверхности за счёт разрушения объёма металла Vмe. Это условие является необходимым, но не определяющим образование плёнок продуктов коррозии с высокими защитными свойствами. Для того чтобы плёнка продуктов коррозии обладала высокими защитными свойствами, она, кроме сплошности, должна иметь высокую механическую прочность (не разрушаться от возникающих в ней процессов роста механических напряжений), не должна образовывать легкоплавких сплавов с материалом, за счёт которого она образуется, должна иметь высокое омическое сопротивление.
Если плёнка продуктов на корродирующей поверхности сплошная, то скорость коррозии не равна скорости химической реакции, лежащей в основе коррозионного процесса, а меньше её. Это происходит вследствие замедления транспорта коррозионного агента и корродирующего материала в зону роста плёнки. Чем плотнее плёнка – тем больше это замедление и меньше скорость коррозии. Поскольку транспорт веществ в зону роста плёнки осуществляется за счёт процессов диффузии, все факторы, замедляющие диффузию в плёнке продуктов коррозии, будут замедлять рост плёнки и снижать скорость коррозионного процесса.
Ориентировочно все металлы по характеру их окисления можно подразделить на три группы: щелочные и щелочно-земельные, для которых наблюдается прямолинейная зависимость между толщиной плёнки (количеством прокорродировавшего материала) и временем коррозии; медь и металлы группы железа, для которых в этом случае характерна параболическая зависимость и такие металлы, как алюминий, титан, хром, цинк и другие, для которых вышеупомянутая зависимость имеет логарифмический характер. Изменение условий, в которых протекает коррозионный процесс, может приводить к перестановкам отдельных металлов из группы в группу, но для всех металлов суммарная кривая окисления будет иметь один и тот же характер (рис. 1). На начальном участке, когда толщина плёнки оксидов мала и сама плёнка не оказывает влияния на скорость диффузии кислорода и корродирующего материала в зону роста плёнки, окисление идет по закону прямой линии. По мере утолщения плёнки зависимость становится всё более сложной, и рост плёнки в толщину подчиняется закону параболы, с утолщением плёнки и её уплотнением процессы диффузии в ней замедляются. И, наконец, когда плёнка значительно уплотняется, торможение процессов диффузии становится очень сильным, рост пленки в толщину подчиняется логарифмическому закону. Длительность, протяженность участков линейного, параболического и логарифмического роста плёнки продуктов коррозии зависит от термодинамических свойств металла и условий, в которых протекает коррозионный процесс. Для разных металлов и сплавов она различна.
Так как при химической коррозии её продукты образуются непосредственно в месте контакта (в зоне реакции) корродирующего материала с коррозионной средой, процесс газовой коррозии можно исследовать, наблюдая изменение положительного весового показателя коррозии образца во времени. Так как положительный весовой показатель коррозии — это прирост веса образца, отнесенный к единице поверхности корродирующего металла и единице времени, можно исследовать процессы химической коррозии, наблюдая изменение веса образца заданных размеров при воздействии на него коррозионной среды в заданных условиях.
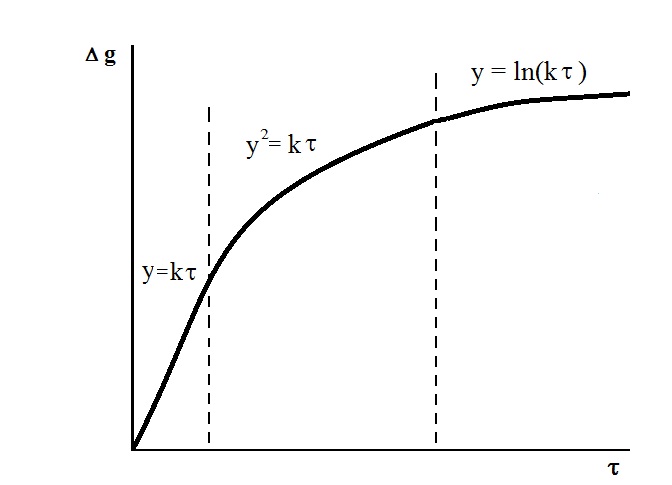
Рис. 1.Суммарная кривая окисления маталла.
Цель и работы
Целью данной работы является установление закона, по которому растет плёнка продуктов коррозии на поверхности металла при окислении его кислородом воздуха при повышенных температурах.
Перед проведением работ необходимо ознакомиться по литературным источникам, приведенным ниже:
а) с механизмом окисления металлов и механизмом химической коррозии;
б) с требованиями к легирующим добавкам и механизмам их действия;
в) с методами коррозионных испытаний в части определения весового показателя коррозии.
Экспериментальная часть
Работа выполняется на установке, показанной на рис.2. Включение муфельной печи I, доведение в ней температуры до заданной, постоянное значение которой в процессе исследования поддерживается автоматически, производится лаборантом кафедры до начала выполнения лабораторной работы.
|
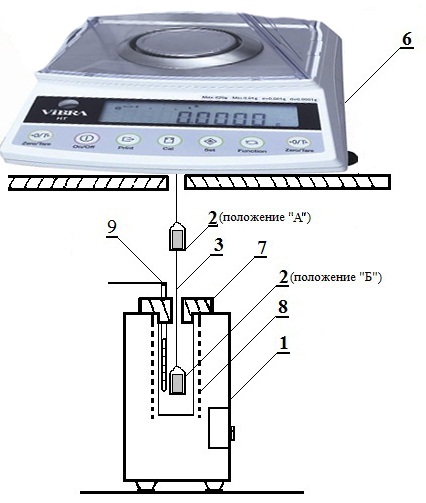
1 – муфельная электропечь МП-3 с терморегулятором 2 – кварцевый тигель с образцом 3 – металлическая нить 4 – кольцо для удержания образца в положении «Б» 5 – крючок для закрепления образца в положении «А» 6 – аналитические весы VIBRA HTR 220. 7 – крышка печи 8 – нагревательная спираль 9 – термопара для замера и поддержания температуры
|
Рис. 2. Установка для определения скорости коррозии металлов
при повышенных температурах
Образец исследуемого металла или сплава из фольги тщательно зачищается наждачной бумагой, обезжиривается содой Na2CO3, промывается дистиллированной водой, высушивается и помещается в кварцевый тигель 2, подвешенный на нить 3 с помощью кольца 4 на крючок 5 (положение тигля "А"). В этом положении образец вместе с тиглем и подвесочной нитью взвешивается с точностью до 4-го знака на аналитических весах 6.
Внимание! Подвешивать нить с образцом на крючок разрешается только при выключенных (арретированных) весах.
После съема разъемной крышки 7 образец с тиглем осторожно снимается с крючка и переводится в положение "Б". Включается секундомер, и этот момент времени τ0 считается началом проведения опыта. Фиксируется вес, который будет являться исходным для τ = 0 и определения привеса образца в процессе окисления.
Крышка вновь устанавливается на место. Весы снимаются с арретира (включаются) и остаются включенными на все время проведения опыта. Измерение веса в первые 10 ÷ 15 минут опыта следует производить через 1÷5 минуты, в дальнейшем взвешивание повторяется через каждые 5 минут в течение до I ÷ 1,5 часов. Результаты взвешивания заносятся в таблицу 1.
Таблица 1
Экспериментальные данные коррозионного процесса
Темпера-тура в печи, °С |
Время от начала опыта τn, мин |
Вес образца с тиглем и нитью (до ,0001), г |
Привес образца Δ g (разность весов в момент времени τn и τ0), г |
Скорость изменения веса ΔΔ g (разность весов в момент времени τn и τn-1), г |
|
|
|
|
|
После окончания опыта печь отключается, весы выключвются, разъемная крышка снимается и тигель с образцом переводится вновь в положение "А" путем завешивания нити 3 за кольцо 4 на крючок 5, тигель охлаждается до комнатной температуры. Образец пинцетом вынимается из тигля и дается визуальная оценка его внешнего вида. Идентифицируется по справочным данным состав продуктов коррозии и их адгезия.
Обработка полученных результатов
По полученным данным рассчитываются весовые положительный и отрицательный показатели коррозии К+вес и К-вес по формулам:
![]()
где, ΔΔg – изменение веса образца, относительно предыдущего взвешивания, г;
S – поверхность образца, м2;
Δτ =(τn - τn-1) – время контакта образца с коррозионной средой, за период от предыдущего взвешивания, час.
![]()
где, АМе – атомный вес металла;
n – изменение валентности металла ;
МОк – молекулярный вес оксида;
m – изменение валентности агрессивного компонента (каслорода);
к – количество атомов кислорода в молекуле оксида.
Критерий
сплошности :
![]() ,
как отношение удельного мольного объема
оксида к удельному объему металла можно
рассчитать по формуле:
,
как отношение удельного мольного объема
оксида к удельному объему металла можно
рассчитать по формуле:
![]() ,
,
где, dМе – плотность металла, г/см3;
dОк – плотность оксида металла, г/см3.
Толщина плёнки оксида (h) рассчитывается для каждого момента времени (τn) эксперимента по формуле:
![]() ,
см
,
см
Полученные расчётные и экспериментальные данные сводятся в таблицу 2.
Таблица 2
Параметры коррозионного процесса.
Время, мин |
Температура, 0С |
τ, час |
В |
h, см |
К-вес., г/м2∙час |
П, мм/год |
|
|
|
|
|
|
|
По данным таблицы строятся графические зависимости: h – τ; lgh – Igτ, h – Igτ и К-вес. – h.
В отчете дается краткое описание методики эксперимента приводятся полученные результаты, рассчитываются ошибки определений и погрешности замеров. Приводятся таблицы и подробный анализ полученных данных.
Графические зависимости и данные последней таблицы анализируются; при этом должен быть дан ответ на следующие вопросы:
1) Как связаны полученные цифровые данные с внешним видом прокорродировавших образцов и почему эта связь имеет место?
2) Является ли пленка образовавшихся оксидов сплошной?
3) Почему кривая имеет тот вид, который получился на графике?
4) Каков механизм коррозии?
5) В каком участке, считая от поверхности корродирующего материала, может быть зона роста пленки оксидов?
Даются выводы. Даются практические рекомендации по способам защиты данного металла, пути повышения окалиностойкости.
Литература
1. Жук Н. П. «Курс коррозии и защиты металлов». Металлургиздат М., 1968.
2. Томашов Н. Д., Жук Н. П., Титов В. А., Веденеева М. А. «Лабораторные работы по коррозии и защите металлов». Металлургия, М., 1971.
3. Бахвалов Г. Т., Турковская А. В. «Руководство к лабораторным работам по коррозии и гальваностегии». Изд. «Металлургия», М., 1965.
ВОПРОСЫ ДЛЯ САМОПРОВЕРКИ
1. Как определить термодинамическую возможность газовой коррозии?
2. Как меняется термодинамическая возможность газовой коррозии с изменением температуры среды и почему?
3. Каков механизм газовой коррозии в случае образования защитных и незащитных коррозионных пленок?
4. Каков механизм диффузии в защитных оксидных пленках
5. По какому закону растут оксидные защитные пленки случае лимитирующей стадии — диффузии в пленке?
6. По какому закону растут оксидные защитные пленки в случае соизмеримости лимитирующих стадий - диффузии и химической реакции компонентов в пленке?
7. Как рассчитывается положительный и отрицательный весовые показатели для газовой коррозии? Каков физический смысл этих показателей?
8. Как рассчитать отрицательный весовой показатель газовой коррозии, зная её положительный весовой показатель?
9. Как меняется скорость газовой коррозии с изменением температуры?
10. Как меняется состав коррозионных окислов черных металлов при изменении температуры?
11. Какие методы защиты от газовой коррозии Вы знаете?
12. Как зависит скорость газовой коррозии металлов от чистоты поверхности, местных напряжений, скорости движения газовой среды, наличия наклепа и др. факторов?
Дополнительные вопросы для самопроверки студентам специальности ТОМ, ММ.
1. Как классифицируются коррозионные процессы по характеру коррозионных разрушений?
2. Качественные и количественные показатели коррозионной стойкости?
3. Взаимосвязь показателей коррозионной стойкости и характера коррозионного разрушения металла?
4. Глубинный показатель коррозионной стойкости, его определение и расчет по весовым показателям коррозионной стойкости.
5. Десятибалльная шкала коррозионной стойкости и её применимость для оценки различных по характеру разрушения коррозионных процессов.
6. Стадийность процесса химического окисления металлов.
7. Лимитирующая стадия процесса и закон роста оксидных пленок.
8. Лимитирующая стадия при линейном законе роста пленок и принцип определения ряда металлов, окисляющихся по этому закону.
9. Почему при линейном законе роста оксидной пленки температурная зависимость скорости окисления соответствует температурной зависимости константы скорости диффузии, а не константы скорости химической реакции?
10. Какова лимитирующая стадия при логарифмическом законе роста оксидных пленок?
11. Как идентифицировать параболический закон роста пленок по опытной кривой окисления металлов?
12. Физический смысл объединенной кривой окисления металлов.
13. Внутренние и внешние факторы, влияющие на скорость газовой коррозии.
14. Особые случаи газовой коррозии.
15. Обезуглероживание сталей, его химизм и методы его предупреждения.
16. Рост чугуна, его сущность и методы предупреждения.
17. Водородная хрупкость сталей, её сущность, предупреждение и устранение этого вида коррозионного разрушения.
18. Жаростойкое легирование — как метод защиты от газовой коррозии; требования к легирующему компоненту. Основные компоненты жаростойких сталей.
19. Термохромирование и термоалитирование — как методы защиты от газовой коррозии; их практическое осуществление и применимость.
20. Безокислительный нагрев в защитных атмосферах. Принцип выбора состава защитной атмосферы для данного температурного режима обработки металла.
ОПРЕДЕЛЕНИЕ СКОРОСТИ КОРРОЗИИ МЕТАЛЛА ПО КОЛИЧЕСТВУ ВЫДЕЛИВШЕГОСЯ ВОДОРОДА