
- •Лабораторна робота 6
- •Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 6.1. Отримання ацетилену I його горiння
- •Хiмiзм процесу:
- •Дослiд 6.2. Приєднання брому до ацетилену
- •Хiмiзм процесу:
- •Дослiд 6.3. Реакцiя ацетилену з окиснювачами
- •Дослiд 6.4. Утворення ацетиленiду срiбла
- •Хiмiзм процесу:
- •Дослiд 6.5. Утворення ацетиленiду мiдi
- •Хiмiзм процесу:
- •Контрольнi запитання
- •Лабораторна робота 7 ароматичнi сполуки Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 7.1. Синтез бензолу iз бензойнокислого натрiю
- •Хiмiзм процесу:
- •Дослiд 7.2. Синтез нiтробензолу
- •Хiмiзм процесу:
- •Вивчення властивостей бензолу Дослiд 7.3. Розчинність бензолу у різних розчинниках
- •Дослiд 7.4. Горіння бензолу
- •Дослiд 7.5. Дiя бромної води на бензол
- •Дослiд 7.6. Дiя перманганату калiю на бензол
- •Сульфування аренів
- •Дослiд 7.7. Отримання бензолсульфокислоти
- •Окиснення аренів
- •Дослiд 7.8. Окиснення гомологiв бензолу
- •Контрольнi запитання
- •Лабораторна робота 8 галогенопохiднi вуглеводнi Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 8.1. Синтез бромистого етилу
- •Хімізм процесу:
- •Дослiд 8.2. Синтез хлористого етилу
- •Хiмiзм процесу:
- •Дослiд 8.3. Синтез йодоформу з етилового спирту
- •Дослiд 8.4. Отримання бромбензолу
- •Хiмiзм процесу:
- •Дослiд 8.5. Вплив каталізаторів на хід бромування вуглеводнів
- •Хімізм процесу:
- •Контрольнi запитання
- •Лабораторна робота 9 спирти I простi ефiри Будова, iзомерiя, номенклатура I властивостi
- •Дослiд 9.1. Визначення будови спиртів
- •Дослiд 9.2. Утворення I гiдролiз алкоголятiв
- •Хiмiзм процесу:
- •Дослiд 9.3. Окиснення етилового спирту оксидом мiдi (II)
- •Хiмiзм процесу:
- •Дослiд 9.4. Окиснення етилового спирту перманганатом калiю
- •Хiмiзм процесу:
- •Дослiд 9.5. Синтез дiетилового ефiру
- •Хiмiзм процесу:
- •Дослiд 9.7. Взаємодiя глiцерину з гiдроксидом мiдi (II)
- •Хiмiзм процесу:
- •Контрольнi запитання
Дослiд 8.1. Синтез бромистого етилу
Реактиви та матеріали: |
етиловий спирт, бромід калію (порошок); сульфатна кислота (d = 1,84 г/см3). |
У пробірку з газовідвідною трубкою вміщують 3 краплі спирту, 2 краплі води й 3 краплі сульфатної кислоти. Охолодивши розігріту спирто-кислотну суміш, до неї додають на кінці мікролопатки декілька кристалів броміду калію. Пробірку закріплюють під нахилом в лопатці штативу й обережно нагрівають вміст пробірки до кипіння. Кінець газовідвідної трубки вставляють в іншу пробірку, що містить 6-7 крапель охолодженої льодом води. Нагрівання ведуть до зникнення кристалів броміду калію в реакційній пробірці. У приймачі утворюються два шари: нижній – бромистий етил, верхній – вода. За допомогою палички вносять 1 краплю бромистого етилу до полум'я пальника. Краї полум'я зафарбовуються в зелений колір.
Хімізм процесу:
C2H5OH + HO – SO3H ↔ C2H5 – O – SO3H + HOH
етилсульфатна кислота
КBr + H2SO4 ↔ HBr + KHSO4
гідросульфід калію
С2H5 – O – SO3H + HBr → C2H5Br + H2SO4
бромистий етил
Найбільш зручним способом отримання галогеналкілів є заміщення гідроксильної групи спиртів R – OH на галоген. Отримання галогенопохідних із спиртів застосовується у великих масштабах, так оскільки спирти – легкодоступні й добре вивчені сполуки. У деяких випадках при отриманні галогеналкілів замість галогеноводнів застосовують галогеніди фосфору.
Дослiд 8.2. Синтез хлористого етилу
Реактиви та матеріали: |
етиловий спирт, сiрчана кислота (d = 1,84 г/см3), хлорид натрiю |
Обладнання: |
пробiрки, пальник, піпетки |
В пробiрку насипають дрiбнi кристали хлориду натрiю (шар 1 мм), потiм до-дають 3 краплi етилового спирту, 3 краплi сiрчаної кислоти i нагрiвають сумiш на полум’ї пальника. Хлористий етил, що видiляється, спалахує, утворюючи характерне кiльце, забарвлене в зелений колiр.
Хiмiзм процесу:
C2H5OH + HO-SO3H C2H5 O SO3H + H2O
NaCl + H2SO4 HCl + NaHSO4
C2H5 O SO3H + HCl C2H5Cl + H2SO4
Хлористий етил - газ, легко згущується в рiдину з температурою кипiння 285 К.
Дослiд 8.3. Синтез йодоформу з етилового спирту
Реактиви та матеріали: |
етиловий спирт, їдкий натр, 2Н розчин йоду в йо-дидi калiю |
Обладнання: |
мiкроскоп, предметне скло, пробiрки |
У пробiрку вносять краплю етилового спирту, 3 краплi розчину їдкого натру i 3 краплi розчину йоду в йодидi калiю. Вмiст пробiрки нагрiвають, але не до кипiння, бо в киплячому розчинi йодоформ розщеплюється лугом. В результатi реакцiї з’являється бiла каламуть, з якої поступово при охолодженнi утворюються кристали йодоформу. Якщо каламуть розчиняється, додають ще 2-3 краплi розчину йоду до теплої реак-цiйної сумiшi i ретельно перемiшують вмiст пробiрки, поки не почнеться видiлення кристалiв.
Двi краплi осаду переносять на предметне скло, розглядають їх пiд мiкроско-пом (рис.8.1) Кристали йодоформу мають вигляд шестикутникiв або шестикiнцевих снiжинок.
Хiмiзм процесу: J2 + 2NaOH NaOJ + NaJ + H2O NaOJ NaJ +[O] CH3
CH2OH
+ [O]
етанол етаналь
+
3J2
+ NaOH CHJ3 + HCOONa йодоформ |
Рис. 8.1. Кристали йодоформу |
Йодоформ утворює кристали жовтого кольору з температурою плавлення 119оС, має дуже рiзкий запах. Йодоформ - прекрасний антисептик.

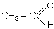 + H2O
+ H2O + 3HJ
+ 3HJ
