
- •3 Масообмінні процеси
- •3.1 Основи масопередачі. Загальні відомості
- •3.1.1 Види процесів масопередачі
- •3.1.2 Фізична суть процесів масопередачі
- •3.1.3 Основні визначення
- •3.1.4 Основне рівняння масопередачі
- •3.1.5 Способи вираження концентрацій бінарних сумішей
- •3.1.6 Рівновага при масопередачі
- •3.1.6.1 Правило фаз
- •3.1.6.2 Криві рівноваги
- •3.1.6.3 Закон Генрі
- •3.1.6.5 Закон Рауля
- •3.1.7 Матеріальний баланс процесів масообміну.
- •3.1.7.1 Робоча лінія
- •3.1.7.2 Графічне зображення процесу. Напрямок процесу переносу
- •3.1.8 Механізм процесу масопередачі
- •3. 1.9 Молекулярна дифузія. Перший закон Фіка
- •3.1.9.2 Турбулентна дифузія.
- •3.1.9.2 Перенос енергії в турбулентному потоці
- •3.1.9.3 Перенос маси в турбулентному потоці
- •3.1.10 Конвективна дифузія
- •3.1.11 Диференційні рівняння масопередачі
- •3.1.11.1 Диференційне рівняння молекулярної дифузії
- •3.11.2 Диференціальне рівняння конвективної дифузії. Другий закон Фіка
- •3.1.11.3 Основний закон масовіддачі. Основний закон конвективної дифузії
- •3.1.12 Рівняння на межі розділу фаз
- •3.1.13 Математичний опис процесу масопередачі
- •3.1.14 Загальний розв'язок основного рівняння масопередачі
- •3.1.15 Рушійна сила масообмінних процесів
- •3.1.15.1 Визначення середньої рушійної сили для випадку, коли лінія рівноваги пряма
- •3.1.15.2 Визначення Yср для випадку, коли лінія рівноваги крива
- •3.1.16 Вплив перемішування на середню рушійну силу δYср і δХср
- •3.1.18 Об'ємні коефіцієнти масовіддачі і масопередачі
- •3.1.19 Подібність процесів масопереносу
- •3.1.20 Перетворення основного рівняння масопередачі для насадкових апаратів.
- •31.21 Визначення числа одиниць переносу
- •3.1.21.1 Визначення числа одиниць переносу для випадку, коли лінія рівноваги пряма
- •3.1.21.2 Визначення числа одиниць переносу для випадку, коли лінія рівноваги крива
- •3.1.22 Визначення висоти одиниці переносу
- •3.1.23 Основи розрахунку масообмінних апаратів.
- •3.1.23.1 Розрахунок діаметра колони
- •3.1.23.2 Визначення швидкості газу в насадкових апаратах
- •Загальна структура формули розрахунку лінійної швидкості газу в точці захлинання має вигляд:
- •1.22.3 Швидкість потоку в тарільчатих апаратах.
- •3.1.23.4 Розрахунок висоти апарата
- •3.1.23.5 Визначення числа ступенів зміни концентрації (числа теоретичних тарілок)
- •3.1.23.6 Розрахунок числа дійсних тарілок за кінетичною кривою
- •3.1.23.7 Визначення відстані між тарілками
- •3.1.23.9 Гідравлічний опір тарільчатої колони
- •3.1.24 Методика розрахунку насадкового масообмінного апарата
- •3.1.25 Методика розрахунку тарільчатого масообмінного апарата
- •3.1.26 Масопередача в системах з твердою фазою
3.1.6 Рівновага при масопередачі
3.1.6.1 Правило фаз
При масопередачі має місце наявність двох фаз. Цільовий компонент переходить з однієї фази до іншої до встановлення стану рівноваги.
Кінець процесу масопередачі (теоретичний) визначається станом рівноваги, який залежить від умов проведення процесу – температури, і тиску. Умови, при яких система знаходиться в стані рівноваги, можуть змінюватись.
Для визначення умов стану рівноваги застосовується правило фаз, яке визначає кількість параметрів N, які можна змінювати довільно, не порушуючи стану рівноваги в системі:
К + 2 = Ф + N (3.29)
де К – число компонентів системи;
Ф – число фаз;
N – число ступенів свободи (число змінних параметрів, які можна змінювати без порушення стану рівноваги).
Розглянемо деякі випадки:
1. Для води при t = 0,0075 С і Р = 6100 Па існують всі три фази, так звана потрійна точка. Для цього випадку число компонентів К = 1, число фаз Ф = 3, число ступенів свободи:
N = К + 2 – Ф = 1 + 2 – 3 = 0
Тобто не можна змінювати жодного параметра без порушення стану рівноваги.
2. Система вода – насичена пара: К = 1; Ф = 2. Число ступенів свободи:
N = К + 2 – Ф = 1 + 2 – 2 = 1
Одна ступінь свободи. Тобто не порушуючи стану рівноваги, можна змінювати або температуру, або тиск. Змінюючи температуру, змінюємо тиск, зберігаючи рівновагу в системі, тобто забезпечуючи існування як рідини, так і пари.
Для води широко застосовуються залежності Р = f(t) і t = f(P), які характеризують рівноважний стан системи і наведені в термодинамічних таблицях.
3. При масопередачі часто зустрічаються випадки, коли К = 3 (абсорбція) – цільовий компонент і два носії в двох фазах; і К = 2 (ректифікація) коли інертний носій відсутній. Число фаз в обох випадках Ф = 2.
Для цих випадків:
N1 = 3 + 2 – 2 = 3
N2 = 2 + 2 – 2 = 2
Тобто стан рівноваги може бути збережений при N1 = 2 і N2 = 3 параметрів. До цих параметрів відносяться: температура t, тиск Р та концентрація цільового компонента в одній із фаз у або х.
Таким чином при Р = const i t = const зберігається рівновага, тобто кожній концентрації в одній фазі відповідає рівновага в другій:
yP = f(x) (3.30)
Зазвичай при проведенні процесів масопередачі підтримують постійним один із незалежних параметрів (Р = const) або (t = const). Якщо Р = const, то кожній температурі t буде відповідати цілком визначена концентрація х або у. І кожному значенню тиску (при t = const) відповідає певне значення х або у.
3.1.6.2 Криві рівноваги
Таким чином, умови існування стану рівноваги при масопередачі можна описати за допомогою залежностей тиск-концентрація: P = f(x) при t = const; температура-концентрація: t =f(x) при Р = const і концентрація в одній фазі – рівноважна концентрація в іншій – yP = f(x). Ці залежності можуть бути виражені за допомогою фазових діаграм, рис. 1.2, 1.3.
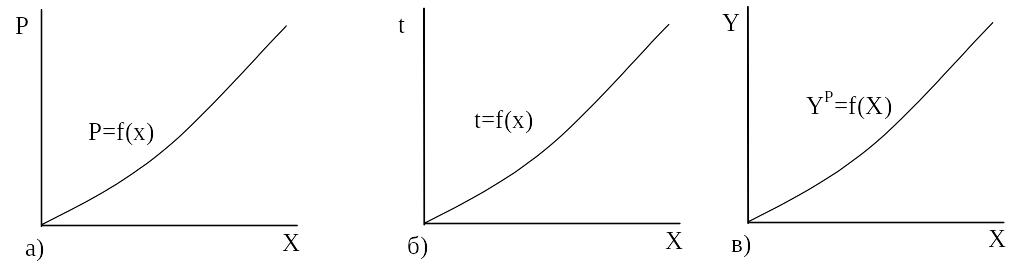
Рис. 3.2. Фазові діаграми рівноваги:
а) P = f(x) при t = const;
б) t =f(x) при Р = const;
в) yP = f(x) при Р = const, t = const.
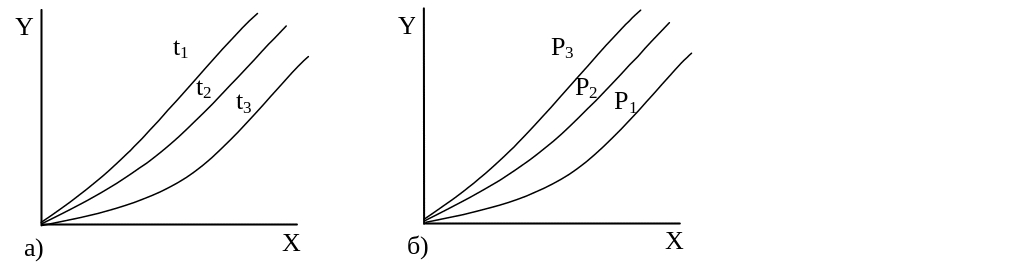 Рис.
3.3. Залежність yP
= f(x) при різних значеннях температури
і тиску:
Рис.
3.3. Залежність yP
= f(x) при різних значеннях температури
і тиску:
а) yP = f(x) при Р = const і t1 > t2 > t3.
б) yP = f(x) при t = const, і Р1 > Р2 > Р3.
Криві рівноваги являють собою геометричне місце точок, які характеризують стан рівноваги між двома фазами Тобто, кожна точка на кривій рівноваги визначає кінцевий стан системи, або з точки зору технології, кінець процесу масопередачі на даній ділянці.
Найбільш поширена залежність, яка наведена на графіках
yP = f(x) (3.31)
по яких, знаючи концентрацію в одній фазі х та умови проведення процесу – знаходять рівноважну концентрацію, а тому час перебігу процесу, розміри та об’єм апаратів.
Відношення концентрацій в двох фазах при рівновазі називається коефіцієнтом розподілення
![]() (3.32)
(3.32)
і є тангенсом кута нахилу лінії рівноваги. Якщо лінія рівноваги крива, то m – величина змінна.
Для конкретних випадків масопередачі побудова ліній рівноваги проводиться на підставі законів, які характеризують цю рівновагу – закона Генрі і закона Рауля.
