
- •1. Алканы ряда метана, их общая формула и химическое строение гомологов данного ряда. Метан, химические свойства (горение, реакция замещения) и применение.
- •3.Алкены ряда этена (этилена), их общая формула и химическое строение гомологов данного ряда. Этилен, его химические свойства (горение, реакции присоединения и полимеризации) и применение.
- •1. Реакции окисления.
- •2. Реакции присоединения.
- •3. Реакции полимеризации.
- •4. Алкадиены, их строение, химические свойства (реакции присоединения и полимеризации), практическое значение.
- •2. Реакции присоединения
- •3. Полимеризация
- •5. Алкины, их общая формула. Этин (ацетилен), строение молекулы, химические свойства (горение, реакции присоединения), получение и применение.
- •1. Окисление.
- •2. Реакции замещения.
- •3. Реакции присоединения
- •7. Основные положения теории химического строения органических веществ
- •1. Все атомы, образующие молекулы органических веществ, связаны в определённой последовательности согласно их валентности.
- •2. Свойства веществ зависят не только от того, какие атомы и в каком количестве входят в состав молекулы, но и от порядка соединения атомов в молекуле (то есть от химического строения).
- •3. По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы можно предвидеть свойства.
- •4. Атомы и группы атомов в молекулах веществ взаимно влияют друг на друга.
- •8. Изомерия органических соединений и ее виды.
- •1. Изомерия углеродной цепи.
- •3. Изомерия положения функциональной группы.
- •4. Межклассовая изомерия.
- •9. Природный газ и его практическое использование.
- •10. Нефть и её практическое использование.
- •11. Предельные одноатомные спирты, их строение, свойства. Применение и получение этилового спирта.
- •Горение
- •12. Глицерин – представитель многоатомных спиртов. Строение, физические и химические свойства (реакция этерификации), применение.
- •13. Фенол, его строение, свойства, применение.
- •14. Получение спиртов из предельных и непредельных углеводородов. Промышленный способ получения метанола.
- •15. Альдегиды, их химическое строение и свойства, получение и применение (на примере муравьиного и уксусного альдегидов).
- •16. Предельные одноосновные карбоновые кислоты, их строение и свойства на примере уксусной кислоты.
- •17. Жиры как сложные эфиры глицерина и карбоновых кислот, их состав и свойства. Жиры в природе, превращение жиров в организме. Продукты технической переработки жиров, понятие о мылах.
- •18. Глюкоза - представитель моносахаридов, строение, физические и химические свойства, применние.
- •19. Крахмал. Нахождение в природе, гидролиз крахмала, применение.
- •20. Целлюлоза, состав, физические и химические свойства, применение. Понятие об искусственных волокнах на примере ацетатного волокна.
- •21. Анилин - представитель ароматических аминов; строение и свойства; получение и применение.
- •22. Аминокислоты, их состав и химические свойства (взаимодействие с соляной кислотой, щелочами, друг с другом). Применение, биологическая роль.
- •24. Белки как биополимеры. Свойства и биологические функции белков.
- •25. Общая характеристика высокомолекулярных соединений: состав, строение, реакции, лежащие в основе их получения (на примере полиэтилена или синтетического каучука).
13. Фенол, его строение, свойства, применение.
Фенол С6Н5ОН – бесцветное, кристаллическое вещество с характерным запахом. Его t плавления = 40,9 С. В холодной воде он мало растворим, но уже при 70◦С растворяется в любых отношениях. Фенол ядовит. В феноле гидроксильная группа соединена с бензольным кольцом.

фенол
Химические свойства
1. Взаимодействие с щелочными металллами.
2C6H5OH + 2Na → 2C6H5ONa + H2
фенолят натрия
2. Взаимодействие со щелочью (фенол – слабая кислота)
C6H5OH + NaOH → C6H5ONa + H2O
3. Галогенирование.

4. Нитрование
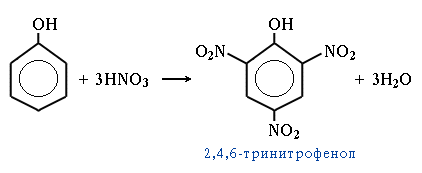
5.Качественная реакция на фенол
3C6H5OH +FeCl3 → (C6H5O)3Fe +3HCl (фиолетовое окрашивание)
Применение
Для дезинфекции, получение лекарств, красителей, взрывчатых веществ, пластмасс.
14. Получение спиртов из предельных и непредельных углеводородов. Промышленный способ получения метанола.
Наибольшее промышленное значение имеют метанол и этанол.
Промышленный синтез метанола.
Метанол применяется в производстве ряда органических веществ (формальдегида, лекарств), используется как растворитель лаков и красок, служит добавкой к топливам. В настоящее время метанол получают экономически выгодным способом из синтез-газа:
1.Синтез-газ получают взаимодействием метана (природного газа) с водяным паром в присутствии катализатора:
СН4+Н2О → СО+3Н2
синтез-газ
2.Из синтез-газа получают метанол:
СО
+ 2Н2
![]() СН3ОН
+Q
СН3ОН
+Q
1моль 2моль 1 моль
Получение спиртов из предельных и непредельных углеводородов.
1. Этанол в промышленности получают гидратацией этилена:
СН2=СН2 + Н2О → СН3-СН2-ОН
2. Из предельных углеводородов спирты получают через галогенопроизводные. Первая реакция – галогенирование алкана:
С2Н6 + Br2 → C2H5Br + HBr
бромэтан
Вторая реакция- взаимодействие бромэтана с водным раствором щёлочи:
C2H5Br + НОН C2H5ОН + НBr
Щёлочь нужна, чтобы нейтрализовать НBr.
Промышленного значения такой способ не имеет, им пользуются в лабораториях. Но он важен в теоретическом отношении, так как показывает взаимосвязь между предельными углеводородами, их галогенопроизводными и спиртами.
15. Альдегиды, их химическое строение и свойства, получение и применение (на примере муравьиного и уксусного альдегидов).
А льдегиды
– органические вещества, содержащие
альдегидную функциональную
льдегиды
– органические вещества, содержащие
альдегидную функциональную
г![]() руппу
(или –СНО), соединённую
с углеводородным радикалом.
руппу
(или –СНО), соединённую
с углеводородным радикалом.
Общая формула альдегидов:
Гомологический ряд
НСНО метаналь, формальдегид
СН3СНО этаналь, ацетальдегид
С2Н5СНО пропаналь
С3Н7СНО бутаналь
Физические свойства, применение
Формальдегид – газ с характерным запахом, ядовит, его 40% раствор называется формалином. Применяется в медицине для дезинфекции, получения пластмасс. Ацетальдегид – жидкость, растворимая в воде, ядовита, применяется для получения пластмасс, этанола, уксусной кислоты.
Химические свойства
1. Реакция «серебряного зеркала»- качественная реакция на альдегиды
СН3СНО + Ag2O → CH3COOH + 2Ag
ацетальдегид уксусная кислота
2. Окисление гидроксидом меди – качественная реакция на альдегиды – образование кирпично-красного осадка Cu2O
СН3СНО + Cu(OH)2 → CH3COOH + Cu2O + 2H2O
3. Восстановление водородом (получение спирта)
СН3СНО + H2 → CH3CH2OH
Получение
1. Окисление спиртов
R–CH2–OH +CuO → R-CHO + Cu + H2O
Гидратация ацетилена
H–С≡C–H + H2O → CH3CHO
