- •Старооскольский технологический институт
- •Неорганическая химия Лабораторный практикум
- •Содержание
- •Предисловие
- •1.Коррозия металлов и методы защиты от нее
- •1. Коррозия, возникающая при контакте двух металлов, различных по природе
- •2. Коррозия, возникающая при образовании микрогальванопар
- •3. Активирующее действие ионов Cl– на процессы коррозии
- •4. Анодные и катодные защитные покрытия
- •5. Протекторная защита
- •6. Катодная защита (электрозащита)
- •2.Гальванические элементы
- •Гальванический элемент Даниэля-Якоби
- •3.Электрохимическое получение латуни и бронзы
- •4.Синтез неорганических веществ
- •5.Определение металлов в их соединениях
- •6.Определение неметаллов в их соединениях
- •7.Химические свойства галогенов
- •8.Химические свойства р-металлов
- •9.Химические свойства металлов семейства железа
- •10.Химические свойства s-металлов
- •Рекомендуемая литература
- •Общие требования к составлению отчета по лабораторным работам
- •Приложения Приложение 1. Стандартные окислительно-восстановительные потенциалы
- •Приложение 2. Растворимость солей и оснований в воде
5.Определение металлов в их соединениях
Цель работы
Научиться определять ионы металлов по качественным и характерным реакциям/
Приборы и реактивы
Пробирки, пипетки.
Натрий фосфорнокислый двузамещенный, чда.
Кислота соляная, стандарт титр 0,1М.
Аммиак водный, чда.
Аммиак водный, 2н. раствор
Алюминон, хч.
Ализарин, хч.
Кислота уксусная, ледяная, хч.
Карбонат аммония, чда.
Гексацианоферрат (II) калия (желтая кровяная соль), чда.
Аммоний родоновокислый, чда.
Оксид свинца IV, хч.
Кислота азотная, концентрированная, хч.
Реактив Чугаева.
Вода дистиллированная.
Порядок проведения работы;
Приготовление рабочих растворов
Раствор НCl, 0,1н. Готовят по стандарт-титру.
Раствор Na2HPO4, 0,1 М. Готовят по точно взвешенной навеске, растворяя 1,42 г препарата в 100 мл дистиллированной воды.
2 н. раствор NH4OH. Готовят по стандарт-титру.
Раствор (NH4)2CO3, 0,1 М. Готовят по точно взвешенной навеске, растворяя 0,96 г препарата в 100 мл дистиллированной воды.
Раствор гексацианоферрата (II) калия (желтая кровяная соль), 0,1М. Готовят по точно взвешенной навеске, растворяя 3,68 г препарата в 100 мл дистиллированной воды.
Раствор родонита аммония (тиоцианат аммония), 0,1М. Готовят по точно взвешенной навеске, растворяя 0,76 г препарата в 100 мл дистиллированной воды.
Определение магния
Осаждение ионов магния в виде двойного фосфата магния аммония происходит в результате взаимодействия гидрофосфата натрия с ионами магния в щелочных аммиачных растворах. При этом образуется мелкокристаллический, легко фильтруемый осадок белого цвета.
В пробирку с 2 – 3 каплями раствора соли магния добавляют 3 – 4 капли 0,1 н. раствора НС1 и 2 – 3 капли раствора Na2HPO4. Затем добавляют по одной капле 2 н. раствор NH4OH при перемешивании до выпадения белого кристаллического осадка фосфата магния-аммония MgNH4PO4•6Н2О. Затем вводят избыток NH4OH до слабощелочной реакции (проба с фенолфталеином):
Mg2++Na2HPO4+NH4OH = MgNH4PO4+2Na++H2O
Определение алюминия
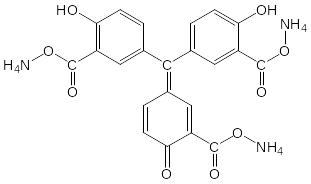
1. Алюминон с гидроксидом А1(ОН)3 образует лак красного цвета.
Al(OH)3 + |
|
(С22H11O9)Al (ярко-красные хлопья). |
К 2 – 3 каплям соли алюминия в присутствии СН3СООН добавляют 1 – 2 капли 0,01%-ного раствора алюминона и нагревают на водяной бане. Затем добавляют раствор NH4OH до слабощелочной реакции и 2 капли раствора (NH4)2CO3. Выпадают красные хлопья алюминиевого лака.
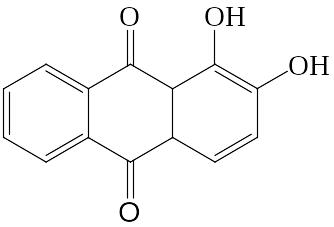
2. Ализарин способствует образованию алюминиевого лака.
|
+Al(OH)3 = |
|
На фильтровальную бумагу наносят 1 каплю раствора соли алюминия. Держат бумагу 1 – 2 мин над концентрированным раствором NH4OH. Затем проводят по пятну свежеприготовленным раствором ализарина и снова держат над концентрированным раствором NH4OH. Осторожно подсушивают бумагу над горелкой. Розовое (но не фиолетовое) пятно указывает на присутствие ионов А13+ в виде алюминиевого лака, нерастворимого в уксусной кислоте.
Определение железа
Гексацианоферрат (II) калия K4[Fe(CN)6] образует с ионами Fe3+ темно-синий осадок берлинской лазури:
4Fe3+ + 3K4[Fe(CN)6] = Fe4[Fe(CN)6]3 +12K+
Осадок разлагается в щелочах, поэтому реакцию следует проводить в кислой среде. В присутствии оксалатов осадок не выпадает, а появляется только синее окрашивание.
Для проведения реакции к 2 – 3 мл анализируемого раствора ионов железа III, подкисленного 0,1 М раствором соляной кислоты, добавляют по каплям 0,1 М раствор гексацианоферрата (II) калия. В присутствии ионов железа появляется интенсивно синее окрашивание – происходит образование берлинской лазури, которая затем переходит в осадок.
Определение меди
Одной их характерных реакций на Cu2+ является образование осадка родоновокислой меди, идущее по схеме:
Cu2+ + NH4CNS = NH4+ + Cu(CNS)2
Образующийся осадок переходит в прозрачный коллоидный раствор темно-красного цвета.
Для проведения реакции к 2 – 3 мл анализируемого раствора ионов меди II, добавляют по каплям 0,1 М раствор родонита аммония. В присутствии ионов меди появляется темно-красное окрашивание.
Определение марганца
Диоксид свинца РbО2 окисляет ионы Мn2+ до МnО4– ионов:
2Mn2+ + 5PbO2 + 6HNO3 = 2HMnO4 + 5Pb2++2H2O
В пробирку помещают РbО2 и несколько капель HNO3 плотностью 1,2 г/см3, нагревают, центрифугируют и добавляют 1 – 2 капли раствора соли марганца (II), перемешивают и снова нагревают. Раствор окрашивается в малиновый цвет.
Определение никеля
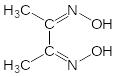
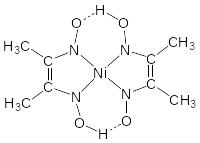
Диметилглиоксим образует с ионами Ni2+ ярко-красный кристаллический осадок внутрикомплексной соли диметилглиоксимата никеля – реакция Чугаева:
NiSO4 + 2 |
|
+ 2NH4OH = |
|
|
+ (NH4)2SO4 + 2H2O |
||
Проведению этой реакции мешают ионы Fe2+, образующие с диметилглиоксимом растворимые комплексы красного цвета.
На фильтровальную бумагу наносят 1 каплю Na2HPO4, образующийся осадок FePО4 остается в центре пятна, а растворимый Ni3(PO4)2 — на периферии. Обводят вокруг пятна капилляром с диметилглиоксимом. Бумагу обрабатывают аммиаком (держат над склянкой с концентрированным аммиаком). На бумаге появляется розовое кольцо или пятно, указывающее на присутствие ионов Ni2+
Обработка результатов
Результаты измерения записывают в виде таблицы:
Определяемый ион |
Характерная реакция |
Визуальный эффект |
|
|
|
Контрольные вопросы
Опишите основные свойства щелочных металлов
Опишите основные свойства щелочноземельных металлов
Опишите основные свойства алюминия
Опишите основные свойства свинца
Опишите основные свойства железа, кобальта и никеля
Опишите основные свойства марганца и хрома
Опишите основные свойства элементов подгруппы меди
Опишите основные свойства элементов подгруппы цинка
Опишите основные свойства элементов платиновой группы
По какой причине переходные металлы наиболее склонны к образованию окрашенных соединений?