
Лекция _____ Арены. Строение молекулы. Методы получения. Химические свойства.
Ароматические углеводороды (у/в), арены – органические соединения карбоциклического ряда, молекулы которых содержат бензольное кольцо С6Н6 (моно- и полициклические функциональные производные бензола).
Бензол был открыт М.Фарадеем в 1825г., он же установил его формулу. В 1865 г. А. Кекуле предложил структурную формулу бензола, в которой в шестичленном кольце изобразил три чередующиеся =. Но это не истинно двойные связи, это только условное обозначение общих шести электронов, в одинаковой степени принадлежащих всем шести атомам углерода. Доказательствами отсутствия непредельности в ароматическом кольце являются следующие факты:
а) Алкены, содержащие =, обесцвечивают бромную воду и раствор KMnO4, бензол не обесцвечивает указанные растворы;
б) Для бензола характерны реакции замещения аналогично алканам, а не присоединения, как для алкенов;
в) Длина одинарной связи 0,154 нм, двойной связи - 0,134 нм. В бензоле длина всех связей одинаковая, равна 0,140 нм.
Вывод: В молекулах бензола нет чередования – и = связей, а есть «полуторная», особая связь. Атом С в молекуле бензола находится в Sp2–гибридном состоянии: 3 σ –связи, образованные перекрыванием трех гибридных орбиталей + единая π-электронная система, общая для всех атомов С.


Энергия связи С ---- С в ароматическом кольце равна 490 кДж/моль, т.е. имеет среднее значение между значениями энергий одинарной – и двойной = связи.
Что такое ароматичность? Это понятие не связано с запахом.
Под ароматичностью понимают совокупность особых свойств, характерных для некоторых циклических соединений, молекулы которых имеют плоскостное строение.
Главная причина ароматичности: единая замкнутая система π- электронов в кольце. Для этого необходимо, чтобы молекула была плоской.
Необходимо отметить, что в молекуле бензола нет чистых = и – связей. Молекула, в которой отрицательный заряд «размазан» более устойчива, чем та, в которой он сконцентрирован в одном месте. Поэтому молекула бензола устойчива.
Гомологический ряд бензола:
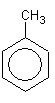 метилбензол
метилбензол  этилбензол
этилбензол  1,2-диметилбензол
1,2-диметилбензол
По JUPAC ароматические соединения рассматриваются как замещенные бензола.
Существуют тривиальные названия некоторых аренов:
 толуол
о-ксилол
толуол
о-ксилол
 м-ксилол
м-ксилол
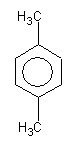 п-ксилол
п-ксилол
Названия некоторых ароматических радикалов: С6Н5– фенил, С6Н5–СН2– бензил, С6Н5–СН< бензилиден.
Изомеры
Для аренов существует изомерия положения заместителя в бензольном кольце.
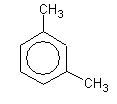 1,3-
диметилбензол
1,2-
диметилбензол
1,3-
диметилбензол
1,2-
диметилбензол
1,4-диметилбензол
Способы получения аренов
Ароматизация парафинов (алканов):

2-метилгексан толуол
Реакция Бертло:
3СН ≡СН t акт. уголь>С6Н6
Этин бензол
Дегидрирование циклоалканов ( метод Зелинского):
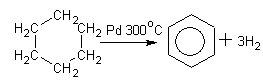
Циклогексан бензол
Реакция Вюрца – Фиттига (подобна алканам):
С6Н5Вr + 2Na + CH3Br → С6Н5 CH3 + 2 NaBr
бромбензол бромметан толуол
Целевой продукт реакции: С6Н5 CH3
Побочные продукты: С6Н5 - С6Н5 (дифенил) и CH3 - CH3 (этан).
В отличие от подобной реакции у алканов целевой и побочные продукты реакции можно легко разделить.
Реакция Фриделя-Крафтса –Густавсона (каализатор реакции AlCl3)

Бензол хлорэтан этилбензол
Реакция имеет большое промышленное значение для получения изопропилбензола:
С6Н6 + CH3–CH2–CH2Cl AlCl3> HCl + C6H5CH2CH2CH3 пропилбензол
бензол хлорпропан -->C6H5CH(CH3)2 изопропил бензол
Вместо галогенопроизводных можно использовать спирты. В этом случае катализаторами служат H2SO4 , HF, H3PO4.
6. Синтез из солей ароматических карбоновых кислот (при нагревании):
C6H5-COONa +NaOH t__>C6H6 + Na2CO3
Физические свойства ароматических углеводородов
Большая часть из них - жидкости, реже твердые вещества, имеющие специфический запах.
Плотность, показатель преломления, температура кипения выше, чем у прямоцепных углеводородов с одинаковым числом атомов углерода. Для сравнения: to кипения гексана равна 68,8оС, tº кипения бензола 80,1оС.
о –изомеры имеют более высокую температуру кипения, чем n –изомеры. Каждая СН2-группа увеличивает t кипения ~ на 30oC.
Ароматические углеводороды практически не растворимы в Н2О. Пары бензола токсичны.
о-, м-, п- ксилолы имеют близкие температуры кипения: о-ксилол 144,4о С, м-ксилол 139,1о С, n-ксилол 138,4oC. Такую смесь трудно разделить.
Химические свойства ароматических углеводородов
NB! Арены имеют склонность к реакциям замещения. Бензольное кольцо устойчиво к окислению.
1. Реакции электрофильного замещения
Подвижные π-электроны, образующие электронное облако, способны активно взаимодействовать с электрофильными реагентами (заряженными +).
Механизм реакции:
I стадия – образование электрофильной частицы А+ из реагента А : В путем гетеролитического распада молекулы.
А : В ----> А++ : В-
II стадия – взаимодействие электрофильной частицы А+ с π-электронным облаком
 π-комплекс
или
π-комплекс
или 
Особенность этой стадии в том, это частица А+ пока ещё не образует настоящей химической связи с определенным атомом С бензольного кольца; π – комплекс- неустойчив
III стадия – образование σ - комплекса

σ - комплекс
Для того, чтобы образовать химическую связь между частицей А+ и атомом С бензольного кольца, нужна пара электронов. Их предоставляют два соседних атома С. Один электрон отдаёт тот атом С, к которому присоединена частица А+, а другой - соседний атома С.У него появляется + заряд. Таким образом, ароматическая система оказывается разрушенной. Оставшиеся 4 электрона распределяются между 5 атомами С, между ними распределяется и + заряд. Молекула неустойчива, поэтому она вынуждена отдать Н+, чтобы вернуться в прежнее ароматическое состояние.
IV стадия – отщепление Н+ от σ – комплекса и возврат катализатора в исходную форму

Н+ +:В- ---> H –B
Примеры реакций электрофильного замещения (SE ) и их механизм:
а) Реакция хлорирования бензола:
С6Н6+Cl2 FeCl3> C6H5Cl+HCl хлорбензол
Механизм:
FeCl3+Cl2 <==> Cl++FeCl-4

H++FeCl4FeCl3+HCl
b) Реакция нитрования бензола:
С6Н6+HNO3 H2SO4>C6H5-NO2+H2O нитробензол
Механизм:
HNO3+H2SO4<==>NO+2+H3O++2HSO-4

H++HSO-4H2SO4
с) Реакция сульфирования бензола:
С6Н6+H2SO4 _____> C6H5-SO3H+H2O бензолсульфокислота
Механизм:
H2SO4+SO3<==> HSO+3+HSO-4

H++HSO-4H2SO4
d) Реакция алкилирования бензола олефинами, например, пропиленом:
С6Н6 + СН3 -CH2=СН2 → C6H5СН(СН3)2
Механизм:
H2SO4 ↔ H++HSO-4
δ+ δ-
СН3CH=СН2 +H+CH3-CH+-CH3

H++HSO-4H2SO4
2. Реакции присоединения
Протекают с трудом, при высокой температуре и в присутствии катализатора.
 циклогексан
циклогексан
h ν, 40ºC
С6Н6 + 3Cl2 ––––––––→ C6H6 Cl6 гексахлорциклогексан
3. Реакции окисления
NB!!! Бензол не окисляется KМnO4; Cr2O3.
Толуол окисляется KМnO4.
 бензойная
кислота
бензойная
кислота

терефталевая кислота
Независимо от длины боковой цепи при окислении образуются СООН-группы. В том случае, если в молекуле ароматического соединения есть несколько боковых радикалов, то их окисление происходит постепенно.
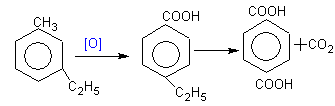
терефталевая к-та.
Лекция 9. Правила ориентации в бензольном кольце. Полициклические ароматические соединения.
Реакционная способность того или иного атома С в бензольном кольце определяется следующими факторами:
