
- •5. Примеры решения задач
- •Задача 1
- •1. Состав и температуру кипения азеотропной смеси.
- •Решение:
- •4. А) 3аданный массовый состав системы 80 кг hno3 и 20 кг h2о пересчитывается на мольный состав. Для этого определим число молей каждого компонента в системе:
- •Задача 2
- •1. Построение диаграммы
- •2. Анализ фазовых превращений
- •Задача 5
- •Решение:
- •Построение диаграммы
- •2) Расчет теплоты плавления
- •3)Расчет активности и коэффициента активности олова в расплаве.
Вариант
Расчетно-графическая работа по физической химии
«Фазовые равновесия в двухкомпонентных системах»
ЗАДАНИЕ 1
Дана зависимость составов жидкой фазы (хА,%) и находящегося в равновесии с ней пара (уА,%) от температуры кипения (Т) для двухкомпонентной системы ____________(А)–___________(В) при постоянном давлении р=1.01∙105 Н/м2, (составы фаз Х и Y выражены в мольных процентах компонента А).
ХА,% |
|
|
|
|
|
|
|
|
|
|
|
|
YА,% |
|
|
|
|
|
|
|
|
|
|
|
|
Т,К |
|
|
|
|
|
|
|
|
|
|
|
|
Построить диаграмму состояния «состав–температура кипения» для этой системы (по компоненту А) и по диаграмме определить:
Состав и температуру кипения азеотропной смеси.
2) Температуру закипания раствора а, содержащего _______мол.% вещества А, и состав первых появляющихся над ним пузырьков пара. При какой температуре жидкость полностью выкипит и каков будет состав исчезающих капель раствора?
Покажите на диаграмме, как в процессе кипения изменялся состав раствора и равновесного с ним пара. Определите вариантность системы до закипания, при кипении, после кипения.
3) Какой состав фаз имеет смесь а при температуре Т = ______? Какое количество вещества А будет в парах и жидкой фазе при этой температуре, если общая масса смеси ______кг?
4) На какие компоненты можно разделить смесь, содержащую _____кг вещества А в 100 кг раствора при дистилляции? Какой чистый компонент и в каком количестве можно при этом получить?
Какой компонент и в каком количестве необходимо добавить в эту смесь, чтобы она стала азеотропной?
5. Примеры решения задач
Задача 1
Дана зависимость составов жидкой фазы (xA) и находящегося в равновесии с ней пара (yA) от температуры кипения (Т) для двухкомпонентной системы HNO3(A) ─ Н2O(B) при постоянном давлении p=1,013∙105н/м2 (составы фаз выражены в мольных процентах компонента А).
xA, % |
0 |
8,4 |
12,3 |
22,3 |
30,8 |
38,3 |
40,2 |
46,5 |
53,0 |
61,5 |
100 |
yA, % |
0 |
0,6 |
1,8 |
6,6 |
16,6 |
38,3 |
60,2 |
75,9 |
89,1 |
92,1 |
100 |
T, K |
373 |
379,5 |
385 |
391,5 |
394,6 |
394,9 |
394 |
391 |
385 |
372 |
357 |
Построить диаграмму состояния "состав - температура" для этой системы и по диаграмме определить:
1. Состав и температуру кипения азеотропной смеси.
2. Температуру кипения раствора а, содержащего 55 мол.% вещества HNO3(A) и состав первых появляющихся над ним пузырьков пара. При какой температуре жидкость полностью выкипит и каков будет состав исчезающих капель раствора? Покажите на диаграмме, как в процессе кипения изменялся состав раствора и равновесного с ним пара. Определите вариантность системы до кипения, при кипении, после кипения.
3. Какой состав фаз имеет смесь а при температуре Т=388 К? Какое количество вещества HNO3(A) будет в парах и жидкой фазе при этой температуре, если общая масса смеси 2 кг?
4. На какие компоненты можно разделить смесь, содержащую 80 кг вещества HNO3 (А) в 100 кг раствора при ректификации? Какой чистый компонент и в каком количестве можно при этом получить?
5. Какой компонент и в каком количестве необходимо добавить в эту смесь, чтобы она стала азеотропной?
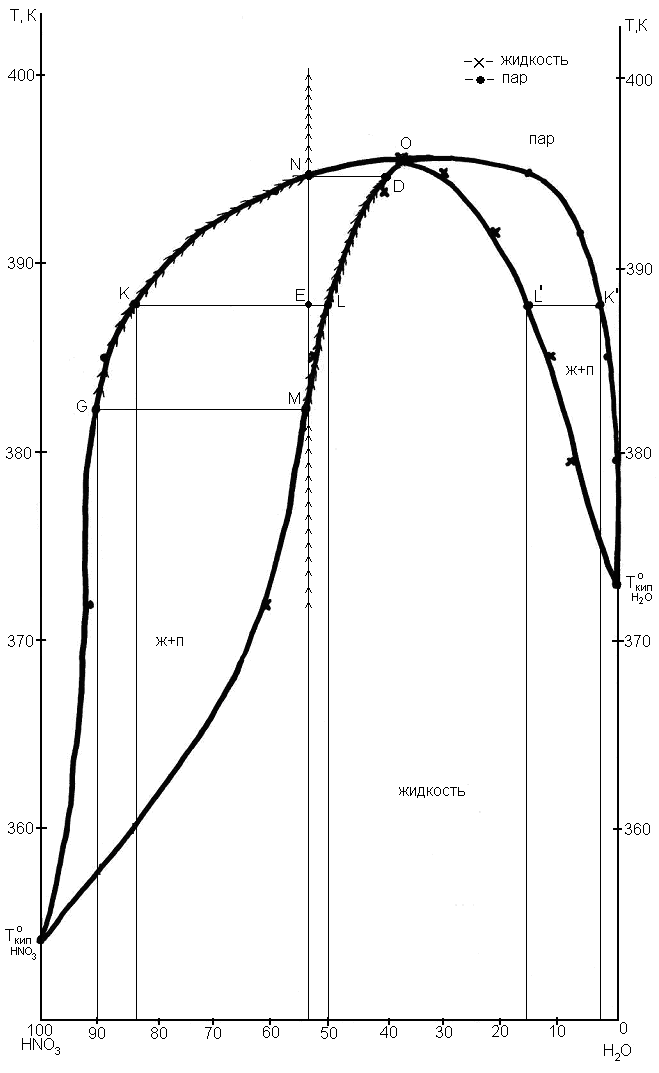
Рис.5.1. Диаграмма состояния «жидкость – пар» с экстремумом температуры
Решение:
На
основании приведенных в таблице значений
составов равновесных фаз и температур
строим двухфазную диаграмму состояния
жидкость – пар (диаграмму кипения).
Составы кипящей жидкой фазы лежат на
линии
![]() –MLDL'–
–MLDL'–![]() ─ это кривая жидкости (нижняя
кривая),
а составы насыщенного пара принадлежат
кривой пара ─ линия
–GKNOK'–
.
– нижняя
кривая.
─ это кривая жидкости (нижняя
кривая),
а составы насыщенного пара принадлежат
кривой пара ─ линия
–GKNOK'–
.
– нижняя
кривая.
Выше кривой пара все системы гомогенные, однофазные, находятся в состоянии пара. Ниже кривой жидкости все системы однофазные, гомогенные, находятся в жидком состоянии. Между кривыми жидкости и пара системы гетерогенны, содержат две фазы: жидкость и пар. Точки на кривой жидкости характеризуют составы жидкости и температуры начала кипения растворов заданного состава. Точки на кривой пара характеризуют составы насыщенного равновесного пара и температуры, при которых заканчивается процесс кипения.
Точка, в которой состав пара совпадает с составом жидкости, называется азеотропной.
1. Азеотропная смесь является нераздельно кипящей, т.е. это раствор, при испарении которого получается пар того же состава, что и исходная жидкая смесь, поэтому ее невозможно путем дистилляции разделить на чистые компоненты. Азеотропная смесь характеризуется постоянной температурой кипения и постоянным составом раствора в процессе кипения.
В данной системе азеотропная смесь (точка О) имеет состав 38,3 мольн.% HNO3 и соответственно 61,7 мольн.% Н2О, она кипит при температуре Ткип. = 394,9К.
2. а) Для определения температуры начала кипения раствора на диаграмме из точки, соответствующей заданному составу восстанавливается перпендикуляр до пересечения с линией жидкости (точка М). Эта точка соответствует температуре начала кипения указанного раствора. Раствор, содержащий 55 мольн.% HNO3 вплоть до Т=382,5 К остается гомогенным и при Т=382,5 К закипает. Состав первых порций пара устанавливается отрезком изотермы [MG], проведенным в двухфазной области до пересечения с линией пара (точка G), т.к. фазы, находящиеся в равновесии должны иметь одинаковую температуру. Этот отрезок изотермы называется коннодой. Коннода показывает, что первый пузырек пара содержит 90 мол.% компонента HNO3 и 10 мол.% H2О. Состав пара беднее компонентом H2О, чем жидкость. Из жидкости в пар преимущественно уходит HNO3, отсюда жидкая фаза обедняется этим компонентом и ее состав меняется в процессе кипения, как это показано стрелками на рис.5.1 (кривая MLD). Вместе с изменением состава кипящей жидкости меняется и состав пара, находящегося с ней в равновесии (кривая GKN). Изменения состава жидкости, пара и температуры фазового равновесия будут происходить до тех пор, пока состав пара не станет равным составу исходной жидкости.
При температуре 394,4 К, соответствующей точке пересечения перпендикуляра [MN] с кривой пара (точка N) молярный состав пара будет равен исходному (55 мол.% HNO3 и 45 мол.% Н2О), вся жидкость превратится в пар и закончится процесс кипения. Молярный состав последней капли жидкости устанавливается коннодой [ND] и он равен 39,7 мол.% HNO3 и соответственно 60,3 мол.% Н2О. При дальнейшем нагревании состав пара меняться не будет.
б) Охлаждение системы на диаграмме кипения отражается изменением фазового состояния системы в обратной последовательности. При Т=394,4K начинается конденсация системы, появляются первые капли жидкости (точка O) и при Т=382,5 К конденсация заканчивается, исчезают последние порции пара (точка G).
в) Для определения вариантности системы воспользуемся правилом фаз Гиббса [С=К─Ф+1 (p-const)]. Для двухкомпонентной системы: С=3─Ф. До кипения и после кипения, когда система является гомогенной, т.е. однофазной С=2. В этом случае независимо можно менять в определенных пределах оба параметра (состав и температуру), не меняя числа и вида фаз. С момента начала кипения и до конца кипения система является двухфазной и С=1, независимо можно выбрать только один параметр, например, температуру, тогда состав фаз определяется по кривым жидкости и пара.
3. а) Для определения равновесного состава жидкости и пара при Т=383К проводится изотерма, соответствующая этой температуре. Для данной диаграммы при Т=388К изотерма дважды пересекает двухфазную область и можно выделить две конноды [LK] и [L'K']. Пересечение конноды с кривой жидкости дает состав жидкой фазы, который определяется по оси абсцисс. Пересечение конноды с кривой насыщенного пара дает состав пара.
Все системы отвечающие конноде [L'K'] двухфазны и имеют состав жидкости (L') 16,3 мол.% HNO3 и соответственно 83,7 мол.% Н2O, другая фаза ─ насыщенный пар (точка К') с содержанием HNO3 3,0 мол.% и 37,0 мол% Н2О.
Все системы, отвечающие конноде [LK], также содержат две равновесные фазы. Одна фаза ─ жидкость (точка L) состава 50 мол.% HNO3 и соответственно 50мол.% Н2О, другая - насыщенный пар (точка К) с содержанием HNO3 85,0 мол.% и 15,0 мол% Н2О.
б)
Система
с молярным содержание HNO3
55
мол.%
при Т=388К
лежит
на конноде [LK]
(точка
Е)
и имеет состав фаз, указанный выше:
(точки L
и
К).
Рассчитаем количество веществ, находящихся
в жидкой и паровой фазах, по
правилу рычага.
Сначала
определим количество молей вещества,
которое содержится в системе массой 2
кг.
Для этого вычислим среднюю молекулярную
массу системы с мольным содержанием
![]() .
.
![]() .
.
В 2 кг системы содержится: n = 2000/Мср = 2000/42,75 = 46,78 моль,
где: n ─ общее количество молей в системе.
По правилу рычага количество пара так относится к количеству жидкости (рис.5.1), как отрезок EL относится к отрезку КЕ. Отсчитываем составы в мольных процентах:
nпара/nжид = EL/KE = (55-50)/(85 -55 )= 1/6
где: nпара ─ число молей пара (1 часть), nжид ─ число молей жидкости (6 частей) общее количество молей n = 46,78 моль (7 частей).
Тогда:
nпара = 46,78 1/7 = 6,68 моль
nжид = 46,78 6/7 = 40,1 моль (nжид. = n─nпар.).
Отсюда, с учетом того, что xi ─ мольные доли компонентов в соответствующих фазах, а Mi ─ их молярные массы, масса компонентов в паре и жидкости (gi) вычисляется следующим образом:
|
|
|
|
В сумме получим: 357,7+1263,15+18,04+361,9=2000 г
