
- •Методическое указание по физической химии «Обратимые электроды и электролиз»
- •Теоретическая часть.
- •Термодинамика гальванического элемента.
- •Электроды второго рода. Каломельный и хлорсеребряный электроды.
- •Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
- •Ионообменные электроды. Стеклянный электрод.
- •Электрохимические реакции.
- •Скорость электрохимических процессов
- •Понятие об электродной поляризации
- •Концентрационная и химическая поляризация
- •Электролиз.
- •Экспериментальная часть.
- •1.Приготовление хлорсеребряного электрода и измерение его потенциала.
- •2.Приготовление электродов I рода и измерение их потенциалов.
- •Контрольные вопросы.
- •Список используемой литературы.
Экспериментальная часть.
1.Приготовление хлорсеребряного электрода и измерение его потенциала.
Хлорсеребряный электрод широко используется в качестве электрода сравнения. Он состоит из серебряной проволоки, покрытой слоем АgСl,помещенной в раствор КС1 определенной концентрации. На электроде устанавливается равновесие:
AgCl + e- ↔ Ag + Cl-
Потенциал электрода Аg|AgCl|Cl- определяется уравнением:
![]()
Для разбавленных растворов при 180 С:
![]()
Целью данной работы является приготовление хлорсеребряного электрода и измерение его потенциала в растворах KCl различной концентрации (0,0001н – 0,1н).
Берут серебряную проводку и покрывают ее на поверхности слоем хлористого серебра. Для этого серебряную проволоку подвергают анодной поляризации в 0,1н КС1 от 2-х вольтного аккумулятора в течении 15 минут. В результате анодного растворения серебра на поверхности электрода образуется осадок АgCl одновременно происходит выделение газообразного хлора, который частично остается в адсорбированном состоянии на поверхности электрода. Для удаления следов хлора электрод со свежеобразованным осадком АgCl, одновременно происходит выделение газообразного хлора, который частично остается в адсорбированном состоянии на поверхности электрода. Для удаления следов хлора электрод со свежеобразуемым осадком АgС1 необходимо подвергнуть катодной поляризации в том же самом сосуде, но с новой порцией раствора KС1 ,соединив его с отрицательным полюсом аккумулятора. Электролиз идет так же в течении 15 минут. После этого хлорсеребряный электрод промывается дистиллированной водой и помещается в электродный сосуд, рис.3.
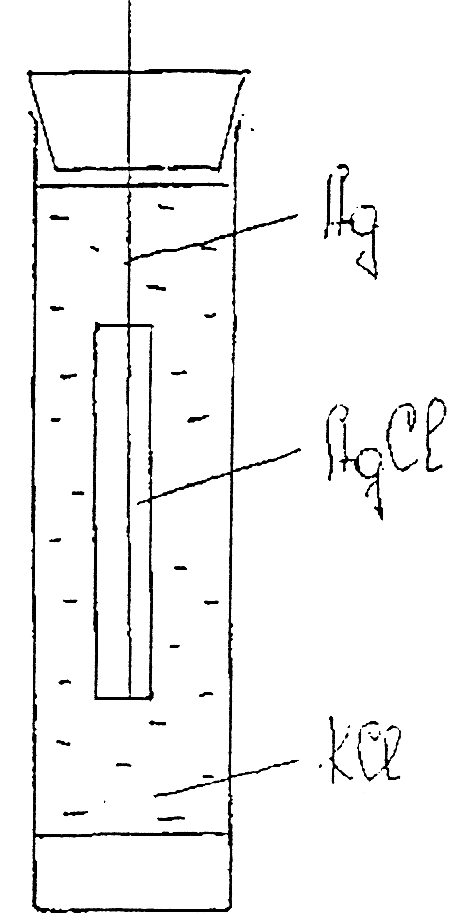 Рис. 3 Хлорсеребряный
электрод.
Рис. 3 Хлорсеребряный
электрод.
Для измерения электродного потенциала хлорсеребряного электрода составляют гальваническую цепь:
Ag| AgCl + KCl | KCl | HCl+KCl, хингидрон | Pt
насыщ. стандартный раствор.
Хлорсеребряный электрод помещают в стаканчик с насыщенным раствором хлористого калия вместе с хингидронным электродом. Измерение э.д.с. проводится компенсационным методом.
Измеренная э.д.с. ЕХ = ЕИЗМ равна
Еизм = Екатода - Еанода
Еизм = Ехин – ЕAg/AgCl/Cl-
Отсюда
ЕAg/AgCl/Cl- = Ехин - Еизм
где Ехин = Е0хин – 0,058рН (при t = 180C)
Если для хингидронного электрода был взят раствор Вейбеля с рН = 2,04, то его потенциал при 18°С:
Ехин = 0,6994 - 0.058 * 2.4 = 0.58В
Поэтому потенциал хлорсеребряного электрода будет равен:
ЕAg/AgCl/Cl- = 0.58 – Еизм
Измерять ЕAg/AgCl/Cl следует в растворах пяти концентраций (от 0.0001н до 0.1н), причем следует идти от разбавленных растворов к концентрированным. Результаты измерения записать в таблицу:
Концентрация НСl, н |
Еизм, В |
ЕAg/AgCl/Cl В |
0,00001 |
|
|
0,0001 |
||
0,001 |
||
0,01 |
На
основании полученных данных строится
график зависимости ЕAg/AgCl/Cl
от логарифма концентрации хлористого
калия и определяется значение коэффициента
наклона прямой
 и сравнивается с теоретическим значением
и сравнивается с теоретическим значением
![]() .
.
Необходимые приборы и реактивы: потенциометр для измерения э.д.с., серебряная проволока, Рt - электрод, аккумулятор на 2 В, 0.1 н раствор КСl, насыщенный раствор КС1.
