
- •Методическое указание по физической химии «Обратимые электроды и электролиз»
- •Теоретическая часть.
- •Термодинамика гальванического элемента.
- •Электроды второго рода. Каломельный и хлорсеребряный электроды.
- •Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
- •Ионообменные электроды. Стеклянный электрод.
- •Электрохимические реакции.
- •Скорость электрохимических процессов
- •Понятие об электродной поляризации
- •Концентрационная и химическая поляризация
- •Электролиз.
- •Экспериментальная часть.
- •1.Приготовление хлорсеребряного электрода и измерение его потенциала.
- •2.Приготовление электродов I рода и измерение их потенциалов.
- •Контрольные вопросы.
- •Список используемой литературы.
Ионообменные электроды. Стеклянный электрод.
К ионообменным относят такие электроды, которые состоят из двух фаз: ионита и раствора, а потенциал на границе раздела фаз возникает за счет ионообменного процесса, в результате которого поверхности ионита и раствора приобретают электрические заряды противоположного знака. Иониты обладают повышенной избирательной способностью по отношению к определенному виду ионов, находящихся в растворе, поэтому электроды называют также ионоселективными. Известны ионоселективные электроды, обратимые относительно ионов натрия, калия, кальция и др.
Стеклянный электрод (рис.5) Аg | АgСl | НС1 (с = 0,1 моль/л) | стекло | Н + является важнейшим представителем группы ионообменных (ионоселективных) электродов. Он представляет собой тонкостенный шарик из специального сорта токопроводящего стекла, наполненный раствором НС1 концентрации 0,1 моль/л. В раствор НС1 погружен вспомогательный хлорсеребряный электрод, который служит внешним выводом к одному из полюсов прибора для измерения потенциала. Стеклянный электрод помещают в исследуемый раствор с неизвестной концентрацией определяемых ионов, в который помещают также электрод сравнения (хлорсеребряный или каломельный). Электрод сравнения присоединяют к другому полюсу. Таким образом, гальванический элемент, в котором один из электродов стеклянный, включает два электрода сравнения (внутренний и внешний).
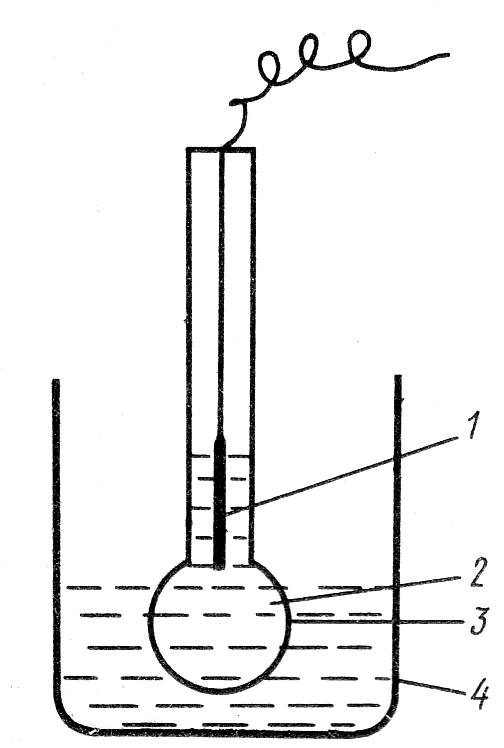
Рис.5 Стеклянный электрод.
1 – внутренний электрод, 2 – внутренний раствор- 0,1М раствор HCl 3 – стеклянная мембрана,
4 – сосуд с исследуемым раствором.
Потенциал стеклянного электрода:
![]()
Преимущества стеклянного электрода заключаются в том, что при измерении рН растворов не вводятся посторонние вещества (водород или хингидрон), потенциал не зависит от присутствия окислителей или восстановителей, равновесный потенциал устанавливается быстро, электрод не отравляется и пригоден для исследования мутных и окрашенных растворов.
По принципу применения электроды делят на индикаторные и электроды сравнения. Индикаторными называют электроды, потенциал которых однозначно меняется с изменением концентрации определяемых ионов (например, электроды Ag° | Аg+; Сu0 | Сu2+; Zn° | Zn2+; (Рt)Н2 | Н+; Рt | X, Н2Х, Н+ и др.). Индикаторный электрод должен быть обратимым по отношению к определяемым ионам. Электродами сравнения называют такие электроды, потенциал которых известен, точно воспроизводим и не зависит от концентрации определяемых ионов, т. е. остается постоянным во время измерений. К электродам сравнения относят стандартный водородный электрод, хлорсеребряный и каломельный электроды. Применяемые на практике электроды сравнения должны быть легки в эксплуатации.
Электрохимические реакции.
Если в электрохимической цепи протекает электрический ток, то она находится в неравновесном состоянии. В цепи идет электрохимическая реакция с конечной скоростью в одном определенном направлении. В неравновесных условиях свойства электрохимических систем отличаются от свойств соответствующих равновесных систем. Отличия заключаются в следующем.
Скорость электрохимической реакции в анодном и катодном направлениях не одинакова.
Масса электродов и состав растворов вблизи них изменяются по сравнению с состоянием равновесия.
Потенциал электрода φ под током не равен равновесному электродному потенциалу, а поэтому и значение напряжения отличается от обратимого значения ЭДС. Величины φ и Е зависят не только от природы системы, ее температуры и давления, но и от силы тока. Таким образом, для неравновесной электрохимической цепи должна существовать определенная связь между силой тока и значением ЭДС.
Изменение массы электродов и состава растворов вблизи них под действием электрического тока свидетельствует о наличии химических превращений. Следовательно, должна существовать определенная зависимость между количеством электричества и массой прореагировавших веществ. Эта зависимость выражается законами Фарадея (1833—1834).
Первый закон: количество (т) вещества, выделяющееся при электролизе на электроде, прямо пропорционально количеству электричества, прошедшего через электролит (q):
m=kЭ q (13)
где kЭ — электрохимический эквивалент, который равен массе превращенного вещества при протекании единицы количества электричества (г/Кл). Его физический смысл можно установить, если принять q=1 Кл. Тогда m = k, т.е. коэффициент k представляет собой количество вещества (г), выделяемого на электроде при пропускании 1 Кл электричества.
Второй закон: при прохождении через различные электролиты одного и того же количества электричества массы различных веществ, участвующих в электродных реакциях, пропорциональны их химическим эквивалентам Э;
m1:m2:m3 = Э1:Э2:Э3 (14)
Количество электричества в кулонах (Кл) равно произведению силы тока (в амперах) на время (в секундах):
q = Iτ
Подставив значение q в уравнение (13), получаем:
m = kIτ (15)
Для выделения 1 г-экв любого вещества (Э) требуется пропустить через электролит одно и то же количество электричества, равное приблизительно 96 500 Кл. Из пропорции Э : 96 500 = k : 1 можно определить величину электрохимического эквивалента:
![]()
Подставив значение k в выражение (15), получим объединенную формулу двух законов Фарадея:
![]()
Количество вещества, выделившегося на электродах при электролизе, прямо пропорционально количеству прошедшего электричества и химическому эквиваленту данного вещества.
Из второго закона следует, что для электрохимического превращения одной молярной массы эквивалента (моль) любого вещества требуется одинаковое количество электричества. Это количество электричества равно числу F, называемому постоянной Фарадея: F= 96485 (≈96500) Кл/моль.
Законы Фарадея являются общими и точными законами электрохимии. Однако в большинстве случаев электрохимическому изменению подвергается меньшая масса данного вещества по сравнению с тем, которое можно ожидать по закону Фарадея. Такое кажущееся отступление от законов Фарадея объясняется тем, что превращению подвергается не одно вещество, а несколько веществ. Поэтому на данное вещество приходится доля эквивалента.
Чтобы учесть влияние побочных реакций, было введено понятие выхода по току АI. Выход по току — это часть протекшего количества электричества, приходящаяся на долю данной электрохимической реакции:
AI
=
![]() ,
или в % AI
=
100
(16)
,
или в % AI
=
100
(16)
где qi — количество электричества, расходуемое на данную реакцию; ∑qi — общее количество прошедшего электричества.
Если из нескольких возможных процессов желателен только один, то выход по току должен быть высоким. Системы, в которых весь ток расходуется только на одну электрохимическую реакцию, используются в приборах — кулонометрах, применяемых для измерения количества прошедшего электричества.
