
- •Методическое указание по физической химии «Обратимые электроды и электролиз»
- •Теоретическая часть.
- •Термодинамика гальванического элемента.
- •Электроды второго рода. Каломельный и хлорсеребряный электроды.
- •Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
- •Ионообменные электроды. Стеклянный электрод.
- •Электрохимические реакции.
- •Скорость электрохимических процессов
- •Понятие об электродной поляризации
- •Концентрационная и химическая поляризация
- •Электролиз.
- •Экспериментальная часть.
- •1.Приготовление хлорсеребряного электрода и измерение его потенциала.
- •2.Приготовление электродов I рода и измерение их потенциалов.
- •Контрольные вопросы.
- •Список используемой литературы.
Электроды второго рода. Каломельный и хлорсеребряный электроды.
Электроды второго рода состоят из металла, труднорастворимой соли этого металла и второго соединения, хорошо растворимого и с тем же анионом, что и первое соединение. Условное обозначение таких электродов М | МА | Аz-. Представителями электродов второго рода являются хлорсеребряный и каломельный электроды. Благодаря простоте изготовления и отличной воспроизводимости потенциала их широко применяют в качестве электродов сравнения при составлении разнообразных гальванических элементов, а также вместо СЭВ при определении потенциалов других электродов.
Хлорсеребряный электрод Аg | АgСl | КС1 (рис. 3) представляет собой серебряную проволоку, покрытую слоем АgС1, опущенную в насыщенный раствор КС1, находящийся в сосуде с микрощелью для контакта с исследуемым раствором.
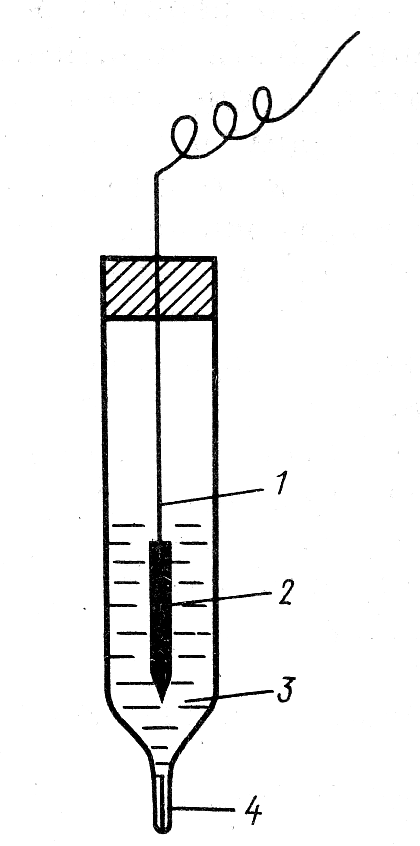 Рис.
3. Хлорсеребряный электрод
Рис.
3. Хлорсеребряный электрод
1 – серебряная проволока,
2 – слой AgCl,
3 – раствор AgCl,
4 – микрощель.
Основному химическому процессу
Ag+ + e-↔Ag
сопутствует реакция растворения или осаждения соли АgС1:
AgCl ↔ Ag+ + Cl-
Суммарный процесс
AgCl + e- ↔ Ag0 + Cl-
определяет вид уравнения для расчета потенциала электрода, обратимого относительно аниона:
![]()
Потенциал хлорсеребряного электрода с насыщенным раствором KCl равен 0,23 В при 25 0С.
Каломельный электрод (Рt)Нg° | Нg2Cl2 | КС1 (рис.4) представляет собой смесь Нg° и Нg2Сl2, помещенную в сосуд, в дно которого впаяна платина, приваренная к медному проводнику. С целью изоляции на медную проволоку надевают стеклянную трубочку, которую припаивают к сосуду и в которой проволоку закрепляют неподвижно. Платина в каломельном электроде служит переносчиком электронов. В сосуд наливают ртуть, так чтобы платина была ею покрыта. На ртуть помещают пасту, полученную растиранием ртути с каломелью в насыщенном растворе КСl, а затем насыщенный раствор КСl. Сосуд закрывают пробкой с отверстием для солевого мостика.
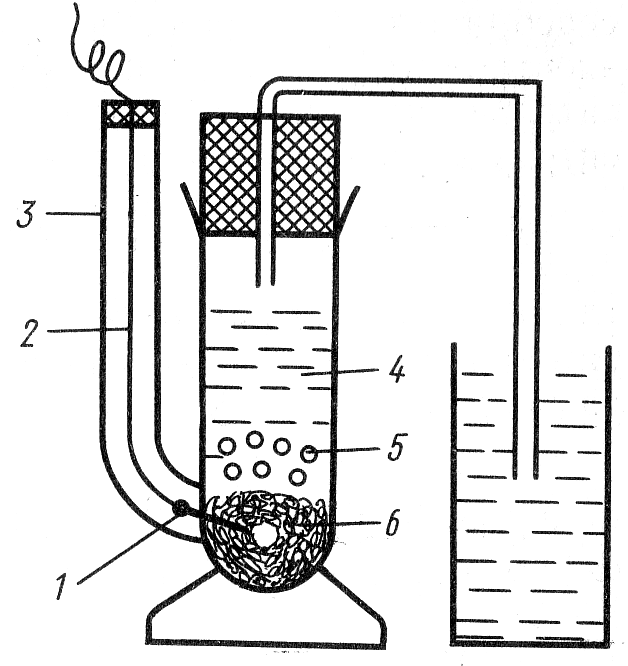
Рис. 4 Каломельный электрод.
1 – платина, 2 – медный проводник,
3 – стеклянная трубка, 4 – раствор
5 – паста, 6 – ртуть.
В соответствии с потенциалопределяющим процессом
Hg2Cl2 + 2e-↔ 2Hg0 + 2Cl-
выражение для потенциала каломельного электрода имеет вид
![]()
Потенциал каломельного электрода с насыщенным раствором КС1 равен 0,242 В при 25 °С.
Окислительно-восстановительные электроды (редокс-электроды). Хингидронный электрод.
Поскольку все потенциалопределяющие процессы протекают с участием электронов, каждый электрод может быть назван окислительно-восстановительным. Однако окислительно-восстановительными условились называть такие электроды, металл которых не принимает участия в окислительно-восстановительной реакции, а является только переносчиком электронов, процесс же окисления — восстановления протекает между ионами, находящимися в растворе. Схему электрода и уравнение потенциалопределяющего процесса записывают в виде
(Pt) | Ox, Red; Ox + ze-↔Red
где Ох и Red — условные обозначения окисленной и восстановленной форм вещества. Отсюда появилось название редокс-электроды. Наиболее широко применяемым редокс - электродом является хингидронный электрод.
Хингидронный электрод Рt | С6Н4О2, С6Н4(ОН)2, Н+ или (Рt) | X, Н2Х, Н+ состоит из платиновой пластинки (или проволоки), погруженной в насыщенный раствор хингидрона. Последний представляет собой комплексное соединение, образованное из хинона С6Н4О2 (X) и его восстановленной формы С6Н4(ОН)2(Н2Х) гидрохинона. При диссоциации хингидрона Н2Х•Х ↔ Н2Х + Х образуется эквимолекулярная смесь хинона и гидрохинона. Хингидрон трудно растворим в воде и в кислых растворах, поэтому легко получается насыщенный раствор. Достаточно добавить 0,1 — 0,2 г на 20 мл исследуемого раствора.
На хингидронном электроде протекает реакция
С6Н4О2 + 2Н+ + 2е- ↔ С6Н4(ОН)2,
которой соответствует выражение для потенциала
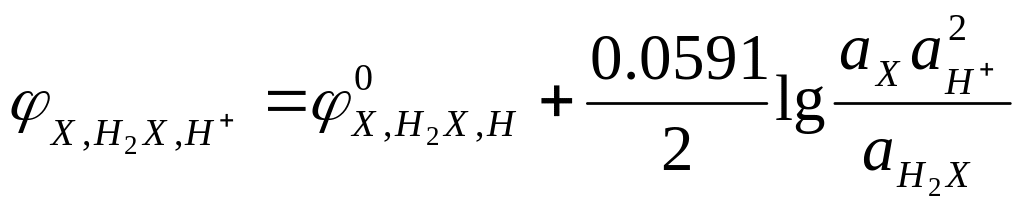 (12)
(12)
Если принять, что коэффициенты активности хинона и гидрохинона равны, то активности хинона и гидрохинона будут одинаковы. В связи с этим уравнение (12) упрощается:
![]()
Стандартным
потенциалом хингидронного электрода
(![]() )
называют потенциал электрода с
)
называют потенциал электрода с
![]() .
Потенциал хингидронного электрода
равен 0,699 В при 25 °С.
.
Потенциал хингидронного электрода
равен 0,699 В при 25 °С.
Хингидронный электрод очень удобен в применении благодаря простоте устройства и устойчивости потенциала, однако он имеет недостаток: его нельзя применять для исследования щелочных растворов и в присутствии посторонних окислителей и восстановителей.
