- •Химическая связь и взаимное влияние атомов в органических соединениях.
- •Химическая связь в органических соединениях.
- •Электронное строение и валентные состояния атома углерода.
- •Делокализованная химическая связь. Сопряжение.
- •Циклические сопряженные системы. Ароматичность.
- •1.4. Водородная связь в органических соединениях
- •Взаимное влияние атомов в органических соединениях.
- •2.1. Индуктивный эффект
- •Мезомерный эффект
- •Кислотные и основные свойства органических соединений
- •Классификация органических кислот и оснований
- •3. Кислоты и основания Льюиса
- •Классификация органических реакций и реагентов
Химическая связь и взаимное влияние атомов в органических соединениях.
План
Химическая связь в органических соединениях.
Электронное строение и валентные состояния атома углерода.
Делокализованная химическая связь. Сопряжение.
Циклические сопряженные системы. Ароматичность.
Водородная связь.
Взаимное влияние атомов в органических соединениях.
Индуктивный эффект.
Мезомерный эффект.
Химическая связь в органических соединениях.
Согласно классической теорией химического строения Бутлерова атомы в молекулах органических соединений соединяются в соответствии с их валентностью, а химические и физические свойства соединений определяются не только природой и числом входящих в их состав атомов, но и типом связей и взаимным влиянием непосредственно несвязанных атомов.
В дальнейшем теория химического строения была расширена и уточнена Льюисом, предложившим теорию электронного строения органических соединений. Согласно этой теории ковалентная связь образуется за счет пары электронов, общей для двух связываемых атомов. Молекула устойчива, если валентная оболочка элементов первого периода (Н) содержит не более двух, а элементов второго периода (C, N, O, F) - не более восьми электронов (правило октета).
Современные теории ковалентной связи основаны на представлениях квантовой механики. Для описания химической связи в органических соединениях в настоящее время используют две основные теории: метод молекулярных орбиталей и метод валентных связей, основные положения которых уже были рассмотрены в курсе общей химии.
Электронное строение и валентные состояния атома углерода.
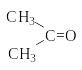
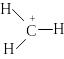
Для органических соединений характерны ковалентные неполярные связи С-С и С-Н и ковалентные полярные связи С-О, С-N, C-Hal.
А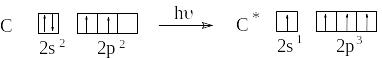 том
углерода в возбужденном состоянии
содержит четыре неспаренных электрона
на внешнем энергетическом уровне и
способен образовать четыре ковалентных
связи:
том
углерода в возбужденном состоянии
содержит четыре неспаренных электрона
на внешнем энергетическом уровне и
способен образовать четыре ковалентных
связи:
Для атома углерода характерно три валентных состояния.
Первое валентное состояние – sp3-гибридизация. В результате гибридизации с участием одной s и трех p орбиталей атома углерода образуются четыре эквивалентные sp3-гибридные орбитали, направленные к вершинам тетраэдра под углами 109,5о:
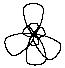
В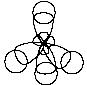 состоянии sp3-гибридизации
атом углерода образует четыре s-связи
с четырьмя заместителями и имеет
тетраэдричекую конфигурацию с валентными
углами, равными или близкими 109,5о:
состоянии sp3-гибридизации
атом углерода образует четыре s-связи
с четырьмя заместителями и имеет
тетраэдричекую конфигурацию с валентными
углами, равными или близкими 109,5о:
Метан
В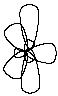 торое
валентное состояние – sp2-гибридизация.
В результате
гибридизации с участием одной s- и двух
p-орбиталей атома углерода образуются
три эквивалентные sp2-гибридные
орбитали, лежащие в одной плоскости под
углами 120о,
а не участвующая в гибридизации p-орбиталь
расположена перпендикулярно плоскости
гибридных орбиталей:
торое
валентное состояние – sp2-гибридизация.
В результате
гибридизации с участием одной s- и двух
p-орбиталей атома углерода образуются
три эквивалентные sp2-гибридные
орбитали, лежащие в одной плоскости под
углами 120о,
а не участвующая в гибридизации p-орбиталь
расположена перпендикулярно плоскости
гибридных орбиталей:
В![]() состоянии sp2-гибридизации
атом углерода образует три s-связи
за счет гибридных орбиталей и одну
p-связь
за счет не участвующей в гибридизации
p-орбитали и имеет три заместителя:
состоянии sp2-гибридизации
атом углерода образует три s-связи
за счет гибридных орбиталей и одну
p-связь
за счет не участвующей в гибридизации
p-орбитали и имеет три заместителя:
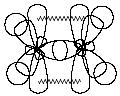
Этилен
Третье валентное состояние углерода – sp-гибридизация. В результате гибридизации с участием одной s- и одной p – орбитали образуются две эквивалентные sp-гибридные орбитали, лежащие под углом 1800, а не участвующие в гибридизации p-орбитали расположены перпендикулярно плоскости гибридных орбиталей и друг другу:
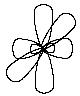
В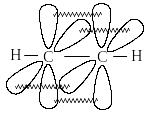 состоянии sp-гибридизации атом углерода
образует две s-связи
за счет гибридных орбиталей и две p-связи
за счет не участвующих в гибридизации
p-орбиталей и имеет два заместителя:
состоянии sp-гибридизации атом углерода
образует две s-связи
за счет гибридных орбиталей и две p-связи
за счет не участвующих в гибридизации
p-орбиталей и имеет два заместителя:
- Cº =C=
HCºCH
ацетилен
Таблица 4. Зависимость структуры соединений от типа гибридизации углерода.
Тип гибридизации |
Число заместителей |
Геометрия и валентный угол |
Примеры |
sp3 |
4 |
Тетраэдрическая 109,5 |
CH4, CCl4, CH3OH
|
sp2 |
3 |
Тригональная
120 |
CH2=CH2,
|
sp |
2 |
Линейная 180 |
HCºCH CH3CºN O=C=O CH2=C=O
|