
«Ученые создали искусственный фотосинтез»
Американские ученые разработали фотоэлемент размером с игральную карту, который имитирует процесс фотосинтеза у растений. Об этом сообщается в пресс-релизе American Chemical Society.
Изготовленное из кремния и покрытое катализаторами устройство помещается в 4-литровую емкость, которую выставляют на яркий солнечный свет. В результате происходит реакция разложения воды на водород и кислород. Оба эти компонента попадают в топливные элементы, где и происходит преобразование химической энергии в электрическую.
По словам разработчиков, в отличие от других представленных ранее «искусственных листов» новое устройство создано из дешевых материалов, кроме того оно может проработать в течение 45 часов без снижения эффективности. Особенность прототипа – в использовании недорогих катализаторов, изготовленных из никеля и кобальта.
«Инновация усовершенствует искусственный фотосинтез»
Открытие позволит улучшить фотоэлектрохимические батареи. Последние используют солнечный свет тем же образом, что и клетки растений — преобразуя его в энергию. Процесс сопровождается химическими реакциями, в результате которых из воды выделяется водород.
Процесс включает использование светочувствительного полупроводника, такого как оксид меди, чтобы обеспечить ток, необходимый для реакции. Хотя соединение не является дорогим, оно нестабильно, особенно если подвергается воздействию света в воде. Исследование, проведенное Адрианой Параччино и Элиахом Тимсеном, опубликовано в издании Nature Materials. Оно показало, что проблему можно преодолеть, покрыв полупроводник тонким слоем атомов с использованием технологии осаждения атомных слоев.
Под наблюдением профессора Майкла Гратцеля в Лаборатории фотоники и интерфейсов EPFL ученые совершили замечательное открытие, комбинируя методы, используемые в промышленных масштабах, и затем применив их к проблеме производства водорода. После описываемого процесса оксид меди просто и эффективно огражден от контакта с водой, что вполне позволяет использовать его в качестве полупроводника. Преимуществ масса: оксид меди, как уже указывалось, недорог и достаточно широко распространен; защитный слой абсолютно непроницаем вне зависимости от состояния поверхности; процесс легко можно реализовать в промышленных масштабах.
Исследовательская группа разработала метод, «вырастив» слой оксида цинка и оксида титана толщиной в атом на поверхности оксида меди. С использованием технологии осаждения атомных слоев ученые сумели легко регулировать толщину защитного слоя с точностью до одного атома по всей поверхности. Подобный уровень точности гарантирует стабильность и эффективность полупроводника. Следующим шагом исследования будет совершенствование электрических свойств защитного слоя.
«Превращение солнечного света в жидкие топлива сейчас на шаг ближе»
В течение миллионов лет, зеленые растения использовали фотосинтез, чтобы захватить энергию от солнечного света и преобразовать её в электрохимическую энергию. Цель ученых состояла в том, чтобы развить искусственную версию фотосинтеза, который можно будет воспользоваться, чтобы произвести жидкие топлива от углекислого газа и воды. Исследователи с Лоренсом Беркелеем американского Министерства энергетики, Национальная Лаборатория (Лаборатория Беркли) сделали важный шаг к этой цели открытием, что кристаллы наноразмера окиси кобальта могут эффективно выполнить важную фотосинтетическую реакцию расщепления молекул воды.
“Фотоокисление водных молекул в кислород, электроны и протоны (водородные ионы) - одна из двух существенных половин реакций искусственной системы фотосинтеза, которая обеспечивает, что электроны должны были уменьшить углекислый газ до топлива”,
сказал Хеинз Фрей, химик с Физическим Разделением Биологических наук Лаборатории Беркли, который провел это исследование с его постдокторским товарищем Фенгом Джиао. “Эффективное фотоокисление требует катализатора, который является и результативным в его использовании солнечных фотонов и достаточно быстро протекает вместе с солнечным потоком, чтобы избежать пустую трату фотонов. Группы окиси кобальта нанокристаллы достаточно эффективны и быстры, а также работоспособны длительное время и производительны. Они совершенно работоспособны.”
Фрей и Джиао сообщили о результатах их исследования в журнале Angewandte Chemie. Это исследование было выполнено через Исследовательский центр Энергии Солнца (Helios SERC), научная программа в Лаборатории Беркли под руководством Пола Аливизатоса, который нацелен на развитие топлив от солнечного света. Фрей работает представителем директора Helios SERC.
Искусственный фотосинтез для производства жидких топлив предлагает обещание возобновляемого и углеродистого-нейтрального источника энергии транспортировки, означая, что это не внесло бы свой вклад в глобальное потепление, которое следует из горения нефти и угля. Идея должна улучшить процесс, который долго-служил зеленым заводам и определенным бактериям, объединяя в единственные системы легкого сбора урожая платформы, которые могут захватить солнечные фотоны и каталитические системы, окисляющие воду - другими словами, искусственный лист.
“Чтобы использовать в своих интересах гибкость и точность, которой легким поглощением, частотой товарооборота и каталитическими свойствами можно управлять дискретными неорганическими молекулярными структурами, мы работали с многоядерной металлической окисью нанокластера в кварце”, сказал Фреи. “В более ранней работе, мы нашли, что иридиевая окись была эффективна и достаточно быстра, чтобы сделать работу, но иридий - наименее обильный металл на земле и не подходящий для использования на очень крупном масштабе. Мы нуждались в металле, который был одинаково эффективен, но намного более производителен”.
Зеленые растения выполняют фотоокисление водных молекул в пределах комплекса белков по имени Фотосистема II, в котором содержащий марганцом ферменты служат катализатором. Металлоорганические комплексы на основе марганца, смоделированные от Фотосистемы II показали некоторое обещание как фотокатализаторы для водного окисления, но некоторые страдают от того, что они нерастворимы в воде, поэтому их почти не используют.
В поиске просто неорганических катализаторов, которые распались бы в воде и были бы намного более работоспособными, чем биоматериалы, Фреи и Джиао, использовали превращенный к окиси кобальта, очень производительный материал, который является важным индустриальным катализатором. Когда Фреи и Джиао проверили частицы размера микроном окиси кобальта, они нашли, что частицы были неэффективны и не протекали не достаточно быстро, чтобы служить фотокатализаторами. Однако когда эти частицы – наноразмера, то это уже другая история.
“Производительность для групп окиси кобальта (Co3O4), где кристаллы наноразмера были приблизительно в 1 600 раз выше чем для частиц размера микроном” - сказал Фреи, “и частота товарооборота (скорость) были приблизительно 1 140 молекул кислорода в секунду в группу, которая является соразмерной с солнечным потоком на уровне земли (приблизительно 1 000 ватт в квадратный метр).”
Фреи и Джиао использовали мезопоры кварца как эшафот, выращивая кобальтовые нанокристаллы в пределах естественной параллели наношкалу в каналах кварца через технику, известную как “влажное оплодотворение.” Лучшие исполнители имели форму прута кристаллами, измеряющими 8 нм в диаметре и 50 нм в длине, которые были связаны короткими мостами, чтобы сформировать связанные группы. Связки были сформированы как сфера диаметром 35 нм. В то время как каталитическая эффективность металла самого кобальта была важнее, Фреи сказал, что главным фактором после расширенной эффективности и скорости связок был их размер.
“Мы подозреваем, что сравнительно очень большая внутренняя область этих связок на 35 нм (где катализ имеет место) была главным фактором в увеличении их эффективности, - сказал он, потому что, когда мы произвели большие связки (диаметры на 65 нм), внутренняя область была уменьшена, и связки потеряли большую часть эффективности”.
Фреи и Джиао будут проводить далее исследования, чтобы получить лучшее понимание того, почему их окись кобальта - нанокристаллической группы (эффективные и быстродействующие фотокатализаторы), а также продолжат изучение других металлических окисных катализаторов. Следующий большой шаг, однако, должен будет объединить водное окисление с половиной реакции с уменьшением углекислого газа в искусственной системе, как в листе растения.
“Эффективность, скорость и размер нашей окиси кобальта группы нанокристаллов сопоставимы Фотосистеме II,” сказал Фреи. “Когда Вы исследуете в качестве фактора по производительности окись кобальта, стабильность нанокластера при использовании, низком электропотенциале и pH факторе и температурных условиях, мы полагаем, что имеем дело с многообещающим каталитическим компонентом, чтобы развить работоспособную интегрированную солнечную топливную конверсионную систему. Это - следующий важный вызов в области искусственного фотосинтеза для топливного производства”.
Исследовательский центр Энергии Солнца поддержан Директором американского Министерства энергетики.
«В основе искусственного фотосинтеза –
нанокристаллический композитный катализатор»
Исследователи из Национальной Лаборатории Лоуренса Беркли Министерства Энергетики США впервые синтезировали уникальный нанокристалл, демонстрирующий пример наличия двух межслойных каталитических интерфейсов типа «металл – оксид металла». Межслойные интерфейсы позволяют последовательно осуществлять множественные каталитические реакции, причем как выборочно, так и совместно. Разработка обеспечивает уникальные возможности для будущего промышленного катализа, а также для таких перспективных технологий экологически чистого производства энергии, как искусственный фотосинтез.
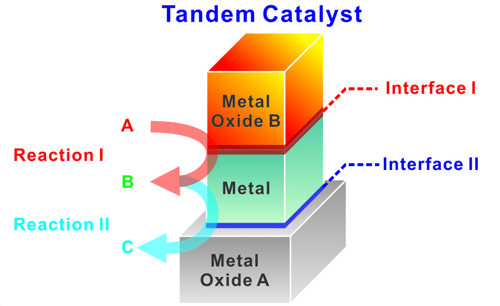
Рисунок 4. Структура инновационного решения.
«Демонстрация синтезированного наноскопического кристалла с несколькими межслойными интерфейсами типа «металл – оксид металла» представляет собой инновационный метод разработки высокопроизводительных, многофункциональных наноструктурированных катализаторов, обеспечивающих возможность многоступенчатых химических реакций», - говорит г-н Пейдон Янг, возглавляющий исследования.
Катализаторами называются вещества, которые ускоряют скорость химических реакций, не изменяя свой собственный состав. Они используются практически на любом производстве, где имеет место химический процесс. Достаточно долго металлические катализаторы были традиционным решение для этих целей, однако в последние годы большую актуальность приобретают инновационные нанокристаллические композитные структуры на основе металлов и их оксидов.
«Высокопроизводительные нанокатализаторы играют ключевую роль в развитии технологий преобразования и хранения энергии», - говорит г-н Янг. «Однако чтобы значительно улучшить возможности подобных структур, а также новых концепций их синтеза, необходимо введение межслойных интерфейсов типа «металл-оксид металла».
Исследования последних лет показали, что для нанокристаллов размер, форма и структура поверхности может оказывать значительное влияние на их каталитические свойства. Это позволяет более эффективно (по отношению к объемным аналогам) оптимизировать нанокристаллические катализаторы с целью обеспечения их избирательной активности. «Хорошо известно, что катализ может быть управляем с помощью различных металлооксидных компонентов, обладающих различной ориентацией кристаллической поверхности, - говорит г-н Янг, - точный выбор и контроль межслойного интерфейса «металл – оксид металла» обеспечивает наилучшую активность и селективность желаемой химической реакции».
Для выявления возможности многоступенчатой химической реакции ученые использовали метод Ленгмюра-Блоджетта, позволяющий выращивать монокристаллические пленки платины и оксида церия на подложке диоксида кремния. Пленки формировались путем нанесения крошечных наноскопических структур кубической формы (с ребром менее 10 нанометров); нанокубы наносились один на другой с целью получения «сэндвич»-подобной структуры с двумя разными межслойными интерфейсами «металл – оксид металла» (например, диоксид кремния – платина – оксид церия). Оба интерфейса затем использовались для активизации двух отдельных, последовательных химических реакций. Во-первых, интерфейс «платина – оксид церия» активировал образование оксида углерода и водорода из метанола. В дальнейшем продукты катализа проходили через гидроформилирование этилена – химическую реакцию, в свою очередь, катализируемую межслойным интерфейсом «платина – диоксид кремния». Конечным результатом этого двухстадийного процесса выступал альдегид пропионовой кислоты или пропаналь.
«Кубическая форма нанокристаллических слоев идеально подходит для сборки интерфейсов типа «металл – оксид металла» с большой площадью контакта», - говорит г-н Янг. «Интеграция бинарных нанокристаллов с целью формирования высоко упорядоченных сверхрешеток – это очень эффективный способ образования подобных интерфейсов, обладающих новыми функциональными возможностями».
Ученые утверждают, что концепция каталитического «тандема» (двойного катализа) представляется особенно актуальной для приложений, в которых критически важно выдерживать последовательность химических реакций. Ярким примером, иллюстрирующим подобную избирательность, является процесс искусственного фотосинтеза, при котором сначала требуются усилия, чтобы захватить энергию солнца, а затем преобразовывать ее в электричество.
«Искусственный фотосинтез, как правило, состоит из нескольких последовательных химических реакций (например, уменьшение количества воды, окисление, уменьшение углекислого газа), следующих одна за другой», - говорит г-н Янг. «Наша концепция в этом смысле способна обеспечить некоторые последовательности в фотоэлектрохимическом синтезе. Однако для этого нам придется изучить другие металлооксидные пары».
