
- •Введение
- •1. Структура атома. Изотопы. Изотоны. Изобары.
- •2. Основы квантовой механики строения атомов
- •2.1. Квантовый характер излучения и поглощения энергии. Постулат Планка.
- •2.2. Постулаты Бора
- •2.3. Двойственная или корпускулярно-волновая природа электрона
- •2.4. Принцип неопределенности Гейзенберга
- •3. Вероятность нахождения электрона в пространстве. Квантовые числа
- •4. Порядок заполнения электронами энергетических уровней и подуровней
- •4.1. Принцип наименьшей энергии
- •4.2. Принцип Паули
- •4.3. Правило Гунда
- •5. Электронные и квантово-графические формулы атомов элементов
- •Заключение
4. Порядок заполнения электронами энергетических уровней и подуровней
4.1. Принцип наименьшей энергии
Электрон занимает тот энергетический подуровень, на котором он обладает наименьшей энергией.
На основании изучения линейчатых спектров атомов была установлена следующая последовательность по энергии атомных орбиталей для многоэлектронных атомов:
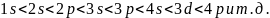
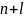 1+0;
2+0; 2+1; 3+0; 3+1; 4+0; 3+2; 4+1;
1+0;
2+0; 2+1; 3+0; 3+1; 4+0; 3+2; 4+1;
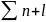 1;
2; 3; 3; 4; 4; 5;
5;
1;
2; 3; 3; 4; 4; 5;
5;
Для запоминания этого ряда удобно пользоваться правилами Клечковского.
В атоме электроны заполняют уровни и подуровни в направлении возрастания суммы главного и орбитального квантовых чисел
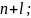
Если для двух различных уровней и подуровней сумма совпадает, то в первую очередь заполняется тот подуровень, у которого меньше значение главного квантового числа
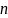 .
.
4.2. Принцип Паули
В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Пример.
2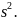
Если:
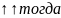
для первого электрона n=1, l=o, ml=0, ms=+1/2.
Для второго электрона n=1, l=o, ml=0, ms=+1/2,
при этом принцип Паули нарушается
Если:
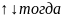
для первого электрона n=1, l=o, ml=0, ms=+1/2.
Для второго электрона n=1, l=o, ml=0, ms=-1/2,
при этом принцип Паули не нарушается.
Другими словами, каждая квантовая ячейка может быть занята не более, чем двумя электронами с противоположно направленными спинами.
Первое следствие из принципа Паули.
Максимальное число электронов на энергетическом уровне равно удвоенному значению квадрата главного квантового числа:
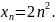
Второе следствие из принципа Паули.
Максимальное
число электронов на данном энергетическом
подуровне
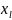 определяется выражением:
определяется выражением:
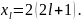
4.3. Правило Гунда
В пределах одного и того же подуровня заполнение орбиталей происходит таким образом, чтобы суммарный спин был максимальным.
Пример.
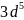 .
.
Если
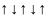 ,
тогда
,
тогда
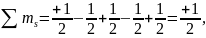 при этом правило Гунда нарушается.
при этом правило Гунда нарушается.
Если
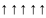 ,
тогда
,
тогда
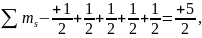 при этом правило Гунда не нарушается.
при этом правило Гунда не нарушается.
Другими словами, электроны в пределах одного и того же подуровня стремятся занять свободную орбиталь.
5. Электронные и квантово-графические формулы атомов элементов
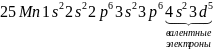 ;
;
Валентными называются электроны, участвующие в образовании химической связи.
4
3
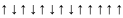 f
f
2
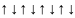 d
d
1 p
s
У
некоторых элементов (как правило,
имеющих электроны
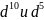 )
происходит так называемый «проскок»
электронов. Например, атом хрома имеет
конфигурацию внешнего уровня
)
происходит так называемый «проскок»
электронов. Например, атом хрома имеет
конфигурацию внешнего уровня
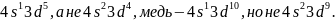
Заключение
Квантово-механические представления позволяют объяснить взаимодействия между электронами и ядром в атоме, между атомами – в молекуле, между атомами, ионами и молекулами в комплексных соединениях, газах, жидкостях и твердых телах. На базе квантово-механической теории получил дальнейшее развитие основополагающий закон химии – периодический закон Д.И. Менделеева.
