- •Введение
- •1. Структура атома. Изотопы. Изотоны. Изобары.
- •2. Основы квантовой механики строения атомов
- •2.1. Квантовый характер излучения и поглощения энергии. Постулат Планка.
- •2.2. Постулаты Бора
- •2.3. Двойственная или корпускулярно-волновая природа электрона
- •2.4. Принцип неопределенности Гейзенберга
- •3. Вероятность нахождения электрона в пространстве. Квантовые числа
- •4. Порядок заполнения электронами энергетических уровней и подуровней
- •4.1. Принцип наименьшей энергии
- •4.2. Принцип Паули
- •4.3. Правило Гунда
- •5. Электронные и квантово-графические формулы атомов элементов
- •Заключение
2.4. Принцип неопределенности Гейзенберга
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс микрочастицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств.
Принцип неопределенности Гейзенберга
Положение и скорость электронов не поддаются одновременному определению с абсолютной точностью:
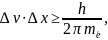
где
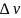 – ошибка в определении скорости,
– ошибка в определении скорости,
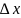 –
ошибка в определении координаты электрона
с массой
–
ошибка в определении координаты электрона
с массой
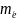 .
.
Если
бы удалось измерить координату частицы
так точно, что
 то ошибка в измерении импульса стала
бы бесконечно большой (и наоборот).
то ошибка в измерении импульса стала
бы бесконечно большой (и наоборот).
Чем точнее определены координаты микрочастицы, тем больше неопределенности в определении скорости и наоборот.
3. Вероятность нахождения электрона в пространстве. Квантовые числа
Таким образом, можно говорить только о вероятности нахождения электрона в данной части пространства. В связи с этим в квантовой механике состояние микрочастицы полностью описывается не ее координатой и скоростью, а некоторой функцией. Эта математическая величина называется волновой функцией или орбиталью и обозначается греческой буквой «пси» ψ.
Физический
смысл имеет не сама волновая функция,
а только произведение квадрата ее модуля
на элементарный объем
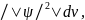 равное вероятности нахождения электрона
в элементарном объеме
равное вероятности нахождения электрона
в элементарном объеме
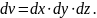
Часть пространства, где наиболее вероятно нахождение электрона, называется электронным облаком.
В 1927 г. австрийский физик Шрёдингер выводит уравнение, связывающее волновую функцию с потенциальной и полной энергией электрона. Не вдаваясь в анализ уравнения Шрёдингера, укажем, лишь, что решить его – значит найти удовлетворяющую ему волновую функцию ψ.
С точки зрения квантово-механической модели атома главное квантовое число можно определить следующим образом.
3.1. Главное квантовое число n характеризует размеры электронного облака и общий уровень энергии электрона в атоме.
n = 1, 2, 3, 4, 5, 6, 7
K, L, N, O, P, Q.
Состояние электрона в атоме, которое характеризуется определенным значением главного квантового числа n, называется энергетическим уровнем.
3.2. Орбитальное квантовое число l характеризует форму электронного облака.
s – облако p – облако d –облако f – облако


 имеет
более
имеет
более
 сложную
сложную

 форму
форму
l = 0 l = 1 l = 2 l = 3
На первом энергетическом уровне могут находиться только s – облака. Иными словами,
если n = 1, l = 0;
если n = 2, l = 0, 1;
если n = 3, l = 0, 1, 2;
если
n
=
4, l
=
0, 1, 2, 3, ⇒
 .
.
Состояние электрона, которое характеризуется определенным значением l, называется энергетическим подуровнем.
3.3.
Магнитное квантовое число
 характеризует
ориентацию электронного облака в
пространстве.
характеризует
ориентацию электронного облака в
пространстве.


Любые
возможные расположения s
– облака в пространстве идентичны,
поэтому s
– состоянию соответствует единственное
значение магнитного квантового числа





p-
облака могут располагаться в пространстве
тремя различными способами, поэтому
для p
- состояния возможны три различных
значения:

Для d – состояния возможны пять значений магнитного квантового числа, для f – состояния – семь значений (см. табл.3).
Таблица 3
Электронный подуровень |
Возможные значения |
Количество орбиталей |
Условное изображение |
1s |
0 |
1 |
|
2p |
-1, 0, +1 |
3 |
|
3d |
-2, -1, 0, +1, +2 |
5 |
|
4f |
-3, -2, -1, 0, +1,+2, +3 |
7 |
|
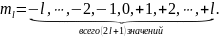
Энергии электронных облаков одного и того же размера и формы, но различным образом ориентированных в пространстве, начинают различаться только при наложении магнитного поля, отсюда и произошло название магнитного квантового числа.
Состояние электрона в атоме, характеризующееся определенными значениями s, l и , называется атомной электронной орбиталью или квантовой ячейкой.
Графически
орбиталь обозначается следующим
образом:

3.4
Спиновое квантовое число
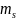 характеризует
вращение электрона вокруг собственной
оси
(spin
– волчок, юла). Более правильно говорить,
что
характеризует
собственный магнитный момент электрона.
характеризует
вращение электрона вокруг собственной
оси
(spin
– волчок, юла). Более правильно говорить,
что
характеризует
собственный магнитный момент электрона.
может
принимать два значения:
= +1/2 (обозначается
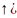 и
и
=
-1/2 (обозначается
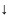 ).
).
Вышеуказанными четырьмя квантовыми числами можно полностью охарактеризовать всю совокупность сложных движений электрона в атоме. Однако заполнение электронами орбиталей происходит не беспорядочно, а в соответствии с определенными принципами.