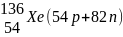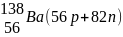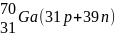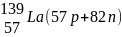- •Введение
- •1. Структура атома. Изотопы. Изотоны. Изобары.
- •2. Основы квантовой механики строения атомов
- •2.1. Квантовый характер излучения и поглощения энергии. Постулат Планка.
- •2.2. Постулаты Бора
- •2.3. Двойственная или корпускулярно-волновая природа электрона
- •2.4. Принцип неопределенности Гейзенберга
- •3. Вероятность нахождения электрона в пространстве. Квантовые числа
- •4. Порядок заполнения электронами энергетических уровней и подуровней
- •4.1. Принцип наименьшей энергии
- •4.2. Принцип Паули
- •4.3. Правило Гунда
- •5. Электронные и квантово-графические формулы атомов элементов
- •Заключение
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.т.н. Ю.Перелыгин
«____»______________ 2012 г.
ТЕКСТ ЛЕКЦИИ № 1
по дисциплине «Химия»
по специальности 200100 «Приборостроение»
Тема № 1. Строение атома и периодическая система химических элементов Д.И. Менделеева
Занятие № 1. Теория строения атома
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2012 г., протокол №_____
г. Пенза
Содержание
Введение
1. Структура атома. Изотопы, изобары, изотоны.
2. Основы квантовой механики строения атома.
3. Вероятность нахождения электрона в пространстве. Квантовые числа.
4. Порядок заполнения электронами энергетических уровней и подуровней.
5.Электронные и квантово-графические формулы атомов элементов.
Заключение.
Литература:
Коровин Н.В. Общая химия. Учебник. – М.: Высшая школа, 1998. – с. 17 -27.
Учебно – материальное обеспечение:
1. Мультимедийный проектор.
2. Плакаты «Изотопы. Изобары. Изотоны», «Энергетические уровни и подуровни атома».
3. Модели электронных облаков.
Цель занятия:
Знать: 1.Основные модели строения атома: планетарная модель Резерфорда, модель Бора. Квантово-механическая модель атома. Квантовые числа.
2.Атомная электронная орбиталь. Энергетические состояния электронов в атоме. Распределение электронов в многоэлектронном атоме. Принципы Паули, Гунда и наименьшей энергии. Ряд заполнений. Правила Клечковского.
Иметь представление: о корпускулярно-волновой природе электрона и о принципе неопределенности Гейзенберга.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы.
4.Рассмотреть учебные вопросы с применением кадров презентации и плакатов «Изотопы. Изобары. Изотоны» и «Энергетические уровни и подуровни атома».
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
Введение
Теория строения атома и теория природы химической связи позволяют понять и описать взаимоотношения атомов и молекул в составе вещества. Эти теории вместе с периодической системой Д. И. Менделеева лежат в основе современной химии.
1. Структура атома. Изотопы. Изотоны. Изобары.
К началу XX века было установлено, что атом не является неделимым, как считали раньше, а представляет собой сложную систему. Было показано, что атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Положительный заряд ядра компенсируется суммарным отрицательным зарядом электронов, так что атом, в целом, электронейтрален.
Согласно современным представлениям, атомные ядра состоят из элементарных частиц: протонов и нейтронов. В ядре сосредоточена почти вся атомная масса, так как масса электронов в сравнении с массами протонов и нейтронов пренебрежимо мала.
Таблица 1
Элементарная частица |
Масса частиц, а.е.м. |
Заряд частицы |
Протон p |
1,0073 |
+1 |
Нейтрон n |
1,0087 |
0 |
Электрон
|
1/1823 |
|
Сумма
числа протонов и нейтронов, содержащихся
в ядре атома, называется массовым числом
атома А. Так как массы протонов и нейтронов
примерно равны единице, а вся масса
атома сосредоточена в ядре, то и массовое
число атома приближенно равно его
относительной атомной массе Аr:
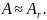
Число
протонов в ядре определяет величину
положительного заряда ядра, чему
соответствует порядковый номер элемента
Z.
Порядковый номер и массовое число атома
условились проставлять слева от индекса
элемента: порядковый номер – снизу,
массовое число – сверху, например,

Элементы, у которых ядра содержат одинаковое число протонов и разное число нейтронов, то есть, у которых порядковый номер одинаков, а массовые числа различны, называют изотопами (см. табл.2).
Еще
примеры изотопов:

Элементы, у которых ядра содержат разное число протонов и одинаковое суммарное число протонов и нейтронов, то есть у которых порядковые номера различаются, а массовые числа одинаковы, называются изобарами (табл.2).
Элементы, у которых ядра содержат одинаковое число нейтронов и разное число протонов, называются изотонами (табл.2).
Таблица.2
Изотопы |
Изобары |
Изотоны |
|
|
|
|
|
|
|
|
|
2. Основы квантовой механики строения атомов
Первую
экспериментально обоснованную модель
атома дал в 1911 году английский ученый
Резерфорд с сотрудниками на основе
анализа опытов по изучению рассеяния
 В модели Резерфорда, как уже упоминалось
выше, в центре атома находится положительно
заряженное ядро, в котором сосредоточена
почти вся атомная масса. Вокруг ядра
движутся электроны, число которых равно
величине заряда ядра или порядковому
номеру элемента. Подобная модель, являясь
по сути своей правильной, тем не менее
противоречит законам классической
электродинамики. Ведь движущийся
электрон должен непрерывно излучать
энергию и, в конце концов, упасть на
ядро. На самом деле этого, конечно, не
происходит.
В модели Резерфорда, как уже упоминалось
выше, в центре атома находится положительно
заряженное ядро, в котором сосредоточена
почти вся атомная масса. Вокруг ядра
движутся электроны, число которых равно
величине заряда ядра или порядковому
номеру элемента. Подобная модель, являясь
по сути своей правильной, тем не менее
противоречит законам классической
электродинамики. Ведь движущийся
электрон должен непрерывно излучать
энергию и, в конце концов, упасть на
ядро. На самом деле этого, конечно, не
происходит.
Недостаток модели Резерфорда заключался в том, что движение электронов описывалось законами классической физики, которые действительны для крупных физических тел или макрообъектов. Однако, как оказалось, законы движения элементарных частиц или микрообъектов принципиально отличаются от законов для макрообъектов. Поведение таких частиц изучают квантовые науки: квантовая химия, квантовая механика и т.д. Объяснять законы, которые действуют для микрообъектов, намного сложнее, чем законы, которым подчиняются макрообъекты. Почему это так? Дело в том, что объясняя законы физики и химии для микрообъектов, преподаватель может наглядно продемонстрировать обучаемым, как это все происходит, или же попросить студентов представить себе тот или иной процесс. В квантовой же химии многие процессы нельзя не только представить себе, но и доказать математически, их приходится принимать на веру, как постулаты. Напомним, что постулатами называются утверждения, принимаемые без доказательств или априори.

 1
1