
- •Биологическая химия (часть 2)
- •060101 – Лечебное дело
- •СОдержАние
- •I. Теоретическая часть
- •1. Обмен липидов
- •1.1. Классификация липидов
- •2. Гликолипиды (в основном гликосфинголипиды).
- •Липолиз триглицеридов в жировой ткани
- •1.3. Окисление жирных кислот
- •1. Активация жк.
- •2. Транспорт жк внутрь митохондрий.
- •3. Внутримитохондриальное окисление жирных кислот.
- •Окисление жк с нечетным числом углеродных атомов
- •Окисление ненасыщенных жирных кислот
- •Нарушения окисления жирных кислот
- •Обмен ацетил-КоА
- •1.4. Липогенез
- •Регуляция синтеза и распада жирных кислот
- •1.5. Метаболизм фосфолипидов
- •1.6. Незаменимые жирные кислоты. Эйкозаноиды
- •1.7. Обмен холестерина
- •Распространение и функции холестерина
- •Биосинтез холестерина
- •Обмен эфиров холестерина
- •Синтез желчных кислот
- •1.8. Регуляция липидного обмена
- •1.9. Нарушения липидного обмена
- •Контрольные вопросы
- •2. Обмен белков
- •2.1. Пути распада белков
- •2. Переваривание белков.
- •Реакции по карбоксильной группе
- •2. Образование аминоациладенилатов.
- •2.3. Обезвреживание аммиака в организме
- •Пути связывания аммиака
- •Фумарат пируват аспартат
- •2.4. Нарушения азотистого обмена
- •2.5. Специфические пути обмена некоторых аминокислот
- •2. Обмен серосодержащих аминокислот.
- •3. Обмен аминокислот с разветвленной цепью.
- •Лей, Иле, Вал α-кетокислоты ацил-КоА-производные
- •4. Обмен дикарбоновых аминокислот
- •5. Обмен диаминомонокарбоновых кислот.
- •6. Обмен фенилаланина и тирозина.
- •7. Обмен триптофана.
- •2.6. Обмен сложных белков. Обмен хромопротеинов
- •Распад гемоглобина в тканях (образование желчных пигментов)
- •Биосинтез гемоглобина
- •2.7. Обмен нуклеопротеинов
- •Аденин гипоксантин; гуанин ксантин
- •Синтез пиримидиновых нуклеотидов у, ц, т
- •Биосинтез пуриновых оснований а, г
- •Синтез дезоксирибонуклеотидов
- •Контрольные вопросы
- •3. Матричные биосинтезы
- •3.1. Биосинтез нуклеиновых кислот
- •3.1.1. Биосинтез днк (репликация)
- •Синтез днк на матрице рнк
- •3.1.2. Биосинтез рнк
- •Синтез рнк на матрице рнк
- •3.2. Биосинтез белка
- •Свойства генетического кода
- •Подготовительная стадия синтеза белка
- •3.2.1. Трансляция
- •1. Инициация трансляции.
- •2. Элонгация трансляции.
- •3. Терминация трансляции.
- •3.2.2. Постсинтетическая модификация белка
- •Транспорт синтезированных белков через мембраны
- •3.2.3. Регуляция синтеза белка
- •3.3. Генная инженерия
- •3. Конструирование рекомбинантной днк:
- •4. Клонирование (размножение) рекомбинантной днк:
- •1. Трансдукция.
- •Генотерапия - лечение заболеваний с помощью генов. Существует два типа генотерапии.
- •Контрольные вопросы
- •4. Гормоны, номенклатура, классификация
- •Основные гормоны человека
- •Контрольные вопросы
- •5. Взаимосвязь процессов обмена веществ в организме
- •Связь между обменом белков и углеводов
- •Связь между обменом белков и липидов
- •Связь между обменом углеводов и липидов
- •Уровни регуляции гомеостаза
- •Изменения обмена веществ при голодании
- •Контрольные вопросы
- •6. Минеральный и водно-солевой обмен
- •6.1. Вода в организме человека
- •6.2. Солевой обмен
- •7. Биохимия почек. Роль почек в регуляции водно-солевого обмена
- •7.1. Экскреторная функция почек
- •7.2. Гомеостатическая функция почек
- •7.3. Метаболическая функция почек
- •7.4. Регуляция водно-солевого обмена и мочеобразования
- •Контрольные вопросы
- •8. Биохимия нервной ткани
- •8.1. Особенности метаболизма нервной ткани
- •8.2. Механизм проведения нервного импульса
- •Контрольные вопросы
- •9. Биохимия мышечной ткани
- •9.1. Химический состав мышечной ткани
- •Химический состав сердечной мышцы и гладкой мускулатуры
- •Источники энергии для мышечной работы
- •9.2. Механизм мышечного сокращения и его регуляция
- •9.3. Биохимические изменения в мышцах при патологии
- •Контрольные вопросы
- •10. Биохимия межклеточного матрикса
- •10.1. Строение межклеточного матрикса
- •1. Коллагены.
- •3. Неколлагеновые структурные гликопротеины.
- •10.2. Особенности метаболизма межклеточного матрикса Катаболизм белков межклеточного матрикса
- •Репарация повреждений межклеточного матрикса в норме
- •Биохимические изменения соединительной ткани при старении
- •Поражения соединительной ткани
- •11. Биохимия крови
- •11.1. Дыхательная функция крови. Буферная система крови
- •11.2. Система свертывания крови. Изменения при патологии
- •Контрольные вопросы
- •12. Биохимия печени
- •12.1. Основные функции печени
- •Роль печени в метаболизме углеводов
- •Роль печени в липидном обмене
- •Роль печени в обмене белков и аминокислот
- •12.2. Желчеобразование. Пигментный обмен. Виды желтух
- •Распад гемоглобина:
- •12.3. Детоксицирующая функция печени
- •Контрольные вопросы
- •13. Регуляция обмена кальция и фосфора
- •14. Биохимия костной ткани
- •Контрольные вопросы
- •II. Лабораторный практикум Работа 1. Обмен липидов
- •Контрольные вопросы
- •Работа 2. Фосфолипиды. Холестерин
- •4.1. Реакция Шиффа.
- •4.2. Реакция Сальковского.
- •4.3. Реакция Либермана – Бурхарда.
- •Контрольные вопросы
- •Работа 3. Переваривание белков. Определение кислот желудочного содержимого
- •Контрольные вопросы
- •Работа 4. Конечные продукты азотистого обмена
- •Контрольные вопросы
- •Работа 5. Гормоны
- •4. Качественные реакции на 11-дегидро-17-оксикортикостерон (кортизон).
- •4.1. Реакция с сернокислым фенилгидразином.
- •4.2. Реакция с реактивом Фелинга.
- •Контрольные вопросы
- •Работа 6. Минеральный и водно-солевой обмен
- •1.1. Определение рН слюны.
- •1.2. Определение фосфатов в слюне.
- •2.1. Качественное определение хлоридов в моче.
- •2.2. Открытие ионов кальция в моче.
- •2.3. Открытие фосфатов в моче.
- •Контрольные вопросы
- •Работа 7. Биохимия мочи
- •1. Определение рН мочи универсальной индикаторной бумагой.
- •2. Определение неорганических составных частей мочи.
- •2.1. Открытие хлоридов в моче.
- •2.2. Открытие фосфатов в моче.
- •2.3. Открытие кальция и магния в моче.
- •2.4. Открытие аммонийных солей в моче.
- •3. Органические составные части мочи.
- •3.1. Качественное обнаружение и количественное определение белка в моче.
- •3.1.1. Проба кипячением в слабокислой среде.
- •3.1.2. Проба кипячением в кислой среде в присутствии насыщенного раствора поваренной соли.
- •3.1.3. Проба Геллера.
- •3.1.4. Проба с сульфосалициловой кислотой.
- •3.1.5. Количественное определение белка в моче по методу разведения (метод Брандберг – Робертс - Стольникова).
- •3.2. Полуколичественный метод определения глюкозы и кетоновых тел в моче с помощью тест-полосок.
- •3.3. Обнаружение кровяных пигментов в моче кипячением со щелочью (проба Геллера).
- •Контрольные вопросы
- •Работа 8. Биохимия крови
- •1. Буферные свойства сыворотки крови
- •2. Количественное определение общего белка сыворотки крови по биуретовой реакции
- •3. Определение кальция в сыворотке крови по методу де Ваарда.
- •Контрольные вопросы
- •Работа 9. Обнаружение желчных пигментов в моче
- •Контрольные вопросы:
- •Работа 10. Биохимия костной и соединительной ткани
- •1. Получение вытяжки из костной ткани и зуба.
- •Контрольные вопросы
- •Литература
Контрольные вопросы
1. Какие факторы определяют биологическую ценность пищевых белков?
2. Какие условия необходимы для переваривания белков в желудке?
3. Присутствие каких веществ в желудочном соке определяет его общую кислотность?
4. Как предотвращается действие пептидаз на клетки желудка и кишечника?
Работа 4. Конечные продукты азотистого обмена
Опыт 1. Биуретовая реакция на мочевину.
Главным конечным продуктом белкового обмена является мочевина. Синтез мочевины происходит в печени из аммиака и диоксида углерода в результате цепи последовательных реакций при участии АТФ. В норме за сутки с мочой человека при обычной смешанной пище выводится около 30 г мочевины (0,5 моль/сут). Увеличение количества мочевины в моче наблюдается при богатой белками пище и при заболеваниях, связанных с усиленным распадом собственных белков организма (лихорадка, гипертиреоз, диабет). Уменьшение выделения мочевины отмечается при пище, бедной белками, при заболевании почек, когда затруднено выделение мочевины, при заболеваниях печени, характеризующихся нарушением синтеза мочевины, при ацидозах в силу недостаточного синтеза мочевины вследствие образования большого количества аммонийных солей.
Несколько кристаллов мочевины помещают в сухую пробирку и расплавляют на пламени до начала затвердевания расплавленной массы. От мочевины отщепляется аммиак и образуется биурет. Аммиак обнаруживают по запаху и по посинению в парах красной лакмусовой бумажки, смоченной водой. Полученный в пробирке биурет охлаждают, затем растворяют в 0,5 мл 10% раствора гидроксида натрия и добавляют 1-2 капли 1% раствора сульфата меди. Розовое окрашивание обусловлено образованием комплексной медной соли биурета.
Опыт 2. Разложение мочевины под действием гипобромита натрия.
К 2-3 мл 5%-ного раствора мочевины приливают 1 мл свежеприготовленного раствора гипобромита натрия. Наблюдают выделение газа. Мочевина разлагается согласно уравнению:
![]()
Эту реакцию применяют для количественного определения мочевины в моче.
Опыт 3. Качественное обнаружение аминокислот в моче.
У взрослых здоровых людей за сутки выводится 100-400 мг аминокислот, что составляет 2% общего азота мочи. Аминоацидурия отмечается при заболеваниях печени с поражением паренхимы (гепатиты, цирроз, болезнь Боткина). Содержание аминокислот в моче повышается при заболеваниях, сопровождающихся распадом тканей. Усиленное выделение отдельных аминокислот наблюдается при врожденных и наследственных болезнях обмена веществ (фенилпировиноградная олигофрения, алкаптонурия и др.).
К 0,5 мл мочи добавляют 0,5 мл 0,2% раствора нингидрина в спирте, насыщенном ЭДТА (динатриевой солью этилендиаминтетрауксусной кислоты). Содержимое пробирки нагревают и наблюдают появление синего окрашивания, обусловленного образованием продукта взаимодействия аминокислот с нингидрином.
Опыт 4. Количественное определение аммиака в моче по Мальфатти.
Аммонийные соли образуются при нейтрализации аммиаком кислот, поступающих в организм извне или получающихся в организме в процессах обмена веществ. В виде аммонийных солей в норме с мочой за сутки выделяется 0,5-1,2 г аммиака. Выведение аммиака с мочой значительно увеличивается при заболеваниях, сопровождающихся ацидозом, например, при сахарном диабете, когда образуются кетоновые тела (ацетоуксусная кислота, -гидроксимасляная кислота) и увеличивается количество фосфорной и серной кислот в связи с усилением расщепления тканевых белков. Уменьшение количества аммиака в моче характерно для поражения почек за счет потери способности получать аммиак из глутамина.
Отмеряют в колбу 5 мл мочи, добавляют 25 мл дистиллированной воды, 2 капли раствора фенолфталеина и титруют 0,1 н. раствором гидрокисда натрия до появления слабо-розовой окраски. Этим достигается нейтрализация веществ кислотного характера, содержащихся в моче. Добавляют 2 мл формалина. Смесь обесцвечивается вследствие разложения аммиачных солей и появления в растворе кислоты.

Смесь вновь титруют 0,1 н. раствором NaOH до розового окрашивания. Количество израсходованных при последнем титровании миллилитров щелочи умножают на 0,0017 (титр 0,1 н. раствора аммиака) и получают массу аммиака во взятом для анализа объеме мочи. Рассчитайте, сколько аммиака выделилось с мочой за сутки, если ее суточный объем 1200 мл. Сделайте вывод о наличии или отсутствии ацидоза.
Опыт 5. Реакция на креатинин с нитропруссидом натрия (реакция Вейля).
Креатинин - один из конечных продуктов азотистого обмена. Он образуется в мышцах из креатинфосфата, который, в свою очередь, получается из креатина и АТФ. За сутки с мочой выделяется 0,5-2 г креатинина. Увеличение выделения креатинина наблюдается при повышенной мышечной деятельности, лихорадке, сахарном диабете и других заболеваниях, связанных с интенсивным распадом белков тканей организма. Выделение креатинина уменьшается при мышечной атрофии, прогрессирующем поражении почек и др.
а) К 0,5 мл мочи добавляют 1-2 капли 5% раствора нитропруссида натрия и добавляют 1-2 капли 10% раствора гидроксида натрия. Креатинин с нитропруссидом натрия Na2[Fe(CN)5NO] в присутствии щелочи дает изонитрозокреатинин красного цвета, но соединение нестойкое — красная окраска быстро переходит в желтую.
б) При добавлении к содержимому пробирки нескольких капель концентрированной уксусной кислоты (до кислой реакции) красная окраска сменяется желтой.
Опыт 6. Количественное определение креатинина в моче по цветной реакции Яффе (метод Поппера).
Креатинин, взаимодействуя с хиноидной формой пикриновой кислоты, образует пикрат креатинина, который в щелочной среде превращается в свою таутомерную форму, имеющую оранжево-красный цвет. Интенсивность окраски пропорциональна концентрации креатинина.
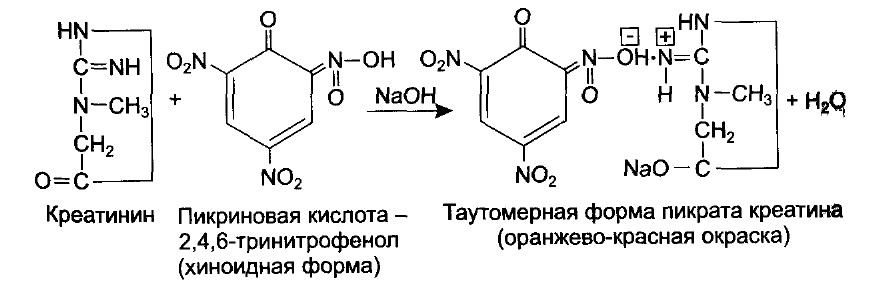
В мерную колбу на 100 мл отмеряют из суточного количества 0,5 мл мочи и 3 мл насыщенного раствора пикриновой кислоты. Встряхивают и добавляют 0,2 мл 10% раствора гидроксида натрия. На 10 минут оставляют при комнатной температуре, после чего дистиллированной водой доводят объем до 100 мл. Оптическую плотность измеряют на фотоэлектроколориметре в кювете с толщиной слоя 1 см при длине волны 510-560 нм (зеленый светофильтр) против контроля.
Одновременно ставят контрольную пробу. В мерной колбе на 100 мл смешивают 3 мл насыщенного раствора пикриновой кислоты и 0,2 мл 10% раствора гидроксида натрия, доводят водой до метки.
Стандартная проба. В мерную колбу на 100 мл наливают 0,5 мл основного стандартного раствора креатинина и 3 мл насыщенного раствора пикриновой кислоты. Встряхивают и прибавляют 0,2 мл 10% раствора гидроксида натрия. Далее пробы обрабатывают так же, как и опыт.
Расчет производят по формуле:
![]() ,
,
где х - количество креатинина в суточной моче, мг; Сст - количество креатинина в стандартной пробе, мг; Dоп — оптическая плотность опытной пробы; Dст - оптическая плотность стандартной пробы; Vсут - суточное количество мочи; V - количество мочи, взятой для анализа.
Полученные данные сопоставить с нормальными величинами содержания креатинина в суточной моче. В норме содержание креатинина в моче у мужчин равно 1-2 г/сут (8,8-17,7 ммоль/сут), у женщин - 0,8-1,8 г/сут (7,1-15,9 ммоль/сут).
