
- •Федеральное агенство по образованию
- •Киров 2006
- •Введение
- •1. Гомогеные и гетерогенные процессы
- •1.1. Разложение аммиачно-цинкового раствора
- •Получение оксида цинка разложением аммиачно-цинкового раствора может быть описано суммарными уравнениями реакций:
- •Описание установки
- •Порядок выполнения работы
- •Определение цинка в растворах и осадках
- •Обработка экспериментальных данных
- •Материальный баланс процесса получения оксида цинка из аммиаката:
- •2 Высокотемпературные процессы
- •2.1. Обжиг сульфидных руд
- •Описание установки и методика проведения работы
- •Обработка опытных данных и составление отчета
- •Результаты экспериментов и расчетов
- •3 Каталитические процессы
- •3.1. Каталитическое окисление сернистого ангидрида
- •Описание установки
- •4.Химико-технологические системы (хтс)
- •4.1. Подготовка воды.
- •4.2 Очистка промышленных сточных вод
- •Библиографический список
- •2.Правила обращения со стеклом
- •3.Правила безопасности при работе с нагревательными приборами
- •4. Противопожарные меры
- •5. Меры оказания первой помощи
3 Каталитические процессы
Катализом называется увеличение скорости химических реакций или возбуждение их при воздействии веществ - катализаторов, которые участвуют в реакции, вступая в промежуточное химическое взаимодействие с реагентами, но восстанавливают свой химический состав с окончанием акта катализа.
По принципу фазового состояния реагентов и катализатора каталитические процессы разделяют на две основные группы: гомогенные и гетерогенные.
При гомогенном катализе и катализатор, и реагенты находятся в одной фазе - газовой или жидкой. При гетерогенном катализе катализатор и реагенты или продукты реакции находятся в разных фазах.
Ускоряющее действие катализаторов состоит в понижении энергии активации химической реакции в результате изменения реакционного пути с участием катализатора или вследствие осуществления реакции по цепному механизму при инициирующем действии катализатора.
Все каталитические реакции, происходящие при гомогенном и гетерогенном катализе, делят по типу взаимодействия катализатора с реагирующими веществами на два основных класса: окислительно-восстановительное (гомолитическое) и кислотно-основное (гетеролитическое) взаимодействия.
Механизм окислительно-восстановительного катализа заключается в обмене электронами между катализатором и реагентами.
Механизм кислотно - основного катализа заключается в обмене протонами или ионами (катионами и анионами) между катализатором и реагирующими молекулами.
Образующиеся промежуточные активированные комплексы неустойчивы и распадаются или реагируют с другой молекулой. В обоих случаях катализатор регенерируется.
3.1. Каталитическое окисление сернистого ангидрида
Основной
стадией контактного способа производства
серной кислоты является окисление SO![]() в SO
в SO![]() .
Контактное окисление диоксида серы
является гетерогенным каталитическим
процессом, идущим с выделением тепла.
.
Контактное окисление диоксида серы
является гетерогенным каталитическим
процессом, идущим с выделением тепла.
Равновесие обратимой реакции:
2SO2 + О2 2 SO3 + 2·96,7 кДж (500°С)
в соответствии с принципом Ле Шателье сдвигается в сторону образования SO3 при понижении температуры и повышении давления.
Реакция гомогенного некаталитического окисления SO3 происходит крайне медленно вследствие малой вероятности столкновения трех молекул и большой энергии активации Е>300 кДж/моль. Поэтому в производстве серной кислоты диоксид серы окисляют на катализаторах. Из сотен катализаторов, ускоряющих процесс, в промышленности используются три: 1) металлическая платина; 2) оксид железа; 3) пятиоксид ванадия.
Наиболее
активным катализатором является платина,
но из-за дороговизны и легкой отравляемости
примесями обжигового газа данный
катализатор заменен на менее активный,
но более дешевый и устойчивый к контактным
ядам ванадиевый катализатор. Ванадиевая
контактная масса содержит в среднем 7%
V2O![]() ,
активатор К2О,
носителем служат пористые алюмосиликаты.
Ванадиевая контактная масса эксплуатируется
при t
=400-600°С. При увеличении температуры выше
600°С начинается необратимое снижение
активности катализатора вследствие
изменения структуры зерна и состава
активного компонента. При понижении
температуры активность катализатора
резко снижается вследствие образования
малоактивного сульфата ванадия VOSO4.
,
активатор К2О,
носителем служат пористые алюмосиликаты.
Ванадиевая контактная масса эксплуатируется
при t
=400-600°С. При увеличении температуры выше
600°С начинается необратимое снижение
активности катализатора вследствие
изменения структуры зерна и состава
активного компонента. При понижении
температуры активность катализатора
резко снижается вследствие образования
малоактивного сульфата ванадия VOSO4.
Процесс катализа состоит из стадий:
1) диффузии реагирующих компонентов из ядра газового потока к гранулам, а затем в порах контактной массы;
2) сорбции кислорода катализатором (передача электронов от катализатора к атомам кислорода);
3) сорбции молекул SО2 с образованием комплекса SO2О.катализатор;
4) перегруппировки электронов с образованием комплекса SO .катализатор;
5) десорбции SO3;
6) диффузии SO3 из пор контактной массы и от поверхности зерен.
Равновесная степень превращения SO2 в SO3 или равновесный выход SO c повышением температуры уменьшается.
Равновесный выход SO3 в зависимости от концентрации реагирующих веществ для соответствующей температуры определяют по уравнению:
хр=
где хр- равновесный выход SO3;
р - общее давление газа, Па;
а - содержание SO2 в газовой смеси до начала окисления, об.% ;
b - содержание кислорода в той же смеси, об.%;
К![]() - константа равновесия, принятая в
технологии серной кислоты:
- константа равновесия, принятая в
технологии серной кислоты:
![]()
![]() парциальные
давления соответствующих компонентов
в состоянии равновесия.
парциальные
давления соответствующих компонентов
в состоянии равновесия.
При 400°С и ниже реакция окисления сернистого газа практически необратима. При температуре порядка 1000ºС SO3 почти полностью диссоциирует на диоксид серы и кислород. С точки зрения полноты превращения диоксида серы в триоксид серы надо было бы выбрать возможно более низкую температуру. Но при температурах ниже 400°С скорость реакции неприемлемо низка.С повышением температуры константа скорости реакции возрастает, но при этом константа равновесия и соответственно равновесная степень окисления диоксида серы уменьшаются. В связи с этим каждой степени окисления соответствует оптимальное значение температуры, отвечающее максимальной скорости.
На рис.3 показана зависимость выхода продукта от температуры при разном времени соприкосновения реагирующих веществ с катализатором, обладающего определенной температурой зажигания при прочих постоянных условиях технологического режима.
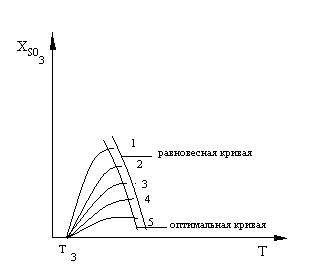
Рис. 3. Зависимость выхода продукта экзотермической реакции от температуры при различном времени контактирования на данном катализаторе,
![]() (Р,
С1,
C2i
= const)
(Р,
С1,
C2i
= const)
Т — температура зажигания катализатора
Максимальный
выход SO3
для
данного времени соприкосновения газа
с катализатором получается при
определенной оптимальной температуре.
Чем меньше время соприкосновения
![]() ,
тем выше оптимальная температура.
Соединив максимальные выходы, можно
получить оптимальную кривую, показывающую,
что с увеличением
и х следует понижать температуру для
достижения максимальной скорости
процесса и степени превращения.
,
тем выше оптимальная температура.
Соединив максимальные выходы, можно
получить оптимальную кривую, показывающую,
что с увеличением
и х следует понижать температуру для
достижения максимальной скорости
процесса и степени превращения.
Таким образом, в контактных аппаратах для достижения максимальной скорости процесса следовало бы начинать его при возможно более высоких температурах, около 600°С, проводить по кривой оптимальных температур и заканчивать при 400°С. Для этого необходим предварительный подогрев газа и непрерывный отвод теплоты по ходу каталитического процесса.
Целью данной работы является исследование влияния рабочего режима установки (температуры, состава газовой смеси, объемной скорости газового потока) на степень контактирования, а именно:
при постоянных значениях состава газовой смеси и объемной скорости газового потока установить зависимость степени контактирования от температуры.
